4-(N-芳基)胺基-6-长链烷氧基取代蝶啶类化合物的合成及其抗肿瘤活性
2018-03-20许秀枝陈垚昊李柱来
林 锦,王 旭,王 艰,许秀枝,陈垚昊,李柱来*
(1福建医科大学药学院药物化学系,福州 350122;2福州外国语学校,福州 350007)
恶性肿瘤是威胁人类健康的主要疾病之一,因此研发高效的抗肿瘤药物是许多医药工作者不断追求的目标。传统的抗肿瘤药物主要是直接作用于DNA的合成及修复、细胞有丝分裂等生理过程,存在实体肿瘤疗效差、不良反应大、易产生耐药性等问题。随着分子生物学和基因工程的快速发展,肿瘤细胞内的信号传导也得到了深入的研究并逐步被人们所了解。其中蛋白酪氨酸激酶(protein tyrosine kinases,PTKs)是细胞内信号传导通路的重要调节因子[1-2]。PTKs通过特异性地催化三磷酸腺苷(adenosine triphosphate,ATP)末端磷酰基转移,使底物酪氨酸残基上的羟基磷酸化,调节下游信号级联反应从而调控细胞增殖、迁移、分化等生理过程。PTKs的活性在正常细胞中受到严格的控制,但是由于突变或结构变化导致PTKs的异常表达则会导致包括肿瘤等多种疾病。因此在抗肿瘤药物的设计中,PTKs被视为理想的药物作用靶标。
另一方面,蝶啶类化合物是生物体内一类重要的杂环化合物,因其最初从蝴蝶翼翅中发现而得名。蝶啶类化合物已被广泛应用作为受体拮抗剂、杀菌剂、抗心律不齐药、抗肿瘤试剂、利尿剂等,其中最具代表性的甲氨蝶呤是临床上常用的抗肿瘤药物。值得一提的是,研究人员已开始从事将蝶啶类化合物作为PTKs抑制剂用于肿瘤治疗的相关工作,包括治疗非小细胞肺癌的靶点EGFR[3]及治疗急性髓细胞样白血病的靶点FLT3[4]等。因此,前人对于蝶啶结构药物开发方面的工作基础,对本研究工作极具参考价值。
本研究在前人工作基础上利用生物电子等排原理,将长链的烷氧基引入蝶啶的6位C原子,以期提高目标化合物的脂溶性,利用多种取代苯胺对蝶啶的4位C原子氨基化,提高目标化合物与PTKs疏水区域的结合能力。如图1和表1所示,通过6步反应合成一系列4-(N-芳基)胺基-6-长链烷氧基取代蝶啶类化合物,采用核磁共振波谱、质谱等手段进行结构表征,并利用MTT法进行体外抗肿瘤活性实验。通过生物活性实验对目标分子的构效关系进行研究,为后续的研究以及未来该类型药物的实际应用提供有力的支撑。
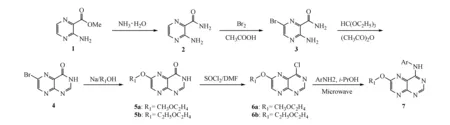
Figure1 Synthetic route of substituted pteridines
1 实验部分
1.1 试剂和细胞株
3-氨基吡嗪-2-羧酸甲酯(广拓化学科技有限公司)青霉素、链霉素、DMEM培养基(美国Thermo Fisher公司);胎牛血清(杭州四季青生物工程材料有限公司);胰蛋白酶(美国Amresco公司);MTT试剂(北京庄盟国际生物基因科技有限公司);F-12K培养基(美国Sigma公司);其余均为市售分析纯试剂。
人胃癌细胞HGC-27、人非小细胞肺癌A549、人急性髓性白血病细胞KG1a(福建医科大学药理实验室)。
1.2 仪 器
Multiskan Mk3酶标仪model 550(美国Thermol Labsystems公司);立式(超)低温冰箱(美国Forma Scientific公司);96孔培养板(美国Corning Incorporated公司);倒置显微镜(日本Olympus公司);WRS-1B数字熔点仪(上海精密科学仪器有限公司);Avance III核磁共振仪(瑞士Bruker Biospin);质谱仪(美国Thermo Finnigan公司);Sybyl-X1.3药物辅助设计程序。
Table1 Chemical structures of target compounds

ProductR1Ar7aCH3OCH2CH22⁃chloro⁃4⁃bromo⁃phenyl7bCH3OCH2CH22⁃chloro⁃5⁃nitro⁃phenyl7cCH3OCH2CH22⁃nitro⁃4⁃chloro⁃phenyl7dCH3OCH2CH22⁃fluoro⁃4⁃chloro⁃phenyl7eCH3OCH2CH22⁃fluoro⁃4⁃nitro⁃phenyl7fCH3OCH2CH22⁃chloro⁃5⁃bromo⁃phenyl7gCH3OCH2CH22,4⁃dichloro⁃phenyl7hCH3OCH2CH22⁃bromo⁃4⁃chloro⁃phenyl7iCH3OCH2CH23⁃nitro⁃4⁃chloro⁃phenyl7jCH3CH2OCH2CH22⁃chloro⁃4⁃bromo⁃phenyl7kCH3CH2OCH2CH22⁃chloro⁃5⁃nitro⁃phenyl7lCH3CH2OCH2CH22⁃chloro⁃5⁃bromo⁃phenyl
2 化学合成
3-氨基吡嗪-2-甲酰胺(2) 在250 mL三颈圆底烧瓶中,加入3-氨基吡嗪-2-羧酸甲酯23.02 g(0.15 mol)和浓氨水200 mL,常温搅拌10 h,反应完毕后,抽滤,将滤饼用少量水淋洗,后用少量无水乙醇淋洗,干燥,得化合物2为淡黄色粉末17.91 g。收率:86.5%;mp:236.7~237.6 ℃(文献值:238~239 ℃[5])。
3-氨基-6-溴吡嗪-2-甲酰胺(3) 在装有磁力搅拌子、回流冷凝管和恒压滴液漏斗的500 mL的三颈圆底烧瓶中,加入化合物2(13.82 g,0.10 mol)和冰醋酸150 mL。通过恒压滴液漏斗缓慢滴加2 mol/L 溴/冰醋酸溶液5 mL(16 g,0.1 mol,溶于冰醋酸50 mL),1 h内滴加完毕,每15 min手动剧烈振摇二颈瓶,控制水浴锅温度在20 ℃以下,待滴加完毕后,室温继续搅拌3 h。将上述反应混合物倒入冰水600 mL中,析出大量淡黄色固体,置入冰箱冷却30 min,抽滤。将滤饼用少量冰水洗涤,后用少量无水乙醇淋洗,干燥,得化合物3为黄色固体19.10 g。产率:88.4%;mp:214.2~216.3 ℃(文献值:212~213℃[6])。
6-溴-4(3H)-蝶啶酮(4) 将化合物3(21.63 g,0.1 mol)加入干燥的250 mL二颈圆底烧瓶中,加入新蒸醋酸酐100 mL和干燥除水后的原甲酸三乙酯100 mL,加热回流3 h,回流开始温度135 ℃,每20 min降低反应温度5 ℃,125 ℃时反应 1 h,后继续每20 min降低反应温度5 ℃,直至降低至95 ℃继续反应20 min,停止加热,将反应液冷却至室温,抽滤,得到棕灰色粗品粉末。将粗品用异丙醇-水(1∶1)混合液500 mL加热溶解后,加入活性炭约4 g脱色30 min,热过滤,将滤液冷却至室温后慢慢析出絮状物,再置于冰箱冷却2 h,析出大量白色絮状物。抽滤,将滤饼用少量水淋洗,后用少量无水乙醇淋醇洗,干燥,得化合物4为淡黄白色固体17.56 g。产率:77.7%;mp:256.3~257.5 ℃(文献值:237~238 ℃[7])。
6-甲氧乙氧基-4(3H)-蝶啶酮(5a) 在100 mL二颈圆底烧瓶中,加入干燥乙二醇单甲醚30 mL,金属钠1 g(约43.4 mmol),室温搅拌至金属钠完全溶解,制备乙二醇单甲醚的钠盐溶液。加入化合物4(4.54 g,20 mmol),搅拌3 h,反应完毕后,将上述反应液倒入水10 mL中,用4 mol/L HCl调节pH至3~4,析出大量白色固体,冷却,抽滤,真空干燥,得化合物5a为白色絮状固体3.67 g。产率:82.7%;mp:236.6~237.8 ℃(文献值:236.5~237 ℃[8])。
6-乙氧乙氧基-4(3H)-蝶啶酮(5b) 制备方法同化合物5a合成,用无水乙二醇乙醚代替无水乙二醇甲醚进行反应,得化合物5b为白色固体,产率81.1%;mp:263.1~264.8 ℃。ESI-MSm/z:235.10[M-H]-;1H NMR(DMSO-d6,400 MHz)δ:8.71(1H,s,pteridine H-2),8.24(1H,s,pteridine H-7),4.52~4.50(2H,m,CH2),3.77~3.75(2H,m,CH2),3.51(2H,q,J=7.0 Hz,CH2),1.12(3H,t,J=7.0 Hz,CH3).13C NMR(DMSO-d6,100 MHz)δ:160.33,157.51,150.86,146.31,143.10,129.83,67.71,66.29,65.65,15.07。
4-(芳香氨基)-6-烷氧基蝶啶(7) 在50 mL二颈圆底烧瓶中,加化合物5a(2.22 g,10 mmol),二氯亚砜10 mL,滴加无水DMF 3滴,搅拌下加热回流3 h,使原料完全反应为止。减压蒸馏除去二氯亚砜,油泵真空干燥30 min,冷却后得棕黄色固体。将其缓慢加入到冰水10 mL中,加入NaHCO3调节pH至7,继续搅拌10 min,抽滤,真空干燥,得6-甲氧乙氧基-4氯蝶啶(化合物6a)为淡黄色固体1.87 g。由于化合物6a在空气中极易吸水并水解生成4,6-二羟基蝶啶,因此直接将干燥所得固体投入下一步反应。将前一步所获得淡黄色固体与芳香胺(10 mmol)和异丙醇150 mL共同加入250 mL单口圆底烧瓶中,均匀搅拌数min,置于微波反应器中反应,单口圆底烧瓶瓶口接球形冷凝管,球形冷凝管上端接装有无水氯化钙干燥管,调节反应功率和反应时间,优选出最佳的反应条件。薄层色谱(TLC)跟踪反应完毕后,冷却至25 ℃,加入水约250 mL,用乙酸乙酯萃取(150 mL)3次,浓缩有机相,得淡黄色粗品,将粗品用少量二氯甲烷溶解,硅胶柱色谱分离(乙酸乙酯-石油醚,1∶4~1∶2梯度洗脱),获得最终产物7a~7i。化合物7j~7l的合成制备方法同化合物6a,用化合物5b代替化合物5a反应,得到6-乙氧乙氧基-4-氯蝶啶(6b)。之后亦直接将反应固体投入下一步反应,得最终产物7j~7l。
化合物7a~7l的结构表征如下所示。
4-(2-氯-4-溴苯基氨基)-6-甲氧乙氧基蝶啶(7a) 淡黄色固体,产率:42.2%;mp:210.3~216.4 ℃;ESI-MSm/z:407.99[M-H]-;1H NMR(DMSO-d6,400 MHz)δ:9.74(1H,s,NH),8.92(1H,s,pteridine H-2),8.68(1H,s,pteridine H-7),8.20(1H,d,J=8.7 Hz,Ar-H),7.91(1H,d,J=2.3 Hz,Ar-H),7.67(1H,dd,J=8.7 Hz,2.3Hz,Ar-H),4.69~4.71(2H,m,CH2),3.80~3.78(2H,m,CH2),3.34(3H,s,CH3);13C NMR(DMSO-d6,100 MHz)δ:157.54,156.95,155.06,149.71,146.30,134.69,131.78,130.98,126.58,121.34,117.21,116.01,69.73,66.60,58.24。
俄罗斯将人工智能和机器人技术的管理级分为国际、联邦、地区、市县4级。民用人工智能系统和机器人技术的防御能力按俄联邦民法129页执行,禁止涉足武器/军事技术、隐私问题。
4-(2-氯-5-硝基苯基氨基)-6-甲氧乙氧基蝶啶(7b) 淡黄色固体,产率:43.5%;mp:165.0~167.6 ℃;ESI-MSm/z:375.10[M-H]-;1H NMR(DMSO-d6,400 MHz)δ:9.78(1H,s,NH),9.30(1H,d,J=2.8 Hz,Ar-H),8.95(1H,s,pteridine H-2),8.80(1H,s,pteridine H-7),8.06(1H,dd,J=8.8 Hz,2.6 Hz,Ar-H),7.92(1H,d,J=8.8 Hz,Ar-H),4.68~4.70(2H,m,CH2),3.80~3.82(2H,m,CH2),3.35(3H,s,CH3);13C NMR(DMSO-d6,100 MHz)δ:157.10,154.92,149.76,146.77,136.08,132.60,132.32,130.79,121.43,120.17,118.32,118.00,69.68,66.74,58.26。
4-(2-硝基-4-氯苯基氨基)-6-甲氧乙氧基蝶啶(7c) 黄色粉末,产率:49.5%;mp:170.2~174.1 ℃;ESI-MSm/z:375.10[M-H]-;1H NMR(CDCl3,400 MHz)δ:9.57(1H,d,J=9.2 Hz,Ar-H),8.99(1H,s,NH),8.89(1H,s,pteridine H-2),8.37(1H,s,pteridine H-7),7.79(1H,dd,J=9.2 Hz,2.5 Hz,Ar-H),7.74(1H,d,J=8.1 Hz,Ar-H),4.81~4.83(2H,m,CH2),3.93~3.95(2H,m,CH2),3.50(3H,s,CH3);13C NMR(CDCl3,100 MHz)δ:157.69,157.13,155.39,146.84,136.48,130.09,128.15,127.69,126.00,123.42,122.57,116.20,70.32,67.60,59.40。
4-(2-氟-4-氯苯基氨基)-6-甲氧乙氧基蝶啶(7d) 黄色粉末,产率:47.8%;mp:174.5~177.8 ℃;ESI-MSm/z:348.10[M-H]-;1H NMR(CDCl3,400 MHz)δ:8.89(1H,s,NH),8.85~8.81(2H,m,pteridine H-2,Ar-H),8.76(1H,s,pteridine H-7),7.26~7.22(2H,m,Ar-H),4.67~4.69(2H,m,CH2),3.88~3.90(2H,m,CH2),3.50(3H,s,CH3);13C NMR(CDCl3,100 MHz)δ:157.35,157.00,155.89,154.05,150.22,146.30,128.64,125.83,125.09,122.57,121.88,116.07,70.31,67.00,59.47。
4-(2-氟-4-硝基苯基氨基)-6-甲氧乙氧基蝶啶(7e) 淡黄色固体,产率:50.2%;mp:156.1~159.4 ℃;ESI-MSm/z:359.15[M-H]-;1H NMR(CDCl3,400 MHz)δ:9.81(1H,s,NH),8.88(1H,s,pteridine H-2),8.59(1H,s,pteridine H-7),7.82(1H,t,J=8.5 Hz,Ar-H),7.61(1H,dd,J=10.4 Hz,2.4 Hz,Ar-H),7.39(1H,d,J=8.6 Hz,Ar-H),4.72~4.74(2H,m,CH2),3.76~3.78(2H,m,CH2),3.34(3H,s,CH3);13C NMR(CDCl3,100 MHz)δ:157.61,156.57,155.55,150.46,147.08,134.07,133.38,132.69,121.95,121.28,120.32,111.05,70.25,67.24,59.50。
4-(2-氯-5-溴苯基氨基)-6-甲氧乙氧基蝶啶(7f) 黄色粉末,产率:46.6%;mp:176.5~178.1 ℃;ESI-MSm/z:408.00[M-H]-;1H NMR(CDCl3,400 MHz)δ:9.33(1H,s,NH),9.27(1H,d,J=2.3 Hz,Ar-H),8.96(1H,s,pteridine H-2),8.84(1H,s,pteridine H-7),7.33(1H,d,J=8.5 Hz,Ar-H),7.22(1H,dd,J=8.5 Hz,2.3 Hz,Ar-H),4.68~4.70(2H,m,CH2),3.88~3.90(2H,m,CH2),3.50(3H,s,CH3);13C NMR(CDCl3,100 MHz)δ:157.31,156.67,155.76,150.05,146.32,136.01,130.23,126.91,123.64,121.91,121.80,121.51,70.22,67.03,59.44。
4-(2,4-二氯苯基氨基)-6-甲氧乙氧基蝶啶(7g) 黄色粉末,产率:61.7%;mp:84.2~185.5 ℃;ESI-MSm/z:364.05[M-H]-;1H NMR(CDCl3,400 MHz)δ:9.32(1H,s,NH),9.12(1H,d,J=2.5 Hz,Ar-H),8.94(1H,s,pteridine H-2),8.83(1H,s,pteridine H-7),7.38(1H,d,J=8.6 Hz,Ar-H),7.06(1H,dd,J=8.6 Hz,2.5 Hz,Ar-H),4.68~4.70(2H,m,CH2),3.88~3.91(2H,m,CH2),3.50(3H,s,CH3);13C NMR(CDCl3,100 MHz)δ:157.12,156.53,155.59,149.95,146.15,135.66,133.62,129.77,123.77,121.75,120.92,120.66,70.06,66.85,59.28。
4-(2-溴-4-氯苯基氨基)-6-甲氧乙氧基蝶啶(7h) 黄色粉末,产率:76.5%;mp:175.0~178.4 ℃;ESI-MSm/z:401.15[M+H]+;1H NMR(DMSO-d6,400 MHz)δ:9.71(1H,s,NH),8.91(1H,s,pteridine H-2),8.69(1H,s,pteridine H-7),8.33(1H,d,J=8.8 Hz,Ar-H),7.91(1H,d,J=2.4 Hz,Ar-H),7.58(1H,dd,J=8.8 Hz,2.4 Hz,Ar-H),4.67~4.70(2H,m,CH2),3.78~3.81(2H,m,CH2),3.34(3H,s,CH3);13C NMR(CDCl3,100 MHz)δ:157.34,156.95,155.79,150.05,146.27,134.93,132.12,129.03,128.83,122.02,113.98,100.18,70.25,67.07,59.48。
4-(4-氯-3-硝基苯基氨基)-6-甲氧乙氧基蝶啶(7i) 黄色粉末,产率:50.4%;mp:172.8~175.3 ℃;ESI-MSm/z:401.15[M+H]+;1H NMR(CDCl3,400 MHz)δ:8.91(1H,s,NH),8.84(1H,s,pteridine H-2),8.65~8.60(2H,m,pteridine H-7,Ar-H),8.12(1H,dd,J=9.0 Hz,2.6 Hz,Ar-H),7.58(1H,d,J=8.9 Hz,Ar-H),4.69~4.71(2H,m,CH2),3.88~3.90(2H,m,CH2),3.50(3H,s,CH3);13C NMR(CDCl3,100 MHz)δ:157.50,156.95,155.73,150.42,148.24,146.75,197.91,132.48,124.54,121.49,121.32,117.03,76.95,67.22,59.60。
4-(2-氯-5-硝基苯基氨基)-6-乙氧乙氧基蝶啶(7k) 淡黄色固体,产率:68.5%;mp:160.2~164.4 ℃;ESI-MSm/z:389.15[M-H]-;1H NMR(DMSO-d6,400 MHz)δ:9.83(1H,s,NH),9.30(1H,d,J=2.7 Hz,Ar-H),8.97(1H,s,pteridine H-2),8.81(1H,s,pteridine H-7),8.09(1H,dd,J=8.8 Hz,2.7 Hz,Ar-H),7.94(1H,d,J=8.8 Hz,Ar-H),4.68~4.71(2H,m,CH2),3.83~3.86(2H,m,CH2),3.55(2H,q,J=7.0 Hz,CH2),1.28(3H,t,J=7.0 Hz,CH3);13C NMR(CDCl3,100 MHz)δ:157.36,156.50,155.49,150.04,147.30,146.67,135.81,129.67,128.76,121.70,118.20,115.59,67.96,67.20,67.04,15.14。
4-(2-氯-5-溴苯基氨基)-6-乙氧乙氧基蝶啶(7l) 淡黄色固体,产率:54.9%;mp:161.2~167.5 ℃;ESI-MSm/z:424.30[M+H]+,1H NMR(DMSO-d6,400 MHz)δ:9.83(1H,s,NH),9.29(1H,d,J=2.7 Hz,Ar-H),8.97(1H,s,pteridine H-2),8.81(1H,s,pteridine H-7),8.09(1H,dd,J=8.8 Hz,2.7 Hz,Ar-H),7.94(1H,d,J=8.9 Hz,Ar-H),4.68~4.71(2H,m,CH2),3.83~3.86(2H,m,CH2),3.55(2H,q,J=7.0 Hz,CH2),1.14(3H,t,J=7.0 Hz,CH3).13C NMR(DMSO-d6,100 MHz)δ:157.41,156.73,155.65,150.13,146.24,136.25,130.17,126.87,123.53,121.79,121.92,121.63,70.11,67.01,59.39,15.30。
3 抗肿瘤活性评价
3.1 细胞的培养
A549细胞、HGC-27细胞、KG1a细胞培养于含10%胎牛血清F-12K的培养液中,加入100 U/mL链霉素和10 μg/mL青霉素。当细胞处于分裂生长状态时,将细胞接种于25 mL的培养瓶中,在37 ℃、5% CO2、饱和湿度的培养箱中培养。每隔2~3天换一次培养液。待瓶中细胞长满后,再进行传代,冻存。
3.2 药物浓度梯度的配制
精密称取样品4 mg,用DMSO稀释成0.5 mL,过0.22 μm微孔滤膜除菌后,精密移取20 μL,用DMEM培养基1 980 μL稀释100倍,得80 μg/mL药品供试液。再经DMEM培养基稀释后得到浓度梯度分别为80,40,20,10,5,2.5,1.25 μg/mL的药品供试液。
3.3 药物对肿瘤细胞生长的抑制作用
收集对数期的A549细胞、KG1a细胞和HGC-27细胞,调整细胞悬液浓度,在每个孔中加入100 μL,铺板使A549细胞、KG1a细胞和HGC-27细胞密度达到每孔1×104个。细胞贴壁24 h后再给药,吸弃培养基,每孔加入“3.2”项各浓度的药物供试液100 μL,同时设3个复孔。5% CO2、37 ℃孵育48 h后,在倒置显微镜下观察细胞形态。在每个孔中加入MTT溶液10 μL,37 ℃孵育2 h后终止培养。同时设置阴性对照孔(与最高浓度药物溶液相同浓度的DMSO溶解介质、培养液、细胞、MTT)、空白对照孔(培养液、细胞、MTT)和调零孔(MTT、培养液)。用酶标仪测量每一个孔的吸收度A450,计算生长抑制率。用相同药物的不同浓度对肿瘤细胞生长抑制率作图,得到剂量-抑制率反应曲线,根据Prism 5软件计算出该药物的半数抑制浓度IC50。
4 结果与讨论
4.1 目标化合物的设计
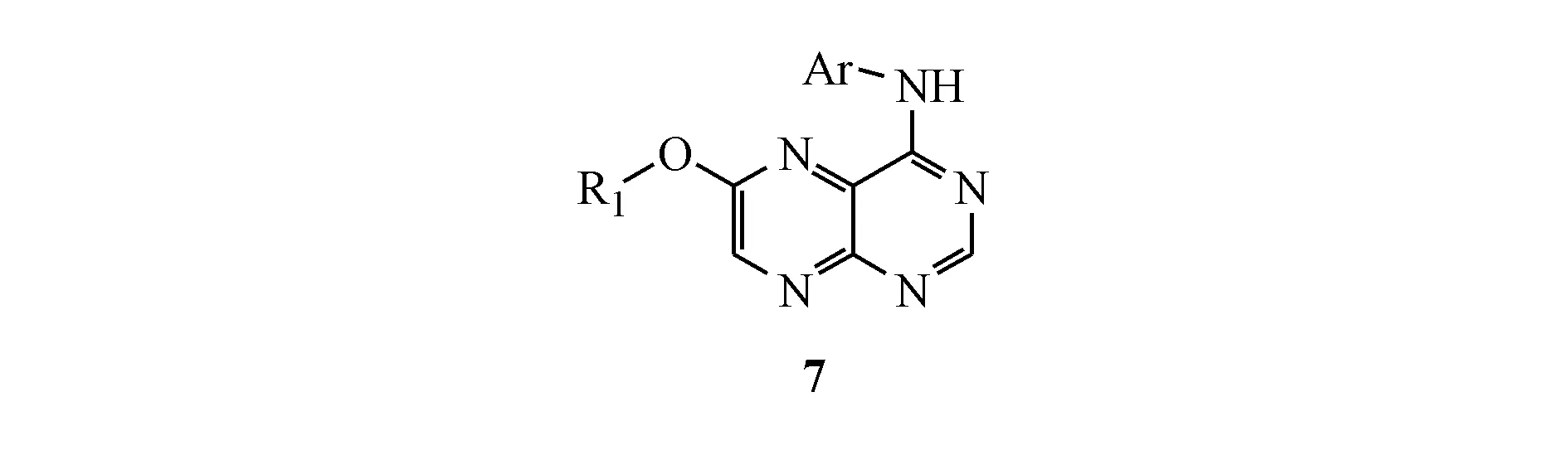
在设计目标化合物时,本研究以文献中表皮生长因子受体(epidemal growth factor receptor,EGFR)与厄洛替尼的结合模型为参考模板。首先,通过分析临床应用的抑制剂厄洛替尼(erlotinib)和吉非替尼(gefitinib)(图2),可以发现它们的母核都是喹唑啉环。两者的主要的结构区别是在喹唑啉环的4号位为(N-芳基)胺基,6、7号位的为不同结构的基团取代,结构的差异能够改变小分子抑制剂的电荷分布以及亲疏水性能。
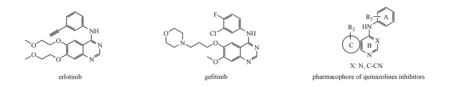
Figure2 Chemical structures of erlotinib,gefitinib and pharmacophore of quinazolines inhibitors
结合喹唑啉类抑制剂的药效团结构(图2)以及查阅的文献资料[9-11]发现,厄洛替尼的喹唑啉环占据了疏水腔Ⅰ(由Leu694、Val702、Val718、Thr766~Cys773、Leu820等氨基酸残基构成)。喹唑啉母环上的1-N原子与Met769成氢键;而3-N原子以一个水分子为桥梁,和受体的Thr766氨基酸残基相互作用形成氢键。喹唑啉母环上的4位取代芳香胺占据了疏水腔Ⅱ(由Ile720、Lys721、Glu738、Met742、Leu764、Thr766、Thr830~Gly833等氨基酸残基构成)。取代芳香胺上的3位乙炔基指向受体内部;喹唑啉母环上的6,7-位烷氧基取代位于ATP结合腔开口处,指向水相,并不与受体表面结合。开口处附近有EGFR蛋白所特有的氨基酸残基Cys773,但它并未参与受体与厄洛替尼的相互作用。
基于以上结果,推测喹唑啉类酪氨酸激酶抑制剂各片段在结合受体时的作用,归结如下:(1)喹唑啉的母核芳香环B、C骈合后占据疏水腔Ⅰ,对应于ATP的嘌呤环;(2)为使候选药物具有生物活性,环B上的1-N原子和X片段须与相应氨基酸残基形成氢键,从而使药物进入受体后可稳固结合并具备与ATP竞争结合受体的能力;(3)芳香环C的作用是固定环B在疏水腔Ⅰ中的取向,其为五元环或六元环,并且具有结构优化的修饰位点;(4)当抑制剂与受体结合时,取代苯环A进入疏水腔Ⅱ,而ATP结合时并未利用此空腔。取代苯环A上的基团R1为亲脂性基团,以卤素原子较为适合,因为其体积适中疏水腔Ⅱ形成疏水-疏水相互作用;(5)当环C上的取代基R2基团为6,7位取代的烷氧基或烷胺基侧链时,抑制剂对ErbB2亚型选择性较好。这些基团不进入受体结合区域,而是处于水相介质中,是调节化合物理化性质进而改善其结合常数的重要改造位点,如化合物的水溶性等。
以吉非替尼和厄洛替尼为先导化合物,根据生物电子等排原理,将先导化合物中的母核喹唑啉环用蝶啶环替代。为了改善母核环上的电荷密度和新设计的化合物亲疏水性能,使其更能被靶标分子(受体酪氨酸激酶)识别,对蝶啶母核进行结构修饰,将两种长链烷氧基(甲氧乙氧基和乙氧乙氧基)引入蝶啶环6位上,通过烷氧基的供电子效应增加蝶啶环上的1-N与3-N的电荷密度,从而促进氢键的生成;同时由于用N原子取代喹唑啉5,8位的C原子形成蝶啶环后,增加了生成氢键的概率。与先导化合物的结构类似,在6-烷氧基取代蝶啶的4位引入含有疏水基团的芳香胺,芳香环上的卤原子取代基增加了目标化合物的疏水性,以期提高目标化合物的疏水性能,从而增加所设计的目标化合物与靶标分子的结合能力并提高其生物活性。
利用计算机辅助药物设计程序(Sybyl-X1.3)对目标化合物与PTKs进行分子对接(Surflex-Dock)。以化合物7b与EGFR(PDB code 1M17)为例,其结果如图3所示。化合物7b的蝶啶4位苯胺基处于由氨基酸残基Val702、Ala719、Lys721、Glu738、Met742、Leu764、Thr766、Asp831组成的疏水腔内(图3-A),这为苯胺上的亲脂性取代基(-Cl、-NO2)与该区域内的疏水性氨基酸残基形成疏水作用创造了条件。此外,还发现化合物7b蝶啶环的3位N与Lys721残基上的氨基氢形成氢键(图3-B)。
4.2 抗肿瘤活性研究
本实验选用人非小细胞肺癌细胞A549、人急性髓性白血病细胞KG1a和人胃癌细胞HGC-273种肿瘤细胞株作为受试对象,利用MTT法来测定所合成的12个目标化合物以及1个对照物(吉非替尼)的体外抑制活性,结果如表2所示。
5 结 论
本实验研究结果表明,蝶啶4位为2-氯-5-硝基苯胺基取代时,其活性均高于其他取代苯胺基取代的产物。对于人非小细胞肺癌细胞A549,化合物7b活性最高,IC50为11.55 μmol/L,活性接近阳性对照物吉非替尼的IC50(5.95 μmol/L),与其他化合物相比均有显著性差异(P<0.05)。此外化合
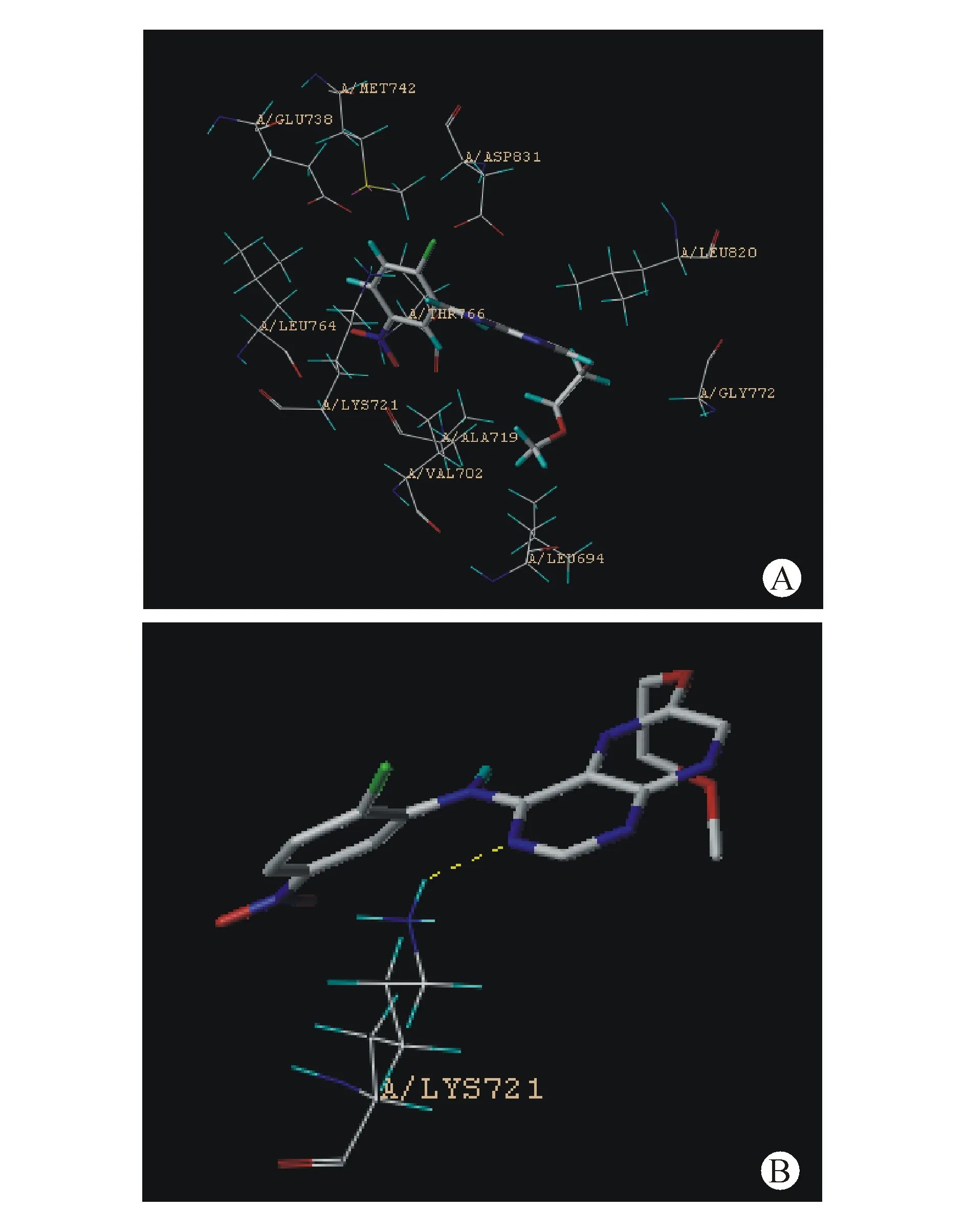
Figure3 Docking pose of compound7bbound to EGFR(A) and the binding mode of compound7bbound to EGFR(B)
Table2 IC50of compounds7a-7l

CompdIC50/(μmol/L)A549KG1aHGC⁃277a5102±40719279±1590>194817b1155±57116576±563>212347cNoinhibition17571±385Noinhibition7d>2287323068±1604>228737e8473±133210228±133513419±34447f14716±48757542±20948920±25847gNoinhibition21682±2075Noinhibition7hNoinhibition19262±138114302±41157iNoinhibition>21234Noinhibition7j>1883813003±5588>188387k2490±9496991±8144023±8067l10855±587317886±1837NoinhibitionGefitinib595±0544222±6312211±1313
物7k对人非小细胞肺癌细胞A549、人急性髓性白血病细胞KG1a和人胃癌细胞HGC-27均有良好的药物活性,对3组细胞的IC50均接近吉非替尼的IC50,与其他化合物相比均有显著性差异(P<0.05)。究其原因,可以从两个方面进行讨论:(1)根据以往文献中的报道[12-13],硝基存在与受体中的氨基酸残基形成氢键的潜在可能;(2)由于硝基具有较强亲脂性(疏水性)[14],可与激酶疏水结合区域之间形成强疏水作用。通过生物活性试验筛选出的化合物均有2-氯-5-硝基苯胺基片段,以此结构为参考进行优化,为开发一类新型酪氨酸激酶抑制剂奠定基础。
[1] Gschwind A,Fischer OM,Ullrich A.The discovery of receptor tyrosine kinases targets for cancer therapy[J].NatRevCancer,2004,4(5):361-370.
[2] Chahrour O,Cairns D,Omran Z.Small moleculekinase inhibitors as anti-cancer therapeutics[J].MiniRevMedChem,2012,12(5):399-411.
[3] Zhou W,Liu X,Tu Z,etal.Discovery of pteridin-7(8H)-onebased irreversible inhibitors targeting the epidermal growth factor receptor (EGFR) kinase T790M/L858R mutant[J].JMedChem,2013,56(20):7821-7837.
[4] Sun D,Yang Y,Lyu J,etal.Discovery and rational design of pteridin-7(8H)-one-based inhibitors targeting FMS-like tyrosine kinase 3 (FLT3) and its mutants[J].JMedChem,2016,59(13):6187-6200.
[5] Ellingson RC,Henry R,McDonald FG,etal.Derivatives 3-aminopyrazinoic acid[J].JAmChemSoc,1945,67(10):1711-1713.
[6] Albert A,Ohta K,Studies P,etal.New routes to 4-aminopteridines via 3-(dimethylaminomethyleneamino)pyrazine-2-carbonitrile and related compounds[J].JChemSoc,1971,22:3727-3730.
[7] Li MD.Design,Synthesis and structure-activity-relation study of novel anti-cancer compounds targeted on protein tyrosine kinase(作用于酪氨酸激酶的抗肿瘤小分子抑制剂的设计与合成)[D].Nanjing:Southeast University,2007.
[8] Duan C,Jia J,Zhu R,Wang J.Synthesis ofN-substituted-6-alkoxypteridin-4-amine[J].JHetChem,2012,49(4):865-872.
[9] Traxler P,Furet P.Strategies toward the design of novel and selective protein tyrosine kinase inhibitors[J].PharmacolTher,1999,82(2/3):195-206.
[10] Lawrence DS,Niu J.Protein kinase inhibitors:the tyrosine-specific protein kinases[J].PharmacolTher,1998,77(2):81-114.
[11] Stamos J,Sliwlowski MX,Eigenbrot C.Structure of the epidermal growth factor receptor kinase domain alone and in complex with a 4-anilinoquinazoline inhibitor[J].JBiolChem,2002,277(48):46265-46272.
[12] Sun J,Li D,Li J,etal.Design,synthesis,biological evaluation,and molecular modeling study of 4-alkoxyquinazoline derivatives as potential VEGFR2 kinase inhibitors[J].OrgBiomolChem,2013,11(44):7676-7686.
[13] Qin X,Li Z,Yang L,etal.Discovery of new[1,4]dioxino[2,3-f]quinazoline-based inhibitors of EGFR including the T790M/L858R mutant[J].BioorgMedChem,2016,24(13):2871-2881.
[14] Debnath AK,Hansch C.Structure-activity relationship of genotoxic polycyclic aromatic nitro compounds:further evidence for the importance of hydrophobicity and molecular orbital energies in genetic toxicity[J].EnvironMolMutagen,1992,20(2):140-144.
