参桂保心方对慢性心力衰竭大鼠基质金属蛋白酶2、基质金属蛋白酶抑制剂1、B型脑钠肽及心室重构的影响
2018-03-20卢玉俊赵信科代晶晶
卢玉俊,赵信科,代晶晶
(甘肃中医药大学附属医院心血管临床医学中心,兰州 730000)
慢性心力衰竭 (chronic heart failure,CHF) 是多种心血管疾病的最终归宿,整个过程伴随着心室重构。心肌细胞外基质 (extracellular matrixc,ECM) 降解增加是心室重构的重要特征之一。降解ECM的基质金属蛋白酶 (matrix metalloproteinases,MMP) 对于心室重构具有重要的影响,尤其是MMP-2在降解ECM的主要成分Ⅳ型胶原中有“钻头”的作用。金属蛋白酶组织抑制剂1 (tissue inhibitor of matrix metalloproteinase-1,TIMP-1) 能抑制MMP-2的活性,影响ECM的降解。B型脑钠肽 (brain natriuretic peptide,BNP) 是心脏神经内分泌激素,为临床诊断CHF、判断CHF严重程度的敏感指标。
中医认为,阳气虚衰、血瘀水停是CHF的基本病机,因此益气温阳、活血利水为治疗心力衰竭的基本大法[1]。参桂保心方主要成分为太子参、桂枝、茯苓皮、白术、猪苓、泽泻、红花、丹参、葶苈子、大枣、麦冬和五味子。方中太子参补气养阴,桂枝温阳化气行水,茯苓皮健脾渗湿利水,白术健脾助运燥湿,猪苓、泽泻利尿消肿;红花、丹参活血化瘀,葶苈子、大枣泻肺平喘、利水消肿、强心,麦冬养阴润肺,五味子敛肺补气,全方具有益气温阳、活血利水之功效。研究[2]表明,参桂保心方可能具有减少MMP-2表达、降低BNP水平等作用。
本研究通过观察参桂保心方对CHF大鼠MMP-2、TIMP-1、BNP水平及其对心脏组织病理学的影响,探讨该药对CHF大鼠心室重构的抑制作用及其机制。
1 材料与方法
1.1 实验材料
1.1.1 动物:10周龄 SPF 级雄性 SD 大鼠( 体质量180~220 g) 90只。由甘肃中医药大学科研实验中心提供,合格证号为SCXK( 甘) 2015-0002。
1.1.2 试剂:异丙基肾上腺素( isoprenaline,ISO) 购自北京Solarbio公司,批号:20160722。
1.1.3 药物:芪苈强心胶囊购自石家庄以岭药业公司,国药准字Z20040141;参桂保心煎剂由甘肃中医药大学附属医院煎药中心提取制备。
1.2 动物分组、造模及给药
90只大鼠适应性饲养半个月,随机分为2组,实验组75只,腹腔注射ISO 3 mg/ (kg·d) ,连续4周[3];对照组15只,腹腔注射生理盐水1 mL。4周后应用超声心动图 (ESAOTE彩超,意大利百胜公司) ,探头频率10 MHz,深度3 cm,测定值为5个心动周期的均值,检测左室射血分数≤50%,认为CHF模型成功[4],见图1。将75只实验组大鼠随机分为模型组,芪苈强心组,参桂保心高、中、低剂量组,每组各15只。参桂保心组按高、中、低剂量 (相当于成人每kg体质量用量的24、12和6倍)[5]药物灌胃,芪苈强心组以芪苈强心胶囊[0.42 g/ (kg·d) ]灌胃,对照组及模型组以等量生理盐水灌胃,时间为8周。
1.3 心胸比率测定
12周后,将6组大鼠用10%水合氯醛3 mL/kg腹腔注射麻醉,将大鼠仰卧置于Carestream多功能活体成像系统暗箱 (美国柯达公司) ,获取大鼠胸部正位X线影像。测量心脏最大横径 (T1+T2) 、胸廓最大横径 (T) ,计算出心胸比率。心胸比率= (T1+T2) /T,正常值≤0.5。见图2。
图2 各组大鼠心胸比率Fig.2 Cardiothoracic ratio of the rats in each group
1.4 BNP测定
大鼠颈动脉取血3 mL,离心20 min (3 000 r/min) ,分离血清,采用双抗体夹心酶联免疫吸附法 (大鼠脑钠肽ELISA试剂盒,武汉基因美生物科技公司,批号JYM0445Ra) 测定大鼠血清BNP水平,严格按照说明书步骤操作。
1.5 心脏组织病理学检查
在乳头肌水平下方室间隔及左心室游离壁取心肌组织3块,于10%甲醛中固定24 h,常规脱水,包埋,切片,HE染色。光镜下观察并进行病理学评分: (1) 心肌纤维有无肥大、变性、坏死; (2) 间质有无充血、水肿、炎症细胞浸润、结缔组织增生; (3) 心内膜、心外膜有无充血、水肿、炎症细胞浸润。将上述病变由轻到重分别评分为1、2、3、4分,无病变为0分[6],累加所有分数进行统计学处理。
1.6 免疫组化法检测心肌MMP-2和TIMP-1表达
取包埋过的左心室中段心肌组织,用免疫组化法检测MMP-2、TIMP-1。操作步骤严格按照试剂盒说明书 (美国ImmunoWay公司,批号YT2798、YT4658)进行。胞膜、胞质有黄至棕黄色颗粒者为蛋白阳性细胞。取组化切片于光镜下400倍放大,随机选取5个视野,用多功能彩色图像分析系统测量其灰度值,取平均值,灰度值越低表明浓度越高[7]。
1.7 Western blotting检测心肌MMP-2和TIMP-1蛋白表达水平
称取心肌组织约100 mg,加入冰预冷的适量细胞裂解液,制成心肌细胞均浆。冰上裂解40 min,4 ℃,12 000 r/min,离心20 min,收集上清,按照说明书进行定量测定。采用Western blotting法检测MMP-2、TIMP-1蛋白的表达( 美国ImmunoWay公司,批号YT2798、YT4658) 。上样量80 μ g,12%聚丙烯酰胺凝胶电泳分离,电转移至PVDF膜上;一抗稀释浓度1∶100,ECL检测试剂盒显影,洗片。以 β-actin(1∶200稀释) 杂交作为内参照。目的蛋白条带与β-actin蛋白条带灰度值的比值,即为蛋白的相对定量值[8]。
1.8 统计学分析
2 结果
2.1 心胸比率测定
与对照组比较,模型组心胸比率明显增加 ( P <0.05) 。与模型组比较,各药物组均能减低心胸比率(P < 0.05) ,其中芪苈强心组和高剂量组减低心胸比率尤为明显,且与中、低剂量组比较差异有统计学意义 (P < 0.05) 。见表1。
表1 各组大鼠心胸比率和BNP的比较Tab.1 Comparison of cardiothoracic ratios and BNP levels among the rats in all the groups
2.2 血清BNP测定
与对照组比较,模型组BNP明显升高 (P < 0.05) 。与模型组比较,各药物组均能降低BNP水平 ( P <0.05) ,其中芪苈强心组和高剂量组降低BNP尤为明显,且与中、低剂量组比较差异具有统计学意义 ( P <0.05) 。见表1。
2.3 心脏组织病理学检查
2.3.1 HE染色:对照组心肌细胞排列整齐,细胞核呈卵圆形,着色较浅无深染,未见心肌细胞肥大,间质无炎症细胞浸润;模型组细胞排列疏松,横纹不清楚,心肌纤维及间质发生坏死,细胞水肿,胞质着色变浅,细胞核出现深染改变,有炎症细胞浸润;参桂保心高、中、低剂量组和芪苈强心组心肌细胞肥大、炎症细胞浸润、心肌纤维走形等均得到不同程度的改善。见图3。
图3 各组大鼠心脏组织HE染色 ×100Fig.3 Hematoxylin-eosin staining of the heart tissue of the rats in each group ×100
2.3.2 病理评分:与对照组比较,模型组病理评分明显增加 (P < 0.05) 。与模型组比较,各药物组病理评分均有所改善 (P < 0.05) ,其中芪苈强心组和高、中剂量组优于低剂量组 (P < 0.05) 。见表2。
表2 各组大鼠心脏病理评分的比较Tab.2 Comparison of the cardiac pathological scores among the rats in all the groups
2.4 免疫组化检测心肌MMP-2和TIMP-1蛋白表达
对照组心肌细胞仅有极少量标记,散在分布,胞质呈淡黄色。模型组阳性心肌细胞胞质染色程度较强,呈棕黄色或棕褐色,表达面积广泛融合。各药物治疗组阳性细胞染色程度及面积低于模型组,高于正常组。见图4、5。
MMP-2和TIMP-1表达的免疫组化结果显示,蛋白表达多少与灰度值大小成反比,免疫结果着色越深,蛋白表达越强,灰度值越小。MMP-2表达方面,与对照组比较,模型组MMP-2表达明显增加,故模型组灰度值明显低于对照组 (P < 0.05) 。与模型组比较,各药物组蛋白表达均有减少 (P < 0.05) 。与芪苈强心组比较,高剂量组优于芪苈强心组 (P < 0.05) 。TIMP-1表达方面,与对照组比较,模型组TIMP-1表达明显减少,模型组灰度值明显高于对照组 ( P < 0.05) 。与模型组比较,芪苈强心组和高剂量组蛋白表达均有增加 (P < 0.05) 。见表3。
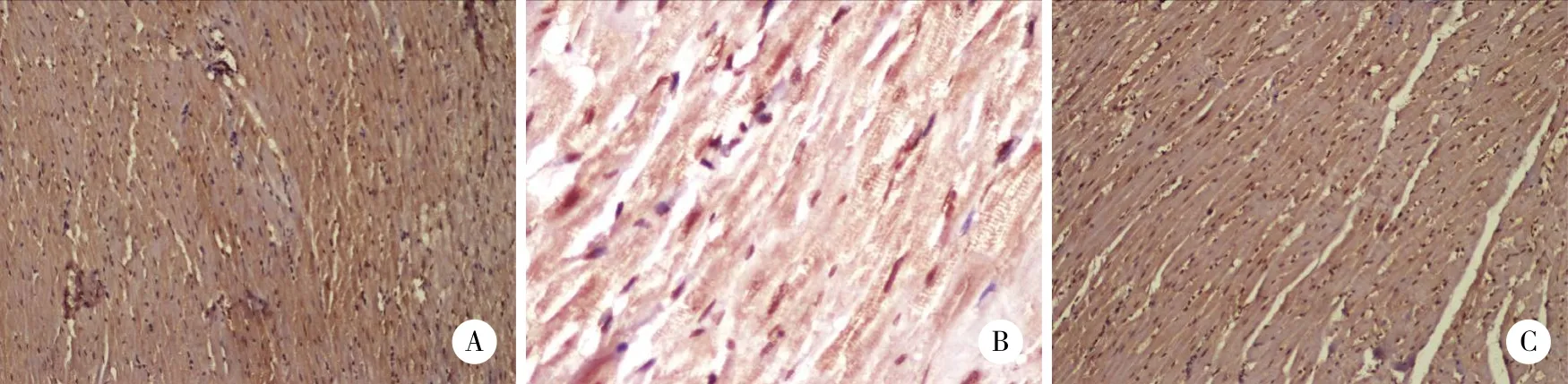
图4 各组大鼠心肌MMP-2蛋白表达 ×400Fig.4 MMP-2 protein expression in the myocardium of the rats in each group ×400
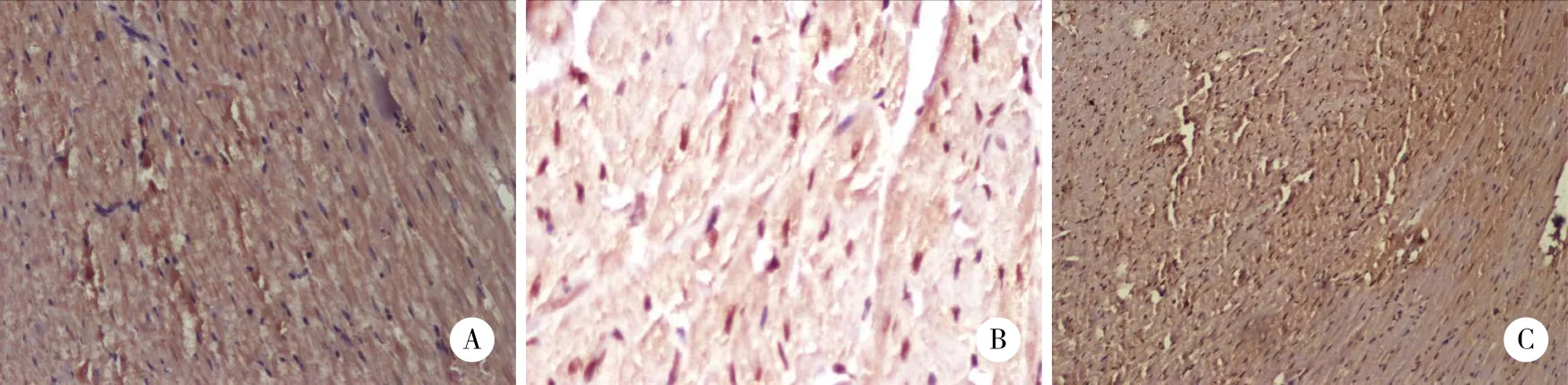
图5 各组大鼠心肌TIMP-1蛋白表达 ×400Fig.5 TIMP-1 protein expression in the myocardium of the rats in each group ×400
2.5 Western blotting检测MMP-2和TIMP-1蛋白表达水平及MMP-2/TIMP-1比值
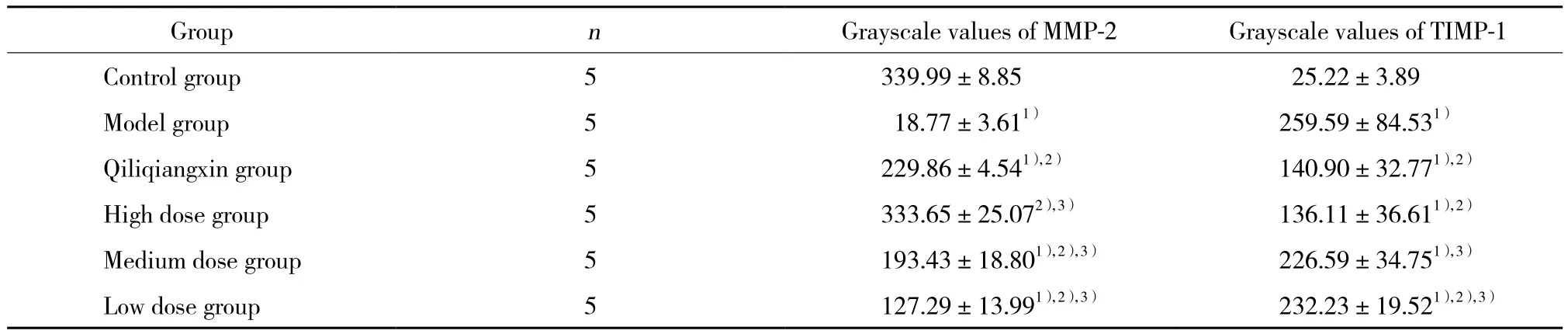
表3 各组大鼠MMP-2和TIMP-1表达的灰度值比较Tab.3 Comparison of grayscale values of MMP-2 and TIMP-1 expressions among the rats in all the groups
2.5.1 各组大鼠心肌MMP-2蛋白表达水平:与对照组比较,模型组MMP-2表达水平明显增高 ( P < 0.05) 。与模型组比较,芪苈强心组和高、中剂量组MMP-2表达水平均有所降低 (P < 0.05) ,其中高剂量组优于芪苈强心组和中剂量组 (P < 0.05) 。见图6、表4。
2.5.2 各组大鼠心肌TIMP-1蛋白表达水平:与对照组比较,模型组MMP-2/TIMP-1比值明显增高 (P <0.05) 。与模型组比较,芪苈强心组和高剂量组MMP-2/TIMP-1比值均有所降低 (P < 0.05) 。见图6、表4。
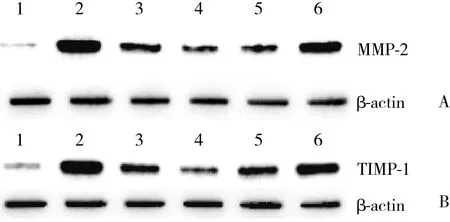
图6 各组大鼠心肌MMP-2、TIMP-1蛋白表达水平Fig.6 MMP-2 and TIMP-1 protein expressions in the myocardium of the rats in all the groups
3 讨论
CHF的主要发病机制是心室重构,而ECM的合成与降解失衡是心室重构的重要方面。研究[9]证明,MMP-2在慢性心衰心肌中的表达量及活性显著增加,使胶原网络发生重构,最终导致心室扩大,这些表明MMP-2直接参与了心室重构过程。TIMPs是MMPs特异性内源抑制因子,通过阻断MMPs与底物结合,抑制MMPs的活性,其中TIMP-1主要抑制MMP-2的活性。MMP-2/TIMP-1的动态平衡是维持ECM合成与降解平衡的重要因素,随着MMP-2活性升高,TIMP-1活性降低[10]。

表4 各组大鼠心肌MMP-2、TIMP-1蛋白表达水平及MMP-2/TIMP-1的比较Tab.4 Expression of MMP-2,TIMP-1 protein in myocardium of rats in each group and comparison of MMP-2/TIMP-1
BNP是一种心脏神经内分泌激素,CHF时心室壁张力增加、容量负荷增重等因素均可导致其分泌,其生理作用主要有利尿排钠、扩张血管、抑制心室重构等。BNP水平与心力衰竭的严重程度呈正相关,国内外多个心衰指南均将其作为诊断心力衰竭、判断心力衰竭严重程度及预后的敏感指标。
本研究结果显示,在心胸比率及BNP方面,治疗后各组均有下降,芪苈强心及高剂量组尤为明显,提示中药具有减轻容量负荷、改善心功能的作用;在HE染色方面,治疗后各组细胞水肿、炎性浸润、病理评分等均有不同程度的改善,提示中药具有保护心肌细胞、抑制心室重构的作用;在蛋白表达方面,治疗后各组MMP-2表达均有减少,其中高剂量组优于芪苈强心组。治疗后芪苈强心和高剂量组MMP-2/TIMP-1比值均有降低且优于其他各组,提示参桂保心方可能通过调节MMP-2/TIMP-1的动态平衡,维持ECM合成与降解平衡,达到抑制心室重构的作用。
综上,参桂保心高剂量及芪苈强心胶囊均能降低心力衰竭大鼠的心胸比率及BNP水平、改善心脏组织病理学评分、减少MMP-2蛋白表达及MMP-2/TIMP-1比值,其中在减少MMP-2表达方面参桂保心高剂量更优于芪苈强心胶囊,这些均可能是参桂保心方抑制心室重构、改善心脏功能的作用机制。
[1] 张秋月,王保和,刘伟爽. 益气复脉方对慢性心衰大鼠基质金属蛋白酶活性调节作用的实验研究[J]. 中西医结合心脑血管病杂志,2016,14( 9) :825-829. DOI:10.3969/j.issn.1672-1349.2016.08.009.
[2] 马晓庆,钟栩,党婵娟. 参桂保心浓煎剂对心衰大鼠NT-proBNP及Caspase-3的 影 响[J]. 西 部 中 医 药,2016,29(7) :8-11. DOI:10.3969/j.issn.1004-6852.2016.07.003.
[3] 罗时珂,李萍,程晓曙. 异丙肾上腺素诱导慢性心力衰竭大鼠模型 的 建 立[J]. 重 庆 医 学,2011,41( s1) :352-354. DOI:10.3969/j.issn.1000-2200.2008.03.007.
[4] 韩克,吴格如,席雨涛. 容量超负荷心力衰竭大鼠模型的制备及心脏功能的超声评价[J]. 中国循证心血管医学杂志,2013,( 5) :507-509. DOI:10.3969/j.1674-4055.2013.05.24.
[5] 徐叔云. 药理实验方法学[M]. 北京:人民卫生出版社,1991:201-206
[6] 蔡辉,李筝,焦东东. 美托洛尔对充血性心力衰竭大鼠血浆醛固酮浓度、心肌纤维化和心室重构的影响[J]. 微循环学杂志,2010,20( 1) :13-15. DOI:10.3969/j.issn.1005-1740.2010.01.005.
[7] 赵伟涛,徐增政,贾桂贞. 芪苈强心胶囊对心衰大鼠MMP-2、MMP-9表达的影响[J]. 医学理论与实践,2016,29(17) :3002-3003. DOI:10.19381/j.issn.1001-7585.2016.17.003.
[8] 龚明玉,杜超,苏玲. 灯盏花素对缺血再灌注大鼠心肌Caspase-9蛋白及mRNA表达的影响[J]. 中国老年学,2013,33( 2) :347-349.DOI:10.3969/j.issn. 1005-9202.2013.02.046 .
[9] BERGMAN MR,TEERLIMK JR,MAHINKAR R,et al. Cardiac matrix metalloproteinase-2 expression in dependently induces marked ventricular remodeling and systolic dysfunction[ J]. Am J Physiol Heart Circ Physiol,2007,292( 4) :1847-1860.
[10] 张艳,廖佳丹,王彩玲. 不同中药复方对慢性心衰大鼠MMP-2、TIMP-2的影响[J]. 北京中医药大学学报,2013,36 ( 6) :409-412.DOI:10.3969/j.issn. 1006-2157.2013.06.011.
