microRNA-1183通过抑制CBL-B的表达促进胃癌细胞的增殖及转移
2018-03-20范一博车晓芳赵欢胡雪君曲秀娟刘云鹏
范一博,车晓芳,赵欢,胡雪君,曲秀娟,刘云鹏
(中国医科大学附属第一医院 1. 肿瘤内科; 2. 呼吸疾病研究所老年病呼吸感染科,沈阳 110001)
microRNA (miRNA) 是一类长度约为22个核苷酸,由内源基因编码的非编码单链RNA分子,参与转录后基因表达调控[1]。近年来,越来越多的研究[2-7]显示,microRNA参与多种肿瘤的增殖和转移,影响肿瘤患者的预后。然而,microRNA-1183是否促进胃癌细胞中的增殖和转移尚不清楚。本研究探讨了microRNA-1183对胃癌细胞MGC803增殖和转移的影响,以及CBL-B和Akt通路在其中的作用。研究结果为进一步明确microRNA-1183对胃癌细胞的增殖和转移机制提供了新思路。
1 材料与方法
1.1 材料
Akt和phosph-Akt抗体购自美国Cell Signaling公司,CBL-B和β-actin抗体购自美国Santa Cruze 公司。
1.2 方法
1.2.1 细胞培养:胃癌细胞系MGC803购自上海细胞库。人胃癌细胞MGC803生长于含有12 U/L庆大霉素、100 mL/L灭活胎牛血清的RPMI1640培养液中,于37 ℃、5%CO2的孵育箱内培养,2 d左右传代1次。所有实验均采用对数生长期细胞。
1.2.2 MTT法检测胃癌细胞的增殖:取对数生长期的胃癌细胞MGC803细胞株接种于96孔板内,待细胞贴壁后转染microRNA阴性对照及microRNA-1183模拟物,72 h后每孔加入MTT溶液 (5 mg/mL) 25 μ L,继续孵育4 h,弃掉孔内上清液。加入二甲亚砜200 μ L/孔,振荡至结晶物充分溶解,在酶联免疫测定仪上选择570 nm波长,空白孔调零,测定各孔吸光值,计算两者的增值率。
1.2.3 Transwell法检测胃癌细胞的转移:取对数生长期的胃癌细胞MGC803,胰酶消化细胞后,1 000 r/min离心5 min,弃上清,加入无血清的RPIM 1640培养基,细胞计数至1×105/mL加入Transwell小室(Corning) 上室。下室加入2.5%胎牛血清的RPIM培养基。37 ℃培养箱培养24 h。 取出Transwell,脱脂棉擦拭表面的细胞,PBS冲洗上室。瑞士吉姆萨染色后,PBS冲洗风干,显微镜下计数细胞数。实验重复3次。
1.2.4 Western blotting检测蛋白表达:分别收集转染microRNA阴性对照及microRNA-1183模拟物的胃癌细胞MGC803,冰上裂解后,提取上清的蛋白,考马斯亮蓝法进行蛋白定量。将样品 (30 μ g/道) 在10%的SDS-聚丙烯酰胺凝胶中电泳约3 h,然后转印至PVDF膜上。用含5%脱脂牛奶的TTBS封闭1 h后,按Marker标记的分子量剪裁转印膜,分别加入兔抗人CBL-B抗体 (1∶1 000) 、pAkt抗体 (1∶500) 、Akt 抗体 (1∶1 000) 和 β-actin抗体 (1∶1 000) 4 ℃过夜。TTBS洗4次后加入辣根过氧化物酶标记的羊抗鼠(1∶800) 或羊抗兔二抗 (1∶800) 室温作用30 min后,再应用TTBS洗4次,ECL法显色,GIS凝胶图像分析系统照相并分析处理。
1.2.5 双荧光素酶报告基因检测系统检测:将质粒 (500 ng) 、microRNA-1183模拟物或阴性对照(50 nmol/L) 及pRL-TK (5 ng) 瞬时转染至胃癌细胞MGC803细胞 72 h后,双荧光报告系统检测荧光素酶的活性。
1.3 统计学分析
采用SPSS 16.0统计软件进行数据分析。所得数据均为3次独立实验结果,以±s表示。2组间比较采用 t 检验,P < 0.05为差异有统计学意义。
2 结果
2.1 microRNA-1183促进胃癌细胞MGC803的增殖和转移
为证实microRNA-1183对胃癌细胞增殖的作用,将microRNA-1183瞬时转染到MGC803细胞,实时PCR结果显示,与对照组相比,microRNA-1183的表达升高了4.2倍 (图1A) 。同时,MTT法结果证实,microRNA-1183可促进胃癌细胞MGC803的增殖 (图1B) 。Transwell法结果证实,microRNA-1183可促进胃癌细胞MGC803的转移 (图1C) 。
2.2 microRNA-1183直接与CBL-B 3’UTR区结合
为了明确microRNA-1183促进胃癌细胞增殖的机制,通过生物信息学网站TargetScan及microRNA.org预测microRNA-1183的靶基因,结果显示,CBL-B等是microRNA-1183的靶基因。BLAST对比分析结果显示,microRNA-1183与CBL-B的3’UTR区有直接结合位点 (图2A) 。进一步过表达microRNA-1183后,CBL-B的表达以浓度依赖的方式下调 (图2B) 。荧光报告素酶结果证实,转染模拟物microRNA-1183后,荧光素酶的活性明显降低 (图2C) ,说明CBL-B是microRNA-1183的靶基因。
2.3 CBL-B抑制胃癌MGC803细胞的增殖
为证实CBL-B对胃癌MGC803增殖的作用,Western blotting验证CBL-B的敲除效率情况 (图3A) 。MTT法结果显示,瞬时敲除CBL-B后,细胞增殖的能力明显增强。Transwell法结果显示,敲除CBL-B后,细胞的转移能力明显增强。结果表明,CBL-B抑制了胃癌细胞MGC803的增殖 (P < 0.01,图3B) 。
2.4 microRNA-1183/CBL-B/Akt信号轴促进胃癌细胞MGC803的增殖与转移
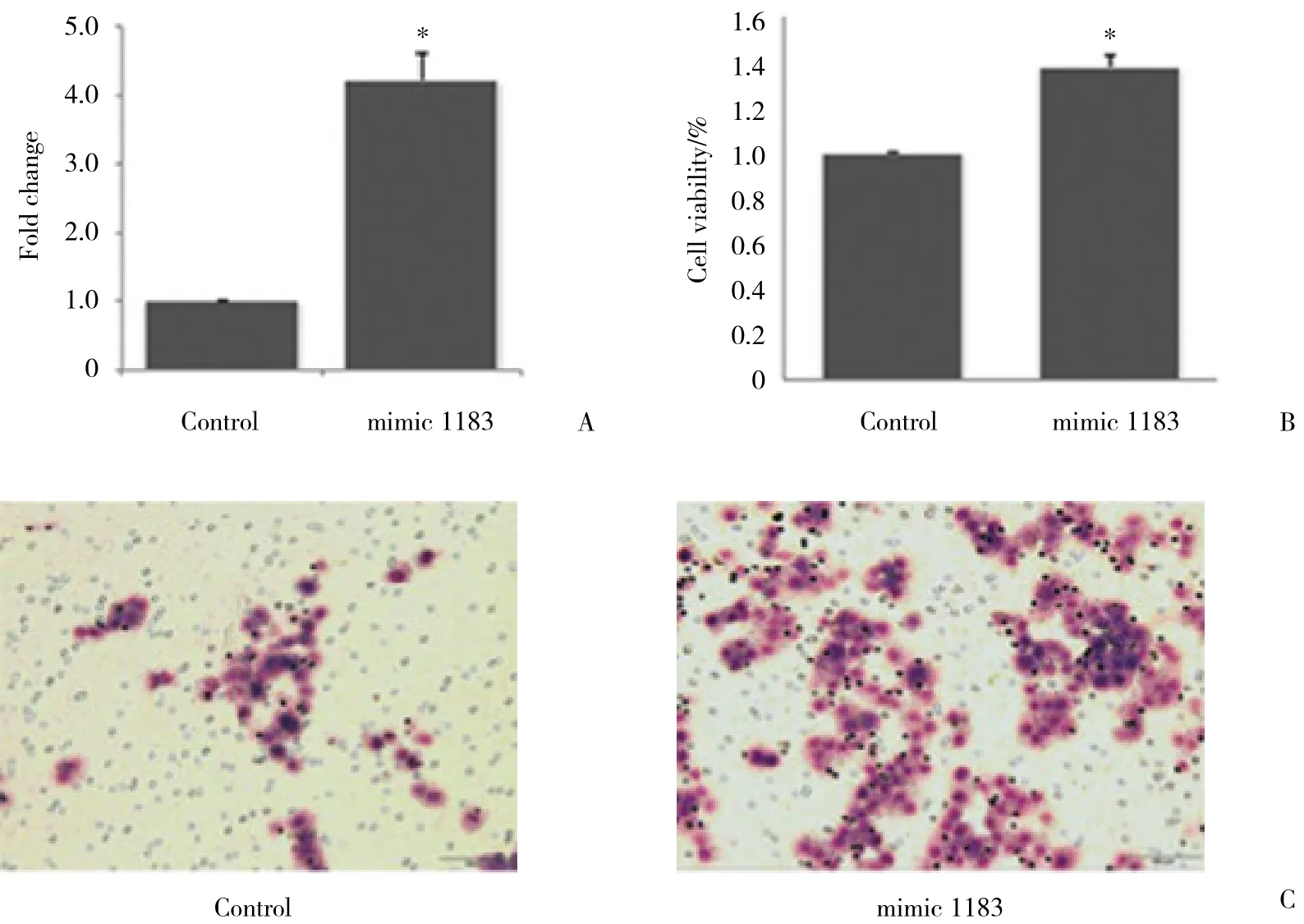
图1 microRNA-1183促进胃癌细胞MGC803的增殖和转移Fig.1 microRNA-1183 promotes the proliferation and metastasis of MGC803 cells

图2 CBL-B是microRNA-1183的靶基因Fig.2 CBL-B is the target gene of microRNA-1183
Western blotting检测microRNA-1183瞬时转染到MGC803细胞48 h后,CBL-B及下游分子Akt的表达变化。结果表明,瞬时转染microRNA-1183后,CBL-B的表达明显下调,伴随Akt的活化明显增强,见图4。
3 讨论
microRNA的异常表达可影响多种肿瘤患者的预后[2-7]。已有文献[8]报道,microRNA-1183在类风湿性关节炎的患者中高表达,且可作为诊断疾病的分子标志物。然而,目前microRNA-1183在肿瘤中发挥的作用尚未见报告。本研究证实,胃癌中microRNA-1183可促进其增殖及转移。
既往研究[8]显示,胃癌患者血浆microRNA-1183的表达可作为诊断类风湿关节炎的生物标志物,其中CXCR4、 EGF和EGFR都是其靶基因。然而,microRNA-1183是否存在其他的靶基因,及其在胃癌中的增殖作用尚不明确。本研究结果显示,microRNA-1183可以通过浓度依赖的方式促进胃癌细胞MGC803的增殖和转移,进一步提示其参与胃癌细胞的恶性转化。
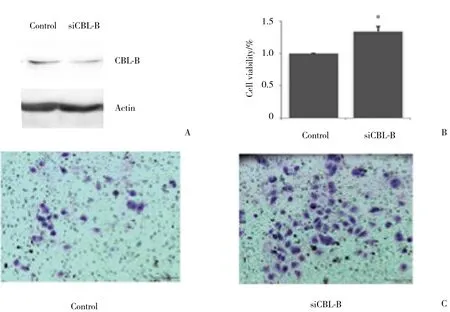
图3 CBL-B抑制MGC803细胞的增殖与转移Fig.3 CBL-B inhibited the proliferation and metastasis of MGC803 cells
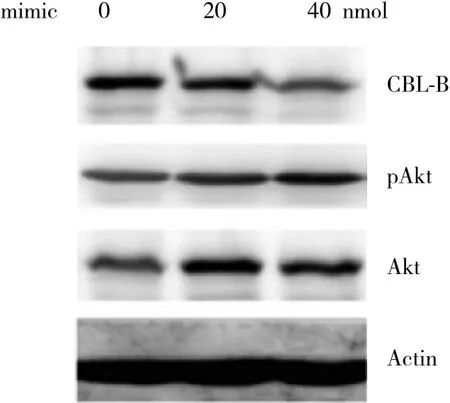
图4 Western blotting过表达microRNA-1183后CBL-B、pAkt和Akt的表达Fig.4 Western blotting shows the expression of CBL-B,p-Akt,and Akt in MGC803 cells overexpressing microRNA-1183
既往关于microRNA-1183的功能及靶基因仅有1篇文章报告。通过TargetScan及microRNAorg预测CBL-B可能是microRNA的靶基因。CBL-B是一种抑癌基因,通过泛素化降解受体或非受体酪氨酸激酶,从而抑制细胞的生长、分化和凋亡[9-10]。本研究发现,过表达microRNA-1183后CBL-B的表达明显下调,并伴随着Akt的活化。这些结果提示,microRNA-1183通过负向调控CBL-B促进胃癌细胞的增殖及转移。
综上所述,microRNA-1183可促进胃癌细胞的增殖和转移,其通过抑制CBL-B的表达促进了Akt的活化,提示microRNA-1183/CBL-B/Akt通路是促进胃癌细胞增殖和转移的机制之一。本研究为进一步明确胃癌细胞的增殖和转移机制,寻找治疗胃癌的靶分子提供重要的科学意义和潜在的临床应用价值。
[1] RAHMANI F,AVAN A,HASHEMY SI,et al. Role of Wnt/β-catenin signaling regulatory microRNAs in the pathogenesis of colorectal cancer [J]. J Cell Physiol,2017,233 (2) :811-817. DOI:10.1002/jcp.25897.
[2] PAN T,CHEN W,YUAN X,et al. miR-944 inhibits metastasis of gastric cancer by preventing the epithelial-mesenchymal transition via MACC1/Met/AKT signaling [J]. FEBS Open Biol,2017,7 (7) :905-914. DOI:10.1002/2211-5463. 12215.
[3] SUI M,JIAO A,ZHAI H,et al. Upregulation of miR-125b is associated with poor prognosis and trastuzumab resistance in HER2-positive gastric cancer [J]. Exp Ther Med,2017,14 (1) :657-663. DOI:10.3892/etm.2017.4548.
[4] LIU N,ZHOU Q,QI YH,et al. Effects of long non-coding RNA H19 and microRNA let7a expression on thyroid cancer prognosis[J]. Exp Mol Pathol,2017,103 (1) :71-77. DOI:10.1016/j.yexmp.2017.06.004.
[5] ZHANG J,FAN J,ZHOU C,et al. miR-363-5p as potential prognostic marker for hepatocellular carcinoma indicated by weighted co-expression network analysis of miRNAs and mRNA[ J]. BMC Gastroenterol,2017,17( 1) :81. DOI:10.1186/s12876-017-0637-2.
[6] BAI Y,LIN H,FANG Z,et al. Plasma microRNA-19a as a potential biomarker for esophageal squamous cell carcinoma diagnosis and prognosis[ J]. Biomark Med,2017,11( 5) :431-441. DOI:10.2217/bmm-2016-0286.
[7] ZHANG Y,XU D,PAN J,et al. Dynamic monitoring of circulating microRNAs as a predictive biomarker for the diagnosis and recurrence of papillary thyroid carcinoma[ J]. Oncol Lett,2017,13( 6) :4252-4266. DOI:10.3892/ol.2017.6028.
[8] LI N,LIAN J,ZHAO S,et al. Detection of differentially expressed microRNAs in rheumatic heart disease:miR-1183 and miR-1299 as potential diagnostic biomarkers [J]. Biomed Res Int,2015,2015:524519. DOI:10.1155/2015/524519.
[9] VANDERLAAN PA,RANGACHARI D,MOCKUS SM,et al. Mutations in TP53,PIK3CA,CBL-B and other genes in EGFR mutated lung cancers:correlation with clinical outcomes [J]. Lung Cancer,2017,106:17-21. DOI:10.1016/j.lungcan.2017.01.011.
[10] XIAO J,YU W,HU K,et al. miR-92a promotes tumor growth of osteosarcoma by targeting CBL-B/AKT signaling pathway [J]. Oncol Rep,2017,37 (4) :2513-2521. DOI:10.3892/or.2017.5484.
