Toll样受体4对大鼠脑缺血再灌注损伤的作用
2018-03-20邢海会丁晓慧解辉王忠华谢菊华陈丰洋罗崟洲周胜男
邢海会,丁晓慧,解辉,王忠华,谢菊华,陈丰洋,罗崟洲,周胜男
(沈阳医学院基础医学院组织学与胚胎学教研室,沈阳 110034)
随着人口老龄化进程的加剧和发病年龄的年轻化,缺血性脑卒中已成为危害人类的主要疾病。缺血性脑卒中具有较高的致残率和死亡率。已有研究[1]表明,脑缺血发生后炎症反应在再灌注损伤中发挥着重要作用。其作用的差异取决于神经炎症持续的时间和释放的细胞因子的性质[2]。Toll样受体4( Toll-like receptor 4,TLR4) 是Toll样受体家族亚型之一,在炎症发生的级联反应中起到重要作用[3]。小鼠急性脑缺血再灌注后阻断TLR4或敲除TLR4基因后对缺血再灌注损伤具有保护作用[4-5],但是WANG等[6]报道TLR4对脑组织具有保护作用。这表明脑缺血再灌注损伤可能与TLR4的表达有关,但是TLR4在脑缺血再灌注后不同时间点的作用还未见报道。因此,进一步研究TLR4在脑缺血再灌注损伤中不同时间点的作用意义重大。
TAK-242是一种小分子环己烯衍生物,为TLR4的特异性配体,腹腔注射后可透过血脑屏障,其作为TLR4的拮抗剂已被成功用于脑损伤的研究中[4,7]。核转录因子κ B抑制蛋白激酶 (nuclear transcription factor kappa B inhibitory protein kinase,IKK α/β) 为TLR4通路下游激酶,脑缺血发生后发生磷酸化,即形成磷酸化的IKK α/β (P-IKK α/β)参与脑缺血损伤[4]。本研究通过大鼠腹腔注射TAK-242阻断TLR4的作用,探讨TLR4及P-IKK α/β在大鼠脑缺血再灌注后不同时间点的作用和机制。
1 材料与方法
1.1 材料
健康雄性SPF级SD大鼠108只,体质量 (257.17±18.97) g,购自辽宁省本溪市长生生物技术有限公司。TLR4小鼠单克隆抗体 (美国Origene公司) 、兔抗大鼠P-IKK α/β、IKK α多克隆抗体 (美国Cell Signaling 公司) ,辣根酶标记山羊抗小鼠IgG (中国中杉金桥公司) ,辣根酶标记山羊抗兔IgG (美国Santa Cruz Biotechnology公司) ,β-actin (中国恩晶生物公司) 。
1.2 方法
1.2.1 动物分组及模型制备:将大鼠随机分为3组,即假手术组、缺血组( 缺血+生理盐水) ,缺血+TAK(TLR4拮抗剂) 组。每组36只大鼠,每组取术后1、3、7、14 d 4个时间点,每个时间点9只大鼠,其中3只做HE染色,6只做Western blotting。各组大鼠分别在术后1、3、7和14 d取材。大鼠用20%乌拉坦( 1 500 mg/kg)麻醉,仰卧位固定于手术台上,颈部正中切口,分离右侧颈总动脉、迷走神经、颈外动脉,结扎颈总动脉和颈外动脉近心端,于颈总动脉远心端放置一备好的丝线,勿收紧线结。经颈总动脉插入鱼线至颈内动脉,长度为2 cm( 颈外动脉和颈内动脉分叉处),以阻断大脑中动脉,结扎备好的线结固定鱼线。缺血+TAK组在大鼠脑缺血1 h后腹腔注射TAK-242( 3 mg/kg)[4],缺血组腹腔注射同等剂量的生理盐水,缺血组和缺血+TAK组均在鱼线插入2 h后拔出,实现缺血后再灌注。假手术组只分离右侧颈总动脉、迷走神经和颈外动脉。
1.2.2 神经功能评分:大鼠手术前和手术后清醒至术后24 h内均采用Zealonga评分法进行神经功能评分。0分,正常,无神经损伤症状;1分,提尾时缺血对侧前肢屈曲,不能伸直;2分,行走时身体向缺血对侧旋转;3分,向缺血病灶对侧跌倒;4分,不能自发行走,意识丧失。
1.2.3 组织切片的制备及HE染色:各组大鼠分别在术后1、3、7和14 d 取材,部分大鼠用4%多聚甲醛经心脏灌流后取脑,切取距前囟前1 mm至前囟后3 mm制作石蜡切片。切片经常规脱蜡和水化,进行HE染色,然后经脱水和透明,中性树胶封片,镜下观察各组大鼠大脑皮质的病理学变化。
1.2.4 Western blotting检测缺血侧大脑皮质TLR4及P-IKK α/β的表达:各组动物分别在术后1、3、7和14 d 新鲜取脑,留取距前囟前1 mm至前囟后3 mm区域内大脑皮质( 约50 mg) ,-80℃冰箱保存备用,Western blotting检测TLR4及P-IKK α/β在缺血脑皮质的表达。脑组织经匀浆离心、测定蛋白质浓度,采用8%分离胶进行SDS-PAGE电泳,PVDF膜转膜,5%脱脂奶粉封闭后,抗TLR4抗体( 1∶500) 室温2 h,再孵育相应二抗室温作用1.5 h,以β-actin作为内参,ECL发光后采用Tanon GIS软件对条带进行定量分析,以目的蛋白值比内参值作为TLR4的相对表达量。抗P-IKK α/β抗 体( 1∶2 000) 或抗IKK α抗 体( 1∶800)替代抗TLR4抗体,检测P-IKK α/β在大脑皮质的表达,以P-IKK α/β值比IKK α值作为P-IKK α/β的相对表达量。
1.3 统计学分析
2 结果
2.1 神经功能评分
假手术组大鼠无神经功能缺损症状,Zealonga评分均为0分,缺血组Zealonga评分为2.38±0.493,缺血+TAK组为1.92±0.739。与假手术组相比,缺血+TAK组和缺血组的Zealonga评分均显著增加 (P < 0.01) ,且缺血+TAK组的Zealonga评分低于缺血组 (P < 0.05) 。
2.2 大脑皮质形态学观察
HE染色结果显示,假手术组大鼠大脑皮质结构完整,神经元形态正常,细胞核大而圆,核仁明显,着色分布均匀 (图1) 。缺血+TAK组和缺血组不同时间点均可观察到不同程度的病理学改变 (图2) 。术后1和3 d,缺血组和缺血+TAK组脑组织均有不同程度的水肿,尤其是术后1 d,缺血组和缺血+TAK组细胞核周围的细胞质出现空泡化,且缺血+TAK组细胞水肿较缺血组严重。术后7 d,缺血组脑组织结构疏松,出现液化性坏死,呈筛网状,神经元大量消失,大量小胶质细胞浸润,呈现急性脑损伤的病理学改变,而缺血+TAK组脑组织结构破坏轻于缺血组,尚可见正常的神经元形态。术后14 d,缺血组神经元消失,星形胶质细胞大量增生,呈现修复期脑损伤改变,缺血+TAK组脑组织结构及神经元形态趋于正常。缺血组和缺血+TAK组术后7 d损伤严重,缺血组和缺血+TAK组7 d时的脑梗死面积分别为15.46±0.522和4.05±0.643,缺血组明显高于缺血+TAK组 (P < 0.01) 。
2.3 TLR4和P-IKK α/β在大脑皮质的表达
Western blotting检测TLR4 (图3) 和P-IKK α/β (图4)在大脑皮质的表达。在所有时间点,假手术组TLR4的表达量最低;术后1和14 d,缺血+TAK组TLR4的表达高于缺血组 (P < 0.05) ;而术后3和7 d,缺血组TLR4的表达高于缺血+TAK组 (P < 0.05) 。术后1 d,缺血+TAK组P-IKK α/β的表达高于假手术组和缺血组 (P < 0.05) ,缺血组高于假手术组 (P < 0.05) ;术后3、7和14 d,缺血组P-IKK α/β的表达高于假手术组和缺血+TAK组 (P < 0.05) 。
3 讨论
脑缺血再灌注损伤是一个多种机制参与的病理生理学过程,其中炎症反应在脑缺血再灌注损伤中发挥着重要作用[8]。ANDRESEN等[9]证实应用TLR4单克隆抗体阻断剂MTS510可改善缺血再灌注损伤小鼠的神经系统功能,减少脑梗死体积,减轻脑水肿。SONG等[10]的临床研究也说明TLR4基因可能与湖南省汉族人群急性动脉粥样硬化性脑梗死有关。
TLR4是Toll样受体家族成员之一,通过髓样分化因子88 (myeloid differentiation factor 88,MyD88) 依赖通路和MyD88非依赖通路介导炎症反应,参与脑缺血[11-12]。大量研究证实,TLR4在一系列酶的作用下可促使其下游激酶IKK α/β发生磷酸化,磷酸化后的IKK α/β与核因子κB调节蛋白在一系列酶的作用下促进核因子κB抑制蛋白IκB磷酸化而降解,解除对核因子κB的抑制,进而促使核因子κB从细胞质移位入细胞核,导致炎症级联反应的发生[1,4]。TAK-242为TLR4拮抗剂,可特异性的与TLR4结合,拮抗TLR4的作用[4,6]。本研究采用TAK-242阻断TLR4的作用,探讨TLR4在大鼠脑缺血再灌注后不同时间点的作用及机制。
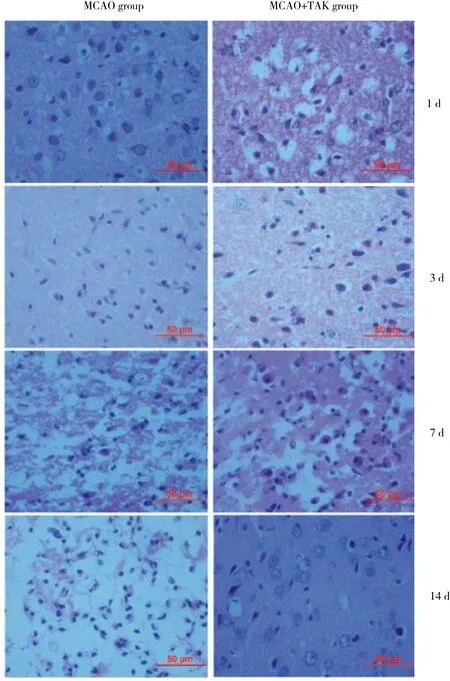
图2 缺血组和缺血+TAK组大脑皮质HE染色结果 ×400Fig.2 HE staining of cerebral cortices in the MCAO and MCAO+TAK groups ×400
本研究结果显示,脑缺血再灌注后1 d,缺血+TAK组细胞水肿较缺血组严重,缺血+TAK组TLR4及P-IKK α/β的表达均高于缺血组,提示脑缺血再灌注后1 d TLR4可能减轻脑缺血再灌注损伤。脑缺血再灌注后3、7和14 d,缺血+TAK组与缺血组相比大鼠神经功能明显改善,脑梗死面积也显著减小,病理损伤减轻;P-IKK α/β的表达也低于缺血组,提示腹腔注射TAK-242有效抑制TLR4下游激酶IKK α/β的磷酸化,降低TLR4介导的炎症反应。有研究[13]报道在给予急性脑出血大鼠模型腹腔注射TAK-242后14 d,与未给药组相比,TLR4表达增加。与本研究结果一致。因此,TLR4通过MyD88依赖通路参与脑缺血再灌注损伤,且在不同时间点作用不同。通过影响MyD88依赖通路下游调控因子P-IKK α/β的表达,在大鼠脑缺血再灌注损伤后1 d,TLR4可减轻脑缺血再灌注损伤,而在大鼠脑缺血再灌注损伤后3~14 d,可加重脑缺血再灌注损伤。TLR4参与脑缺血再灌注损伤在不同时间点的作用不同,考虑与炎症反应在脑缺血再灌注发生的不同时间释放的促炎或抑炎因子不同相关。神经胶质细胞如小胶质细胞和星形胶质细胞在脑缺血再灌注发生的增殖反应也随着时间的推移而发生变化,OKUN等[14]报道TLR4在中枢神经系统可表达于神经元、小胶质细胞、星形胶质细胞和少突胶质细胞等,其中在小胶质细胞含量最高。而小胶质细胞是中枢神经系统参与免疫炎症反应的重要细胞。

图4 各组大鼠不同时间点P-IKK α/β在大脑皮质的表达Fig.4 P-IKK α/β expression at different time points in the cerebral cortices of the different group rats
综上所述,TLR4通过MyD88依赖通路影响了P-IKK α/β在大脑皮质的表达,参与免疫炎症反应的调节,在大脑缺血再灌注早期可减轻脑缺血再灌注损伤,而后期加重脑缺血再灌注损伤。这一发现对以TLR4为靶点治疗处于不同患病时期的缺血性脑卒中患者具有重要临床指导意义。
[1] ZHANG P,GUO ZF,XU YM,et al. N-Butylphthalide (NBP)ameliorated cerebral ischemia reperfusion-induced brain injury via HGF-regulated TLR4/NF-kappaB signaling pathway [J].Biomed Pharmacother,2016,83:658-666. DOI:10.1016/j.biopha.2016.07.040.
[2] SIERRA A,ENCINAS JM,DEUDERO JJ,et al. Microglia shape adult hippocampal neurogenesis through apoptosis-coupled phagocytosis [J]. Cell Stem Cell,2010,7 (4) :483-495. DOI:10.1016/j.stem.2010.08.014.
[3] MEDZHITOV R,PRESTON-HURLBURT P,JANEWAY CA JR. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity [J]. Nature,1997,388 (6640) :394-397. DOI:10.1038/41131.
[4] HUA F,TANG H,WANG J,et al. TAK-242,an antagonist for Tolllike receptor 4,protects against acute cerebral ischemia/reperfusion injury in mice [J]. J Cereb Blood Flow Metab,2015,35 (4) :536-542.DOI:10.1038/jcbfm.2014.240.
[5] PUSHKOV D,NICHOLSON JD,MICHOWIZ S,et al. Relative neuroprotective effects hyperbaric oxygen treatment and TLR4 knockout in a mouse model of temporary middle cerebral artery occlusion [J]. Int J Neurosci,2016,126 (2) :174-181. DOI:10.3109/00207454.2014.1002609.
[6] WANG Y,GE P,YANG L,et al. Protection of ischemic post conditioning against transient focal ischemia-induced brain damage is associated with inhibition of neuroinflammation via modulation of TLR2 and TLR4 pathways [J]. J Neuroinflammation,2014,11:15.DOI:10.1186/1742-2094-11-15.
[7] SHA T,SUNAMOTO M,KITAZAKI T,et al. Therapeutic effects of TAK-242,a novel selective Toll-like receptor 4 signal transduction inhibitor,in mouse endotoxin shock model[ J]. Eur J Pharmacol,2007,571( 2/3) :231-239. DOI:10.1016/j.ejphar.2007.06.027.
[8] BURROWS F,HALEY MJ,SCOTT E,et al. Systemic inflammation affects reperfusion following transient cerebral ischemia[ J]. Exp Neurol,2016,277:252-260. DOI:10.1016/j.expneurol.2016.01.013.
[9] ANDRESEN L,THEODOROU K,GRUNEWALD S,et al. Evaluation of the therapeutic potential of anti-TLR4-antibody MTS510 in experimental stroke and significance of different routes of application[ J]. PLoS One,2016,11( 2) :e0148428. DOI:10.1371/journal.pone.0148428.
[10] SONG Y,LIU H,LONG L,et al. TLR4 rs1927911,but not TLR2 rs5743708,is associated with atherosclerotic cerebral infarction in the Southern Han population:a case-control study[ J]. Medicine,2015,94( 2) :e381. DOI:10.1097/MD.0000000000000381.
[11] YANG Z,ZHONG L,ZHONG S,et al. miR-203 protects microglia mediated brain injury by regulating inflammatory responses via feedback to MyD88 in ischemia[ J]. Mol Immunol,2015,65( 2) :293-301. DOI:10.1016/j.molimm.2015.01.019.
[12] HWANG EH,KIM TH,OH SM,et al. Toll/IL-1 domain-containing adaptor inducing IFN-beta ( TRIF) mediates innate immune responses in murine peritoneal mesothelial cells through TLR3 and TLR4 stimulation[ J]. Cytokine,2016,77:127-134. DOI:10.1016/j.cyto.2015.11.010.
[13] LEI C,WU B,CAO T,et al. Brain recovery mediated by toll-like receptor 4 in rats after intracerebral hemorrhage[ J]. Brain Res,2016,1632:1-8. DOI:10.1016/j.brainres.2015.11.045.
[14] OKUN E,GRIFFIOEN KJ,MATTSON MP. Toll-like receptor signaling in neural plasticity and disease[ J]. Trends Neurosci,2011,34(5) :269-281. DOI:10.1016/j.tins.2011.02.005.
