高强度间歇训练对不同类型肌纤维代谢与分布的调节*
2018-03-20梁永桥马建设
孙 一,朱 荣,梁永桥,马建设
(1.吉林大学体育学院,吉林 长春 130012;2.温州医科大学,浙江 温州 325035)
骨骼肌可根据功能需要而发生适应性变化,因此具有良好的可塑性。规律运动可诱导骨骼肌发生生理性适应,如线粒体生物合成、血管发生以及肌纤维类型分布改变等,最终提高机体的运动能力并产生良性健康效应[1]。虽然运动可对机体所有器官组织产生影响,但运动的健康效应主要来源于骨骼肌适应。深入了解运动诱导骨骼肌适应的具体机制对于提高运动能力以及为慢性病患者制定行之有效的运动康复方案具有重要意义。
哺乳动物的骨骼肌是机体最重要的动力器官,是由结构与功能迥异的不同类型肌纤维构成的嵌合体(mosaic)。肌纤维根据形态、代谢和收缩特性可大致分为慢肌(I型)和快肌(II型)两大类。根据肌球蛋白重链(myosin heavy chain,MHC)亚型可分为I、IIa、IId/x和IIb四型[2, 3]。肌纤维类型是决定运动员运动能力特别是耐力和爆发力水平的重要因素。此外,在长期卧床、衰老、心衰等病理状态下,骨骼肌II型纤维比例增加,同时发生代谢异常和肌萎缩,最终导致运动耐力下降并影响生存质量[2]。因此,调控肌纤维类型分布是提高机体运动能力、延缓甚至逆转肌萎缩并提高生存质量的策略之一。研究发现,运动能够改变肌纤维类型分布,目前比较一致的观点认为,长期持续耐力训练可诱导肌肉适应性变化,上调线粒体密度并提高氧有氧代谢能力并促使I型肌纤维比例增加[4]。
近年来,在传统持续耐力训练基础上,发展了一种新颖训练模式——高强度间歇训练(high intensity interval training,HIT)。持续耐力训练和HIT均可改善骨骼肌代谢并最终提升运动表现,包括上调骨骼肌线粒体容量、氧化能力、糖原储备、毛细血管密度,减少底物水平磷酸化,增加最大摄氧量(maximal oxygen uptake,VO2max)并提高有氧运动能力。由于两种训练模式可诱导相似的生理性适应,因此HIT具有省时、有效等突出特点[5-8],此外HIT运动时间较短、存在间歇而更易被接受[9]。多项研究证实,即使运动总时间约4 min的低负荷HIT亦可改善VO2max、提高运动能力以及上调线粒体容量[5, 7]。HIT已在竞技体育和大众健身中广泛应用,其安全性也得到了大样本随机对照试验和Meta-分析的证实[10]。多项研究结果提示,HIT改善有氧运动能力的机制主要与外周适应有关,其中γ过氧化物酶体增殖物活化受体辅活化蛋白1 (peroxisome proliferator-activated receptor gamma co-activator 1 alpha,PGC-1α)表达上调以及线粒体基因转录激活诱导的线粒体生物合成增加起决定作用[4, 11, 12],然而不同类型肌纤维对于HIT是否产生相似变化尚不得而知。目前存在三点疑虑:(1)由于高强度运动主要动员II型肌纤维,但HIT时肌纤维的募集方式有待证实;(2)HIT对不同类型肌纤维有氧、无氧代谢的影响未见报道;(3)长期HIT对肌纤维类型分布产生何种影响;(4)研究证实,活化腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)、p38促分裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)和钙调神经磷酸酶(Calcinerin,CaN)信号通路参与肌纤维类型分布的生理过程[4],但上述信号途径在HIT诱导肌纤维类型重塑中的作用尚不清楚。深入探索HIT时肌纤维的募集方式以及不同类型肌纤维对HIT的适应规律与机制对于进一步认识HIT具有省时有效优势以及拓展HIT在竞技体育和大众健身中的应用具有重要的理论与现实意义。因此本研究旨在探讨急性(1次)和长期(8周)HIT对不同类型骨骼肌纤维代谢与分布的影响及可能机制。我们假设,急性HIT主要动员II型肌纤维并激活多种信号转导通路,而长期HIT提高机体运动能力的同时诱导不同类型肌纤维代谢与分布特征发生适应性改变。
1 研究对象与方法
1.1 实验动物与分组
健康雄性SPF级Sprague-Dawley(SD)大鼠30只,体重250~300 g,由军事医学科学院实验动物中心提供。动物饲养于标准实验室,温度24℃~26℃,湿度60%~70%,12 h昼夜交替光照,每笼5只,自由进食水。将动物随机分为安静对照(resting control,r-C)组、急性HIT(acute high intensity interval training,a-HIT)组和长期HIT(chronic high intensity interval training,c-HIT)组,每组n=10只。
1.2 实验方案
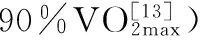
1.3 一般情况观察与记录
实验过程中,观察并记录各组动物体重(g)、摄食量(g)以及精神状态、活动情况、体毛色泽、大便形态等的变化。
1.4 运动能力测定
c-HIT组大鼠在末次训练后48 h同r-C组进行一次递增负荷运动实验,方案为:10 min跑台热身运动(速度5 m/min)后,起始负荷设定为10 m/min ,每3 min递增5 m/min,直至力竭。力竭判定标准:动物跟不上预定速度,大鼠臀部压在笼具后壁,后肢随转动皮带后拖达30 s以上,毛刷刺激驱赶无效,行为特征为呼吸深急、幅度大,精神疲倦,俯卧位垂头,刺激后无反应。用力竭时间(min)表示运动能力。
1.5 动物取材
分离比目鱼肌(慢肌,I型肌纤维为主)和胫骨前肌(快肌,II型肌纤维为主),将组织分为三部分,一部分制作组织切片进行肌纤维类型测定,一部分新鲜组织进行酶活性和糖原含量检测,另一部分进行蛋白表达测定。取材时将后两部分新鲜组织用锡纸包裹迅速投入液氮中并转移至﹣80℃低温冰箱冻存待测。
1.6 代谢酶活性测定
取500 μg组织置于5 mL含0.3 mol/L蔗糖、10 mmol/L咪唑(4℃、pH 7.4)的溶液中,使用匀浆器进行充分研磨,将组织匀浆液离心15 min(4℃、3 000 rpm)后取上清。使用南京建成生物工程研究所提供的检测试剂盒,应用UV-120-20紫外分光光度计检测各组动物骨骼肌琥珀酸脱氢酶(succinate dehydrogenase,SDH)和乳酸脱氢酶(lactate dehydrogenase,LDH)活性,单位:U/mg。
1.7 肌糖原含量测定
使用722型光栅分光光度计以蒽酮法测定各组肌糖原含量,方法为[15]:取50 mg骨骼肌匀浆液用400 μL氢氧化钾(浓度30%)消化30 min,随后加入800 μL无水乙醇沸水浴10 min。待冷却后离心30 min(4℃、3000 g),弃上清并将沉淀物悬浮于1 ml三氯乙酸(浓度5%)中。取100 μL溶液与600 μL的蒽酮溶液(浓度0.2%)混匀,沸水浴5 min。冷却后以空白管调零,测定各样品与葡萄糖标准溶液在620 nm处的吸光度,描计标准曲线后计算肌糖原含量(单位:μg/mg)。
1.8 肌纤维类型测定
利用ATP酶染色法鉴定I型和II型骨骼肌纤维:骨骼肌标本置于4%的多聚甲醛缓冲液中固定4~8 h后进行常规石蜡包埋、切片(5 μm),用ATP酶染色法鉴定肌纤维类型:碱预孵(pH 10.6)后,I型肌纤维ATP酶活性被抑制,II型肌纤维ATP酶活性仍然保持,故II型纤维被染成深色,I型纤维则着色较浅。封固后,切片用显微照相图像采集系统进行照相,用Simple PCI图像分析软件分析肌纤维类型分布以及肌细胞横截面积(cross-sectional area,CSA)。
1.9 蛋白表达量测定
利用Western Blot法测定AMPKα、磷酸化AMPKα(phosphorylation of AMPKα,p-AMPKα)、p38 MAPK、p-p38 MAPK、CaN、PGC-1α、活化T细胞核因子(nuclear factor of activated T cells,NFAT)c1亚基(NFATc1)蛋白表达量。取50 mg骨骼肌组织研磨、匀浆裂解,离心(4℃、15000 g)30 min,用考马斯亮蓝法测定总蛋白浓度。取10 μg蛋白样品经15% SDS-PAGE分离后转移至PVDF膜。一抗4℃静置过夜,二抗37℃孵育1.5 h,充分洗涤后,使用ECL发光成像,扫描各条带灰度值。以β-actin为内参蛋白,计算目的蛋白的表达量=目的蛋白灰度值/β-actin灰度值,以r-C组比目鱼肌目的蛋白表达量为基准,计算各组与基准的倍数表示蛋白相对表达量。
1.10 MHC亚型测定
方法同1.9(Western Blot法)。成像扫描后,MHC呈现为四条清晰的条带,即I、IIa、IId/x和IIb。根据蛋白质分子量的差异,不同MHC亚型在凝胶电泳中迁移率不同,I>IIb>IId/x>IIa。用凝胶图像分析软件分析MHC各亚型灰度值并计算其百分构成比(%)。
1.11 统计学处理
所有数据以“均数±标准差”表示,组间比较使用单因素方差分析(One-Way ANOVA),多重比较使用Bonferroni检验,统计学差异为P<0.05。统计软件为SPSS 17.0。
2 结果
2.1 实验期间动物的一般情况
整个实验期间各组动物均较活泼,未出现精神异常、掉毛、体毛凌乱、无光泽、大便形态改变等不适反应与过度疲劳状态。摄食量和体重在三组间均无显著性差异(P>0.05)。见图1和图2。
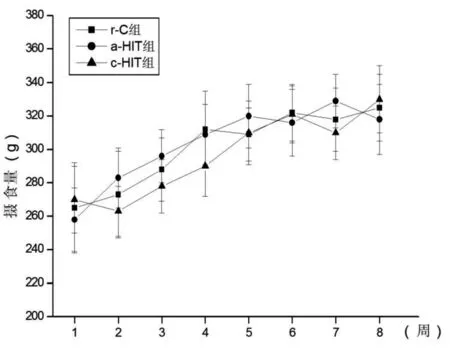
图1 各组摄食量的变化
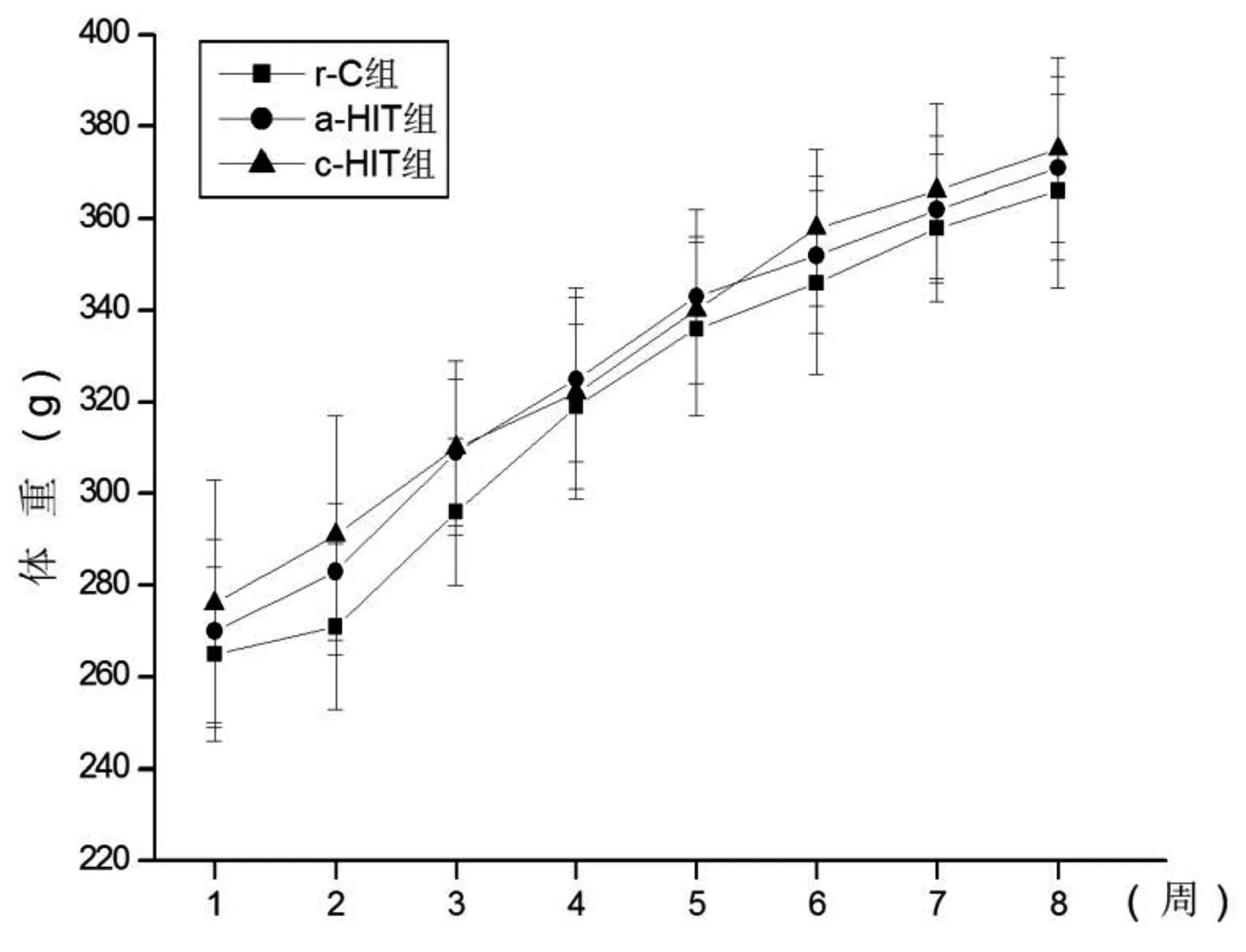
图2 各组体重的变化
2.2 运动能力的变化
8周运动后,c-HIT组大鼠力竭时间明显延长,较r-C组提高了39.2%(P<0.05)。见图3。
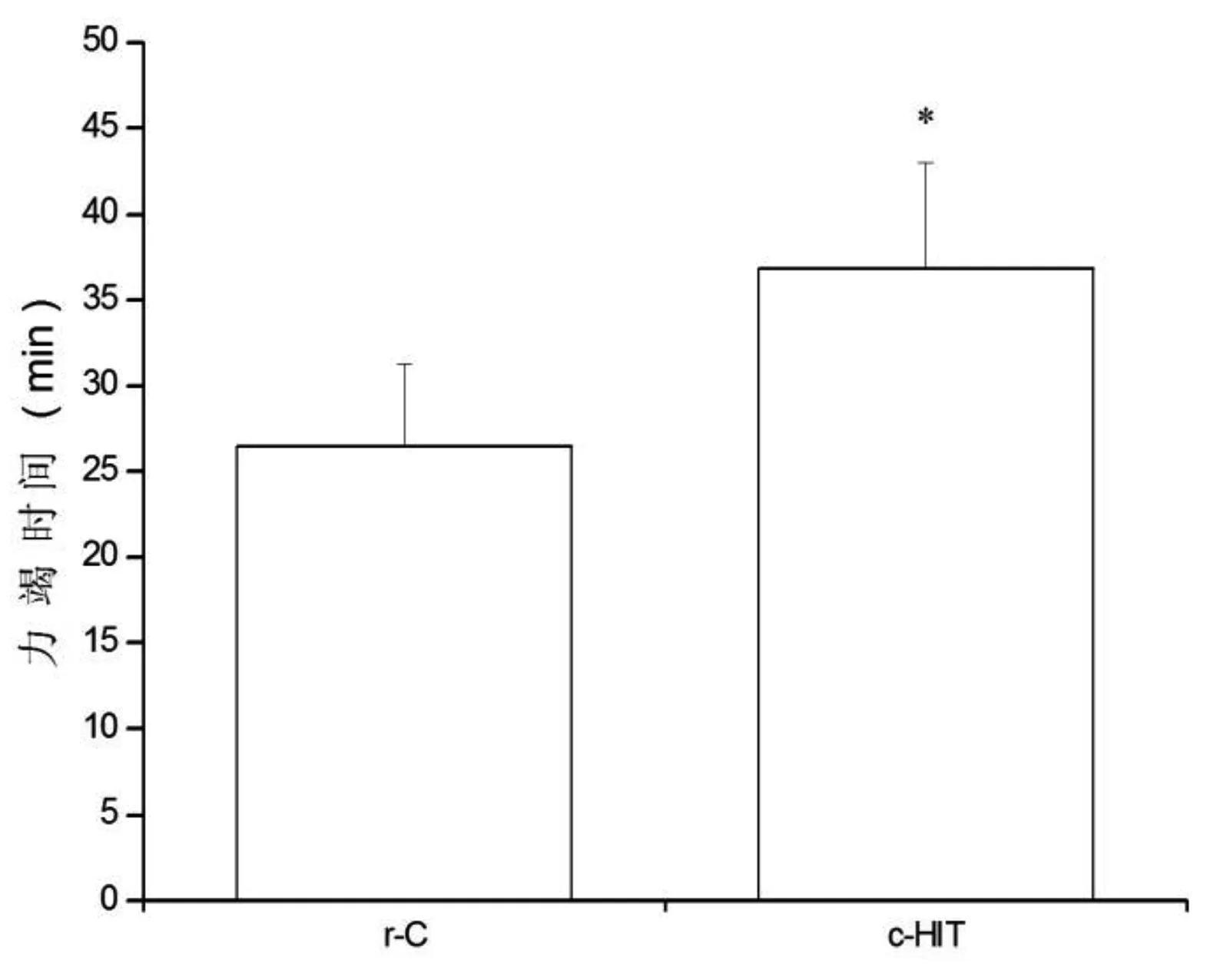
图3 运动能力的变化注:与r-C组比较,*P<0.05
2.3 糖原含量的变化
各组比目鱼肌糖原含量均高于胫骨前肌(P<0.05)。与r-C组比较,a-HIT组糖原含量下降(比目鱼肌:﹣58.1%,P<0.05;胫骨前肌:﹣59.4%,P<0.05),c-HIT组糖原含量升高(比目鱼肌:+57.0%,P<0.05;胫骨前肌:+62.5%,P<0.05),但a-HIT组比目鱼肌和胫骨前肌糖原含量降低的幅度以及c-HIT组糖原含量升高的幅度并无显著性差异(P>0.05)。见图4。
2.4 酶活性的变化
各组比目鱼肌SDH活性均高于胫骨前肌(P<0.05),LDH活性均低于胫骨前肌(P<0.05)。与r-C组比较,c-HIT组比目鱼肌和胫骨前肌SDH活性均升高(P<0.05),LDH只在胫骨前肌升高(P<0.05);a-HIT组比目鱼肌和胫骨前肌SDH和LDH均无显著性改变(P>0.05)。见图5和图6。
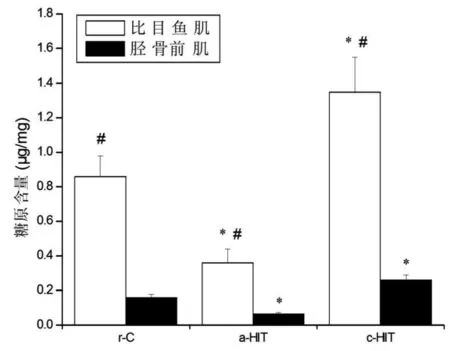
图4 糖原含量的变化注:与r-C组比较,*P<0.05;与胫骨前肌比较,#P<0.05
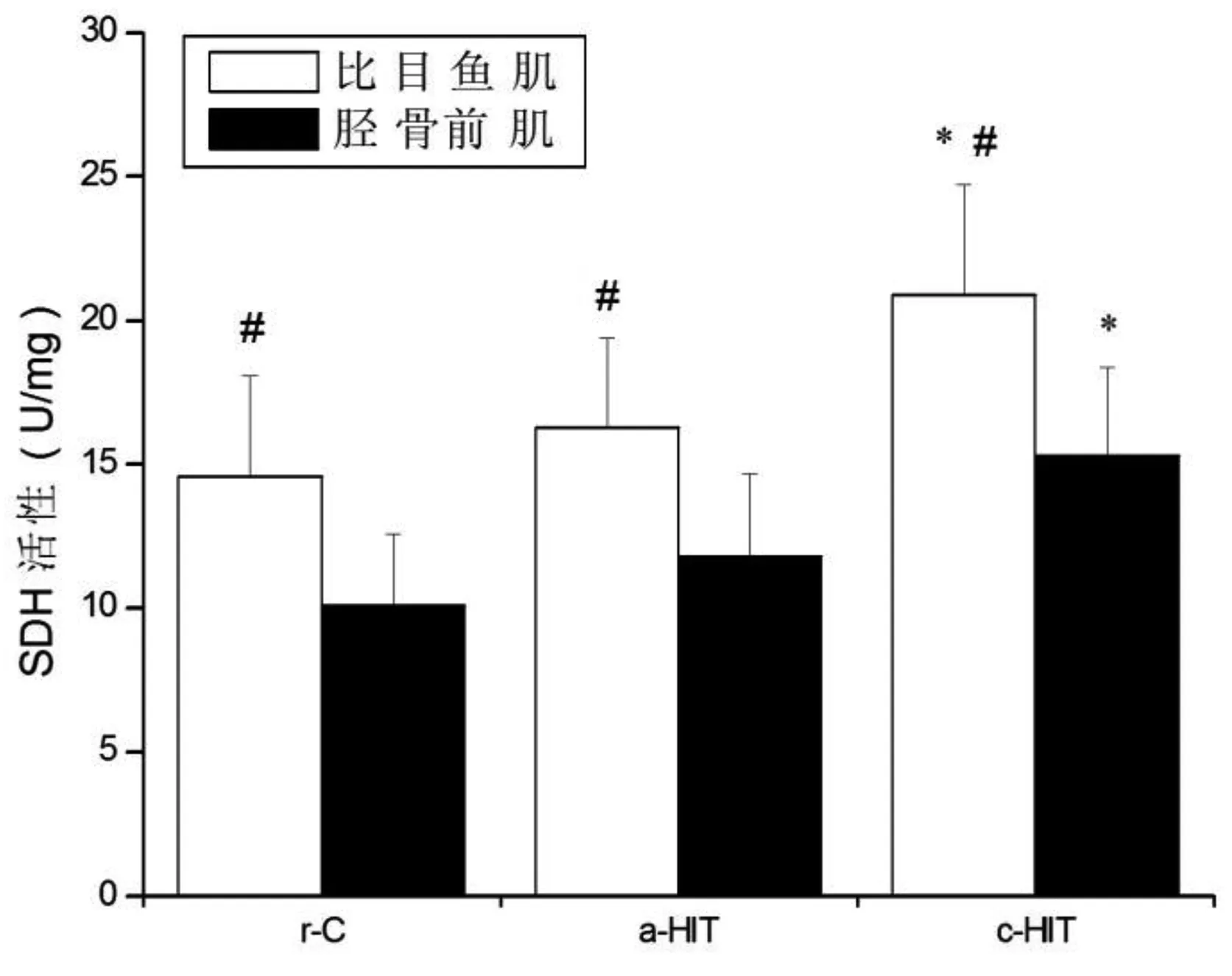
图5 SDH活性的变化注:与r-C组比较,*P<0.05;与胫骨前肌比较,#P<0.05
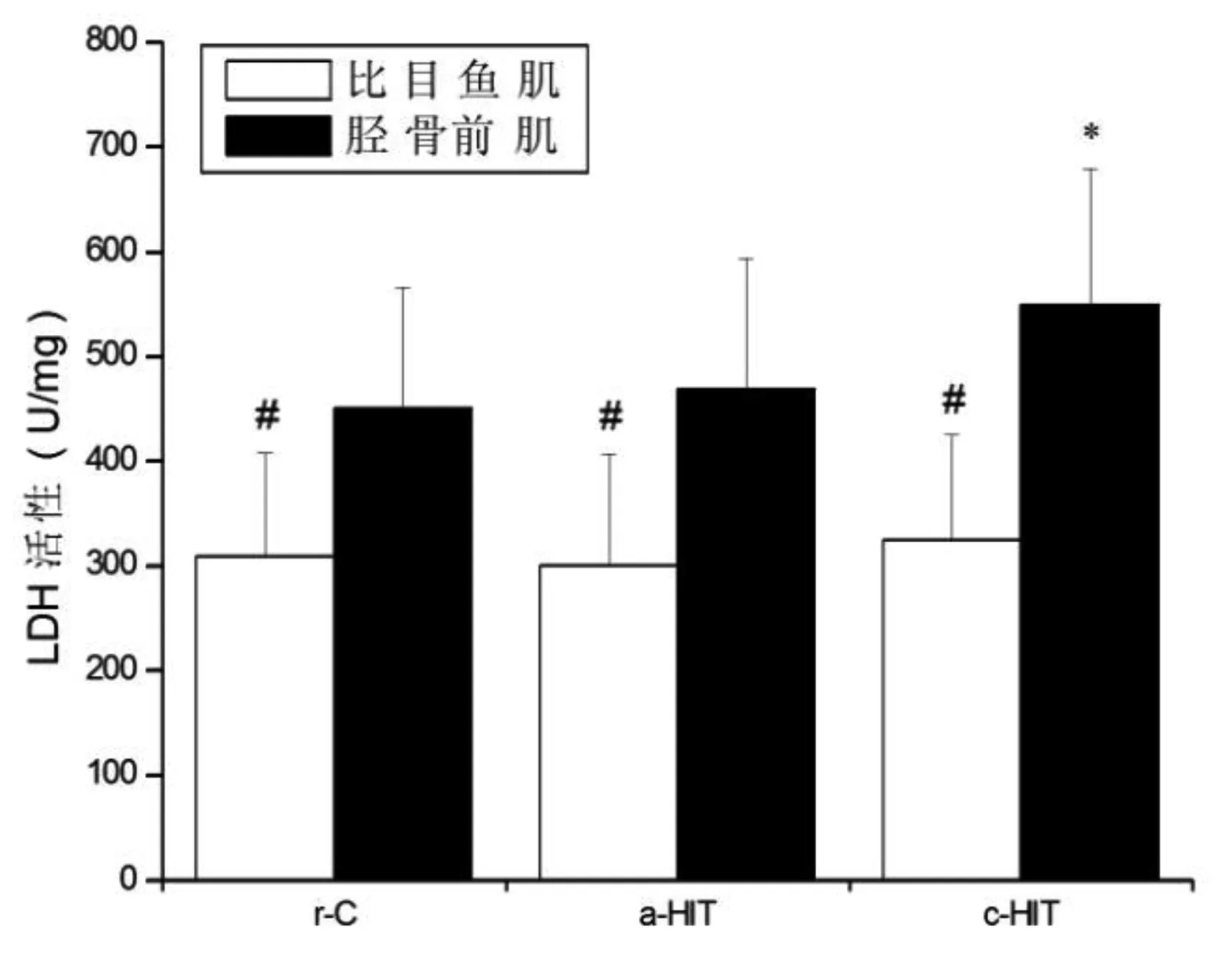
图6 LDH活性的变化注:与r-C组比较,*P<0.05;与胫骨前肌比较,#P<0.05
2.5 肌纤维类型分布与CSA的变化
ATP酶染色见图7和图8,其中I型肌纤维着色较深,II型肌纤维着色较浅。肌纤维分布和CSA见图9和图10。与r-C组比较,c-HIT组比目鱼肌和胫骨前肌I型肌纤维比例增加(P<0.05),II型肌纤维比例减少(P<0.05),CSA无显著性变化(P>0.05),a-HIT组肌纤维比例和CSA均无显著性变化(P>0.05)。

图7 比目鱼肌ATP酶染色
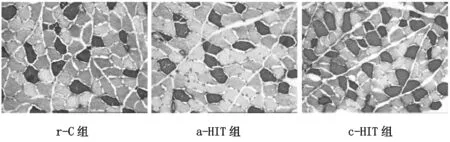
图8 胫骨前肌ATP酶染色
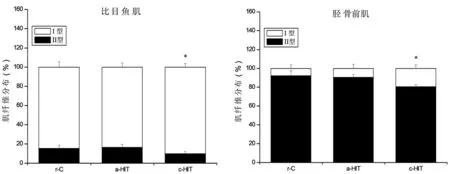
图9 比目鱼肌和胫骨前肌I型与II型肌纤维分布注:与r-C组比较,*P<0.05

图10 比目鱼肌和胫骨前肌CSA注:与II型肌纤维比较,*P<0.05
2.6 蛋白表达量的变化
各组比目鱼肌p-AMPKα/AMPKα、p-p38 MAPK/p38 MAPK、PGC-1α表达量均高于胫骨前肌(P<0.05),CaN和NFATc1表达量均低于胫骨前肌(P<0.05)。与r-C组比较,a-HIT组p-AMPKα/AMPKα(比目鱼肌:+45.0%,P<0.05;胫骨前肌:+40.0%,P<0.05)、p-p38 MAPK/p38 MAPK(比目鱼肌:+51.0%,P<0.05;胫骨前肌:+47.5%,P<0.05)、CaN(比目鱼肌:+43.6%,P<0.05;胫骨前肌:+36.7%,P<0.05)、PGC-1α(比目鱼肌:+34.0%,P<0.05;胫骨前肌:+40.1%,P<0.05)和NFATc1(比目鱼肌:+45.1%,P<0.05;胫骨前肌:+41.6%,P<0.05)表达量均升高,但升高的幅度并无显著性差异(P>0.05);c-HIT组PGC-1α(比目鱼肌:+135.2%,P<0.05;胫骨前肌:+129.6%,P<0.05)和NFATc1(比目鱼肌:+187.2%,P<0.05;胫骨前肌:+169.5%,P<0.05)显著性升高,但升高的幅度并无显著性差异(P>0.05)。见图11~15。

图11 p-AMPKα蛋白表达量注:与r-C组比较,*P<0.05;与胫骨前肌比较,#P<0.05
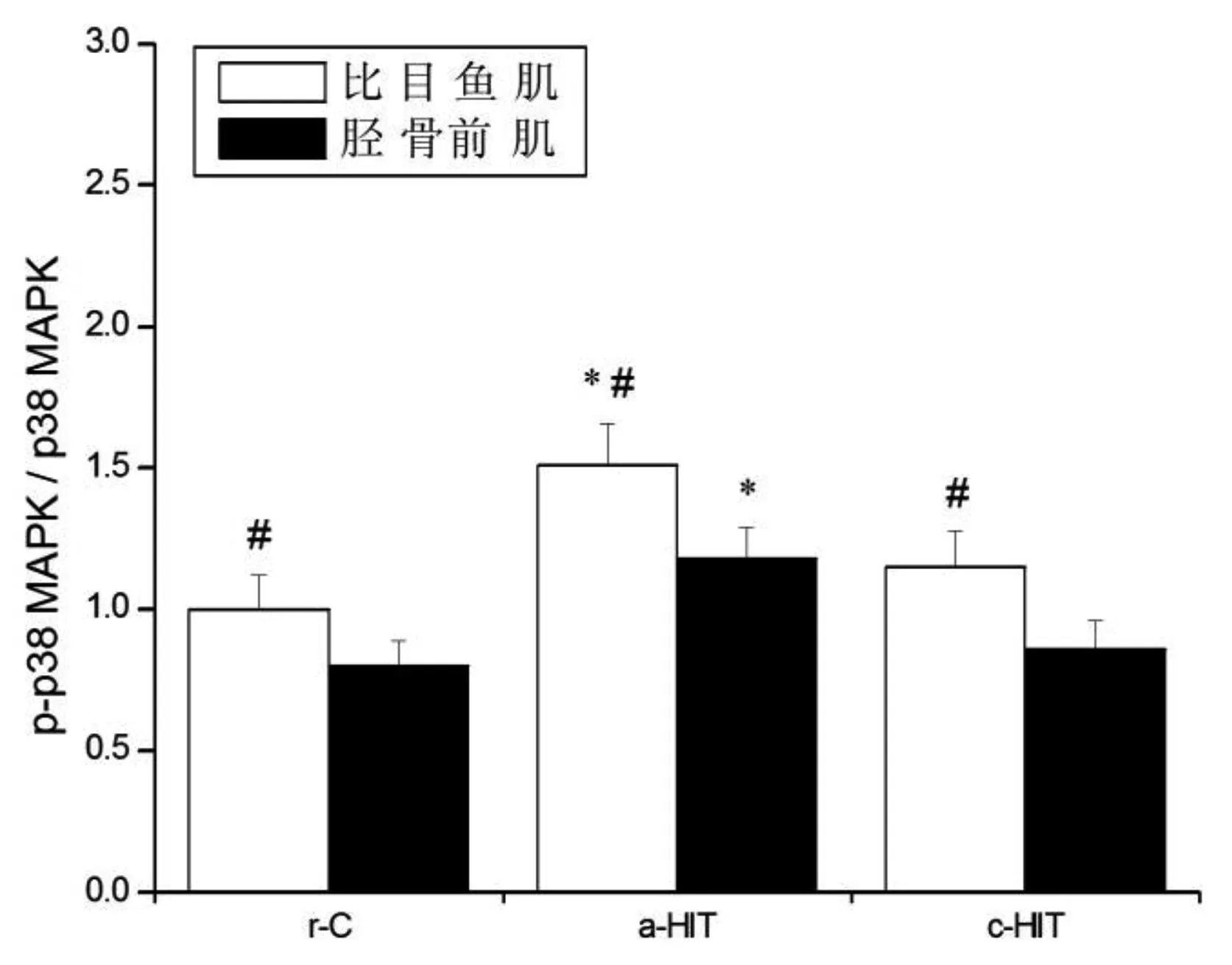
图12 p-p38 MAPK蛋白表达量注:与r-C组比较,*P<0.05;与胫骨前肌比较,#P<0.05
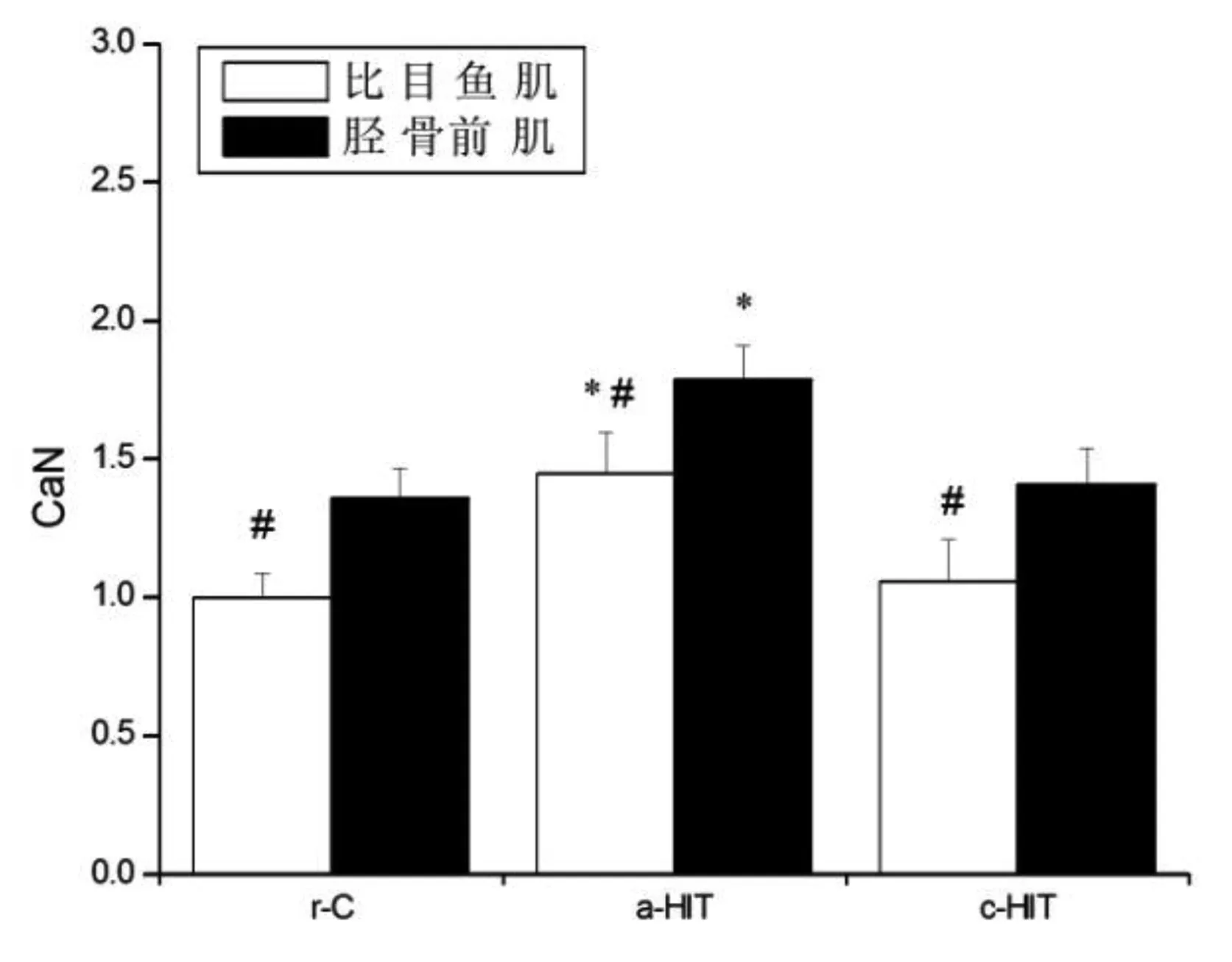
图13 CaN蛋白表达量注:与r-C组比较,*P<0.05;与胫骨前肌比较,#P<0.05
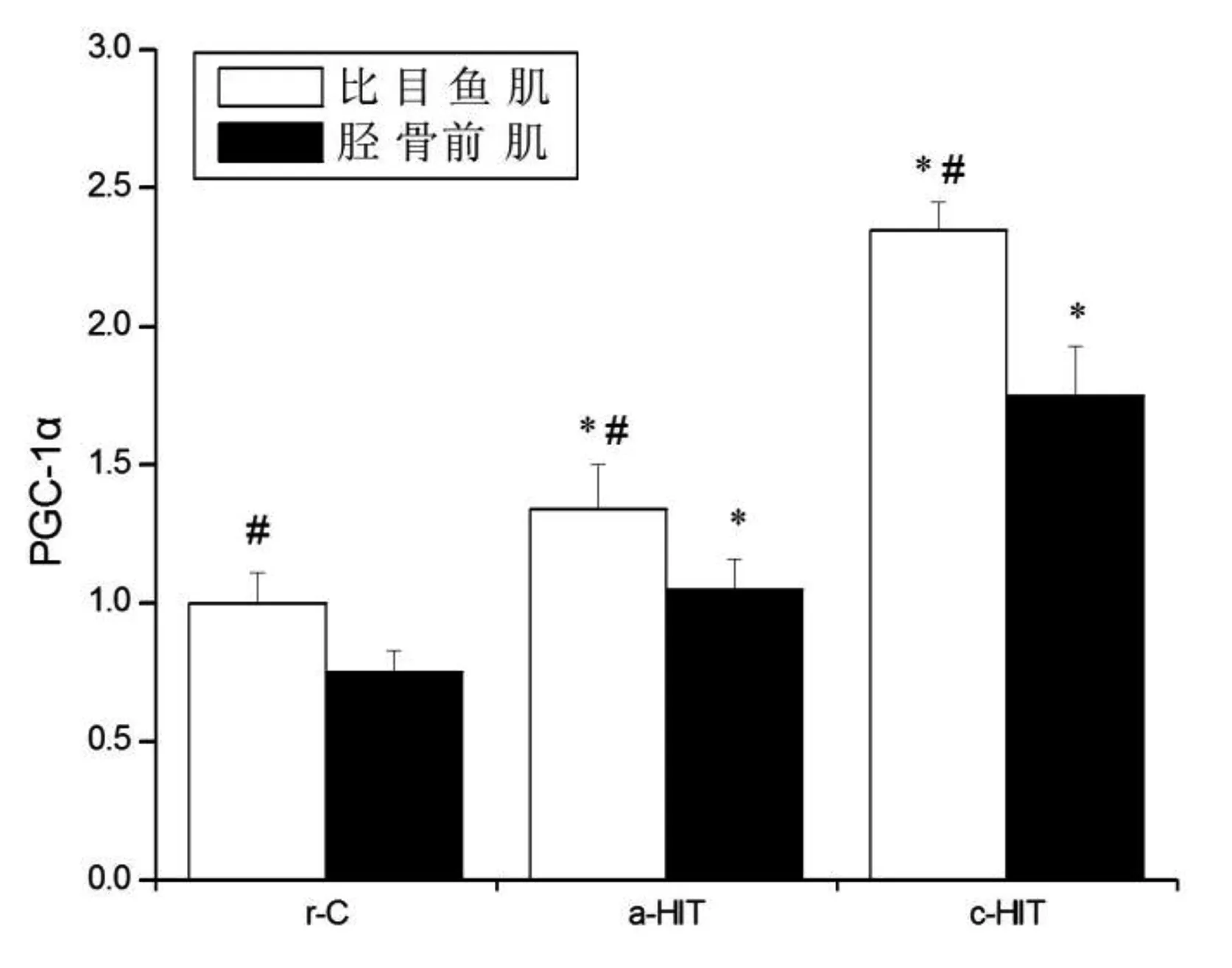
图14 PGC-1α蛋白表达量注:与r-C组比较,*P<0.05;与胫骨前肌比较,#P<0.05
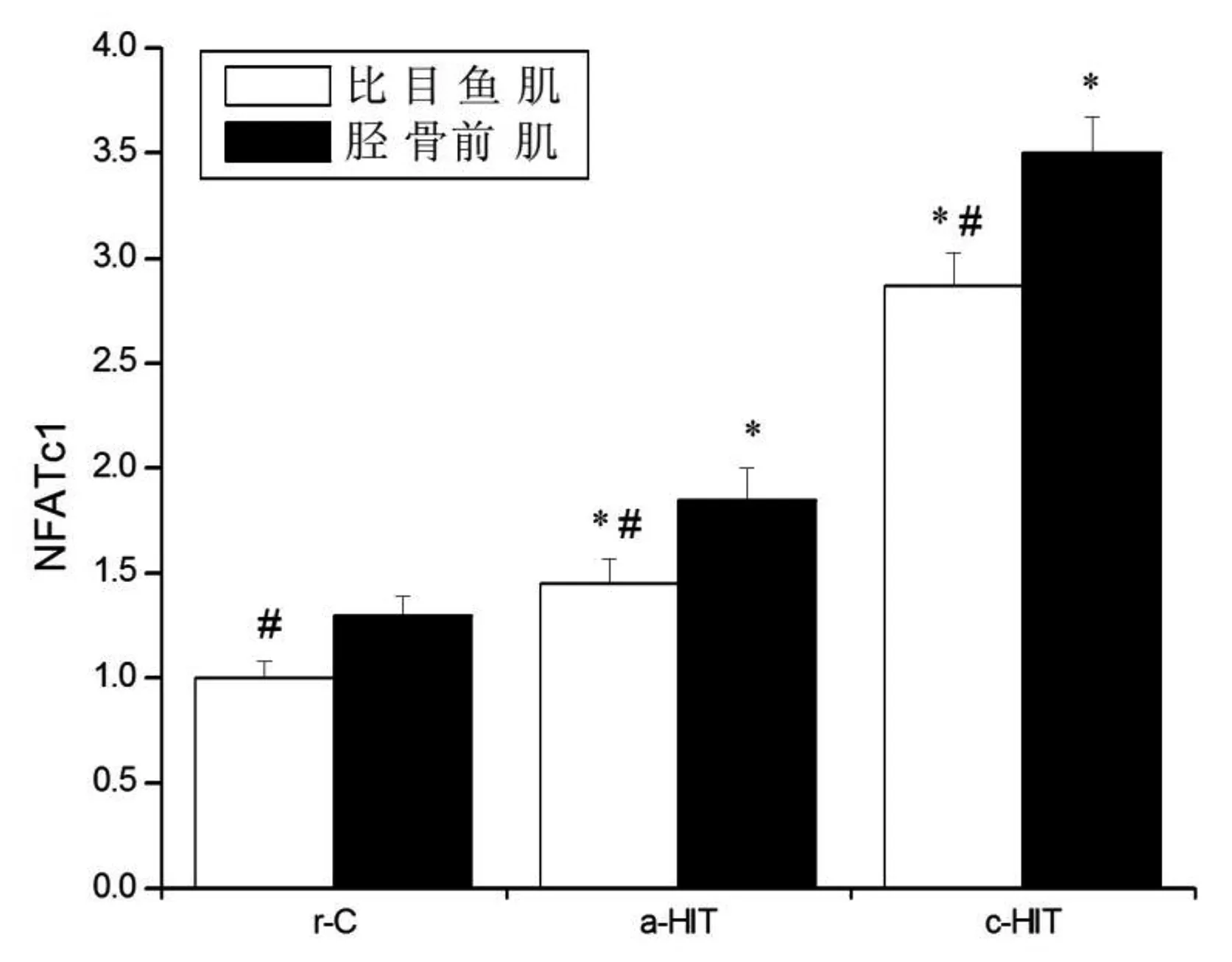
图15 NFATc1蛋白表达量注:与r-C组比较,*P<0.05;与胫骨前肌比较,#P<0.05
2.7 MHC亚型的变化
与r-C组比较,c-HIT组比目鱼肌MHC IIa型和IIb型比例减少(P<0.05),I型比例增加(P<0.05),胫骨前肌MHC IIb和IId/x型减少(P<0.05),IIa和I型增加(P<0.05);a-HIT组MHC各亚型均无显著性改变(P>0.05)。见表1和表2。

表1 比目鱼肌MHC亚型的变化
注:与r-C组比较,*P<0.05

表2 胫骨前肌MHC亚型的变化
注:与r-C组比较,*P<0.05
3 讨论
3.1 急性HIT时肌纤维的募集方式及对肌细胞内信号通路的影响
肌纤维的募集方式一般用不同类型肌纤维糖原耗竭的程度表示[4]。持续亚极量运动时肌纤维募集方式与运动强度有关,低强度时I型肌纤维首先被募集,随着运动强度增加,II型肌纤维逐渐动员[4]。基于此我们推测,HIT时强度较高,因此理应主要动员I型肌纤维。然而出乎意料的是,本研究中虽然a-HIT组比目鱼肌和胫骨前肌糖原含量均下降,但下降的幅度并无显著性差异,提示HIT可同时募集快肌和慢肌纤维,这与Greenhaff等以超极量运动(supramaximal exercise)为模型得到的结果基本一致(同时动员I和IIa型)[16]。其可能的解释是,HIT时强度较高(无氧代谢为主,同时产生大量乳酸)而动员II型肌纤维,间歇期虽然完全休息,但运动中消耗的三磷酸腺苷(adenosine triphosphate,ATP)、磷酸肌酸(phosphocreatine,PCr)等能量底物再合成以及乳酸清除依赖于机体的有氧代谢系统,而且在反复多次HIT时,运动开始阶段无氧代谢供能的比例较高,随后有氧代谢参与再合成ATP的比例逐渐增加[17],因此HIT间歇期氧化能力较强的I型肌纤维同时被动员。
研究发现,急性运动能够激活肌细胞内多种信号转导途径[18],每次急性运动的积累效应(即长期运动)最终可改善线粒体容量和氧化能力。AMPK/PGC-1α、MAPK/PGC-1α和CaN/NFAT是调控肌纤维类型分布最重要的三条信号通路[4]。运动时能量状态改变(如AMP/ATP比值升高)活化AMPK,自由基和机械应力作用激活MAPK,AMPK和MAPK共同促进PGC-1α表达上调,后者具有促进慢肌纤维表达、线粒体生物合成、氧化磷酸化和脂肪酸氧化等作用,其在骨骼肌中表达水平的高低与肌纤维类型关系密切;胞浆钙离子浓度增加激活CaN并使NFAT去磷酸进入胞核,诱导慢肌纤维基因表达增加[4]。然而不同肌纤维对于急性HIT的反应则鲜有关注。本研究发现,比目鱼肌和胫骨前肌中p-AMPKα、p-p38 MAPK、CaN以及PGC1-1α和NFATc1在运动后即刻均显著性上调,且增加的幅度在不同类型肌肉间并无显著性差异,提示急性HIT时不同肌纤维多种信号途径存在基本一致的激活模式。Bartlett等[11]证实,持续耐力训练(70%VO2max)和HIT(90%VO2max)激活肌细胞内信号途径(PGC-1、AMPK、p38和p53等)的作用效果类似,而Egan等[19]则指出,肌细胞信号途径的激活与运动强度有关。此外,Trisha等[20]发现,HIT后AMPK和p38无显著性变化,而Gibala等[21]的研究结果与本研究一致,其机制未明。由于Trisha等的运动时间(20 s)低于Gibala等[21](30 s)和本研究(2.5 min),推测可能与HIT方案特别是高强度运动持续时间有关。因此,运动激活肌细胞内与线粒体生物合成等事件相关联的信号转导途径可能存在运动强度和运动时间阈值,然而关于“阈值”的范围尚无定论。
总之,一次急性HIT能够同时募集快肌和慢肌纤维并激活肌细胞内与线粒体生物合成、慢肌基因表达上调等事件相关联的多种信号转导通路。
3.2 长期HIT对不同类型肌纤维代谢与分布的调节
运动训练能够上调线粒体有氧代谢酶的活性和表达量,增加毛细血管密度以及肌细胞内的甘油三酯和糖原储备量,进而提升骨骼肌的氧化能力并最终改善运动表现[1]。多项研究证实[4, 5, 7, 11, 12],HIT能够有效改善有氧、无氧运动能力,其机制主要与运动诱导的外周适应(主要是骨骼肌)有关,此外,与持续耐力训练相比,HIT可募集更多的肌纤维参与收缩。因此,本研究对不同类型肌纤维对于长期HIT的适应性改变(代谢与分布)进行深入探索。
3.2.1 有氧代谢能力以及肌纤维分布的变化
本研究发现,与r-C组比较,c-HIT组递增负荷运动实验时的力竭时间明显延长,提示运动能力改善。SDH是线粒体内参与有氧代谢的关键酶,其表达量与线粒体氧化能力和线粒体容量正相关。Shepherd等[22]报道,长期HIT后线粒体细胞色素C氧化酶(cytochorome c oxidase,COX)表达升高,但Larsen等[23]指出 COX与线粒体容量相关性较低(r =0.55),而SDH则与线粒体容量高度相关(r =0.73),本研究选取SDH作为骨骼肌有氧代谢能力的参数更有说服力。在本研究中,c-HIT组比目鱼肌和胫骨前肌SDH活性较r-C组上调,说明不同类型肌纤维的氧化能力均得到明显提高。此外,c-HIT组与线粒体生物合成相关的基因PGC-1α表达量显著性上调。上述不同类型肌纤维的适应性改变与急性HIT时肌纤维的激活模式基本一致,提示一次HIT时所募集的肌纤维种类决定了该类型肌纤维在多次HIT后氧化能力得到提高。结合本研究的结果,我们认为,急性HIT能够同时动员快肌和慢肌纤维并激活肌细胞内多种信号转导途径,每次急性HIT的积累效应(即长期运动)最终可同时改善两类肌纤维线粒体容量和氧化能力。
骨骼肌可根据功能需求而发生表型适应性改变。HIT对于肌纤维类型分布的影响尚无定论,有研究证实,HIT和持续耐力训练均可提高I型肌纤维比例[20, 24],但另有学者的实验结果显示,HIT后IIa型增加,I型减少[25],可能与运动模型以及选取的肌肉标本有关。本研究ATP酶染色法发现,c-HIT组比目鱼肌和胫骨前肌中I型肌纤维比例增加,II型肌纤维比例减少;MHC亚型电泳结果则显示,比目鱼肌中IIb和IIa型肌纤维比例减少,I型增加,而胫骨前肌中IIb和IId/x型减少,IIa和I型增加。虽然两种方法得到的结果不尽相同,但比较肯定的是长期HIT后I型肌纤维比例升高,其机制可能与长期运动诱导PGC-1α表达上调有关。骨骼肌PGC-1α 特异性过表达上调I型肌纤维比例,线粒体生物合成增加,抗疲劳能力增加;而骨骼肌特异性敲除PGC-1α 将下调I型肌纤维比例并增加IId/x和IIb等酵解型纤维[26]。细胞培养实验发现,PGC-1α辅助肌细胞增强因子-2 (myocyte enhancer factors-2, MEF2)诱导I型肌纤维中慢肌肌钙蛋白和肌红蛋白的表达[27]。
3.2.2 无氧代谢能力的变化
LDH是机体糖代谢中无氧酵解过程的一种重要酶,LDH活性高低在一定程度上能反映糖酵解能力的高低。在本研究中,c-HIT组LDH活性在胫骨前肌显著性上调,而比目鱼肌则无显著性改变,提示长期HIT只提高了快肌纤维的无氧代谢(糖酵解)能力。人体试验显示[7],HIT可同时改善机体的有氧和无氧运动能力,而持续耐力训练只能够提高机体的有氧运动能力,本研究在分子水平(LDH活性)和细胞(不同类型肌纤维分布)水平上证实了上述结论。HIT同时提高有氧、无氧代谢能力的具体机制尚不得而知,结合本研究的结果以及既往的研究报道,我们认为,持续耐力训练运动强度不高(中等或者低强度),只能刺激有氧供能系统,主要募集慢肌肌纤维并增加I型肌纤维比例,而HIT强度较高(至少高于无氧阈),可同时激活有氧和无氧供能系统,快肌和慢肌纤维同步募集,并上调快肌中I型和IIa型肌纤维比例。
此外,Gibala等[28]指出,骨骼肌对乳酸等代谢产物的缓冲能力改善是HIT提高机体无氧运动能力的重要因素。另外一个重要的机制是中枢神经系统的功能状态(即神经-肌肉调控)如肌纤维募集速率、传入神经纤维兴奋频率以及运动单位的同步化等。Creer等[29]将受试者分为HIT联合耐力训练组和单纯耐力训练组,结果发现,4周联合运动能够增加运动单位的募集速率并提高无氧运动能力,而单纯耐力训练组则无上述改变,提示神经-肌肉功能改善是HIT提高无氧能力的重要原因之一。
4 结论
本研究针对急性HIT后肌纤维的募集方式和相关信号通路以及长期HIT诱导不同类型肌纤维代谢和分布的差异进行了深入探讨,结果发现,(1)一次急性HIT能够同时募集快肌和慢肌纤维并激活细胞内多种信号转导途径(AMPK、MAPK和CaN)。(2)长期HIT提高快肌中I型和IIa型肌纤维以及慢肌中I型肌纤维比例;增加快肌和慢肌糖原含量,上调快肌和慢肌氧化酶(SDH)活性并促进PGC-1α表达(线粒体生物合成),进而改善氧化代谢能力;上调快肌纤维酵解酶(LDH)活性,改善其无氧代谢能力。(3)长期HIT可显著提高机体的运动能力。
从运动处方的角度考量,多种运动方式中能够最大限度募集肌纤维并激活细胞内信号转导通路者将诱导机体产生最大程度的适应性改变,由于HIT可同时动员I型和II型肌纤维,改善有氧、无氧代谢水平和运动能力,因此是一种省时有效的训练模式。
[1] Drake JC, Wilson RJ, Yan Z. Molecular mechanisms for mitochondrial adaptation to exercise training in skeletal muscle[J].FASEB J, 2016, 30(1): 13-22
[2] Talbot J, Maves L. Skeletal muscle fiber type: using insights from muscle developmental biology to dissect targets for susceptibility and resistance to muscle disease[J]. Wiley Interdiscip Rev Dev Biol, 2016, 5(4): 518-534
[3] Miller MS, Bedrin NG, Ades PA, et al. Molecular determinants of force production in human skeletal muscle fibers: effects of myosin isoform expression and cross-sectional area[J]. Am J Physiol Cell Physiol, 2015, 308(6): C473-484
[4] Qaisar R, Bhaskaran S, Van Remmen H. Muscle fiber type diversification during exercise and regeneration[J]. Free Radic Biol Med, 2016, 98(2): 56-67
[5] Ito S, Mizoguchi T, Saeki T. Review of High-intensity Interval Training in Cardiac Rehabilitation[J]. Intern Med, 2016, 55(17): 2329-2336
[6] Costigan SA, Eather N, Plotnikoff RC, et al. High-intensity interval training for improving health-related fitness in adolescents: a systematic review and meta-analysis[J]. Br J Sports Med, 2015, 49(19): 1253-1261
[7] 黎涌明. 高强度间歇训练对不同训练人群的应用效果[J]. 体育科学, 2015 (8): 59-75,96
[8] 施曼莉, 朱荣. 高强度间歇运动对骨骼肌糖原含量的影响及机制研究[J]. 体育科学, 2015(4): 66-71
[9] 王京京, 张海峰. 高强度间歇训练运动处方健身效果研究进展[J]. 中国运动医学杂志, 2013, 32(3): 246-254
[10] Weston KS, Wisloff U, Coombes JS. High-intensity interval training in patients with lifestyle-induced cardiometabolic disease: a systematic review and meta-analysis[J]. Br J Sports Med, 2014, 48(16): 1227-1234
[11] Bartlett JD, Hwa JC, Jeong TS, et al. Matched work high-intensity interval and continuous running induce similar increases in PGC-1α mRNA, AMPK, p38, and p53 phosphorylation in human skeletal muscle[J]. J Appl Physiol (1985), 2012, 112(7): 1135-1143
[12] Tzanis G, Philippou A, Karatzanos E, et al. Effects of high-intensity interval exercise training on skeletal myopathy of chronic heart failure[J]. J Card Fail, 2016 [Epub ahead of print]
[13] Bedford TG, Tipton CM, Wilson NC, et al. Maximum oxygen consumption of rats and its changes with various experimental procedures[J]. J Appl Physiol, 1979, 47(6): 1278-1283
[14] Fletcher JA, Meers GM, Linden MA, et al. Impact of various exercise modalities on hepatic mitochondrial function[J]. Med Sci Sports Exerc, 2014, 46(6): 1089-1097
[15] 许绍哲, 朱荣. 长期运动训练诱导sd大鼠骨骼肌糖原含量上调的分子机制[J]. 中国运动医学杂志, 2015, 34(1): 42-49
[16] Greenhaff PL, Nevill ME, Soderlund K, et al. The metabolic responses of human type I and II muscle fibres during maximal treadmill sprinting[J]. J Physiol, 1994, 478 (1): 149-155
[17] Larsen RG, Maynard L, Kent JA. High-intensity interval training alters ATP pathway flux during maximal muscle contractions in humans[J]. Acta Physiol (Oxf), 2014, 211(1): 147-160
[18] Kristensen DE, Albers PH, Prats C, et al. Human muscle fibre type-specific regulation of AMPK and downstream targets by exercise[J]. J Physiol, 2015, 593(8): 2053-2069
[19] Egan B, Carson BP, Garcia-Roves PM, et al. Exercise intensity-dependent regulation of peroxisome proliferator-activated receptor coactivator-1 mRNA abundance is associated with differential activation of upstream signalling kinases in human skeletal muscle[J]. J Physiol, 2010, 588(10): 1779-1790
[20] Scribbans TD, Edgett BA, Vorobej K, et al. Fibre-specific responses to endurance and low volume high intensity interval training: striking similarities in acute and chronic adaptation[J]. PLoS One, 2014, 9(6): e98119
[21] Gibala MJ, McGee SL, Garnham AP, et al. Brief intense interval exercise activates AMPK and p38 MAPK signaling and increases the expression of PGC-1alpha in human skeletal muscle[J]. J Appl Physiol (1985), 2009, 106(3): 929-934
[22] Shepherd SO, Cocks M, Tipton KD, et al. Sprint interval and traditional endurance training increase net intramuscular triglyceride breakdown and expression of perilipin 2 and 5[J]. J Physiol, 2013, 591(3): 657-675
[23] Larsen S, Nielsen J, Hansen CN, et al. Biomarkers of mitochondrial content in skeletal muscle of healthy young human subjects[J]. J Physiol, 2012, 590(14): 3349-3360
[24] Kazior Z, Willis SJ, Moberg M, et al. Endurance exercise enhances the effect of strength training on muscle fiber size and protein expression of Akt and mTOR[J]. PLoS One, 2016, 11(2): e0149082
[25] Dawson B, Fitzsimons M, Green S, et al. Changes in performance, muscle metabolites, enzymes and fibre types after short sprint training[J]. Eur J Appl Physiol Occup Physiol, 1998, 78(2): 163-169
[26] 于亮, 张鹏, 王瑞元,等. PGC-1α对骨骼肌肌纤维类型及运动能力的调控作用[J]. 生理科学进展, 2013(1): 59-62
[27] Lin J, Wu H, Tarr PT, et al. Transcriptional co-activator PGC-1 alpha drives the formation of slow-twitch muscle fibres[J]. Nature, 2002, 418(6899): 797-801
[28] Gibala MJ, Little JP, van Essen M, et al. Short-term sprint interval versus traditional endurance training: similar initial adaptations in human skeletal muscle and exercise performance[J]. J Physiol, 2006, 575(3): 901-911
[29] Creer AR, Ricard MD, Conlee RK, et al. Neural, metabolic, and performance adaptations to four weeks of high intensity sprint-interval training in trained cyclists[J]. Int J Sports Med, 2004, 25(2): 92-98
