DKK1基因过表达慢病毒载体构建及其在大鼠肾上腺嗜铬细胞瘤细胞PC12中的表达
2018-03-19李慧华仝书严陈锐张才溢耿德勤
李慧华,仝书严,陈锐,张才溢,耿德勤
(徐州医科大学,江苏徐州221004)
Dickkop-1(DKK1)是DKK蛋白家族成员之一。DKK1基因是经典Wnt/β-catenin信号通路的抑制剂。DKK1基因可参与诱导头部的产生,在胚胎发育、神经再生、突触形成等体内多种病理生理过程中发挥作用[1,2]。研究发现,机体内DKK1基因表达异常,可引起认知障碍、情绪异常等神经精神疾病[3,4]。近年尸检发现阿尔茨海默病(AD)患者脑组织DKK1基因表达增加。小鼠海马组织DKK1表达随年龄增加而增加,并伴有空间工作记忆障碍。DKK1基因在AD中的作用引起了越来越多的关注[5,6]。此外,DKK1基因还在肿瘤及肾脏、肝脏、骨疾病中发挥重要作用[7,8]。大鼠肾上腺嗜铬细胞瘤PC12细胞作为类神经元细胞,在结构、功能上与神经元有很多相似之处,但较神经元容易培养,常用于神经精神系统疾病的体外研究[9]。2016年6月~2017年6月,本研究选用PC12细胞为研究对象,建立稳定细胞系,为进一步探讨DKK1基因在神经精神疾病中的作用及分子生物学研究奠定基础。
1 材料与方法
1.1 材料 目的基因DKK1 (NM_001106350)、慢病毒载体质粒GV358(Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin)、慢病毒包装质粒pHelper1.0、pHelper2.0和E.coli DH5α感受态细菌、293T细胞(上海吉凯基因化学技术有限公司);PC12细胞为本实验室保存。RPMI1640培养基(Cyclone),胎牛血清(Gemini),嘌呤霉素(Selleck),蛋白裂解液 (上海吉凯基因化学技术有限公司),DKK1抗体(Abcam),β-actin抗体(Santa Cruz),限制性内切酶AgeI(NEB)、Taq DNA聚合酶(SinoBio),dNTP(Takara),Primer(捷瑞生物),In-FusionTMPCR Cloning Kit(clontech),质粒抽提试剂盒(Promega),琼脂糖凝胶DNA回收试剂盒(天根生化),Lipofectmine 2000(invitrogen),SYBR®qPCR Mix(Roche)。
1.2 DKK1基因扩增 采用RT-PCR法。参考GenBank中DKK1的cDNA编码序列(NM_001106350),使用Primer5软件设计引物,交由上海吉凯基因化学技术有限公司合成引物序列。DKK1基因上游引物序列:5′-GAGGATCCCCGGGTACCGGTCGCCACCATGACGGTTGTGCGTGCAGTGGCAG-3′,下游引物序列:5′-TCCTTGTAGTCCATACCGTGTCTCTGGCAGGTGTGGAGCCTG-3′(在上下游引物5端分别加入限制性内切酶AgeI/AgeI酶切位点及保护碱基)。以含有DKK1基因的cDNA库为模板,扩增DKK1基因序列。PCR反应体系:98 ℃预变性5 min、98 ℃变性10 s、55 ℃退火10 s、72 ℃延伸90 s,共30个循环;72 ℃保温8 min,4 ℃保存。PCR产物大小854 bp。扩增产物行1%琼脂糖凝胶电泳,用DNA凝胶回收试剂盒切胶回收RT-PCR产物。
1.3 DKK1基因慢病毒表达载体的构建与鉴定 用限制性内切酶AgeI/AgeI对GV358载体进行酶切,使其线性化。琼脂糖凝胶电泳回收酶切产物。将线性化的GV358载体DNA和DKK1基因酶切产物进行连接反应,于冰水浴中配制如下反应体系:ddH2O 2.5 μL,5×CE Ⅱ Buffer 2 μL,酶切后的载体DNA 2.5 μL,纯化后的PCR产物片段2 μL,ExnaseTMⅡ 1 μL;于37 ℃反应30 min,随后置于冰水浴中冷却5 min后立即转化至大肠杆菌DH5a感受态细菌。将细菌接种于含有氨苄青霉素的平板上,在恒温培养箱中倒置培养12~16 h。挑取重组阳性克隆行PCR初步鉴定后及送测序。PCR鉴定上游引物:5′-GGGTCAATATGTAATTTTCAGTG-3′,下游引物:5′-CCTTATAGTCCTTATCATCGTC-3′,产物1 005 bp。反应体系包括:ddH2O 9.2 μL,2× Taq Plus Master Mix 10 μL,上下游引物各0.4 μL,单个菌落,总体积20 μL。反应条件:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环,72 ℃延伸5 min,保存。采用空载体质粒为阴性对照组,有GAPDH的载体为阳性对照组,排除假阴性和假阳性结果。对PCR阳性克隆片段进行测序。
1.4 重组慢病毒的包装及滴度测定 GV358-DKK1基因慢病毒载体系统包装:取对数生长期的293T细胞,调整细胞密度为5×106/mL,胰酶消化后接种于直径10 cm细胞培养皿中,37 ℃、5% CO2培养箱内培养24 h,细胞长至70%~80%融合时进行转染。将GV358-DKK1质粒和两种病毒包装辅助质粒pHelper1.0、pHelper2.0分别进行高纯度无内毒素质粒抽提,采用Lipofectamine2000脂质体介导的瞬时转染法进行共转染,包装293T细胞。培养6 h后更换为完全培养基,继续培养48 h收集上清,离心去除细胞碎片;0.45 μm滤器过滤,超速离心浓缩后收集病毒浓缩液,-80 ℃保存。将293T细胞按4×104/孔接种96孔板,分别加入逐孔稀释法稀释的病毒液,48 h后观察荧光表达情况,估计慢病毒转染目的细胞的效率。同时设立空载体对照组。收取细胞抽取基因组DNA并做定量PCR检测,计算滴度,公式:qPCR滴度=N×C/V。N为感染时24孔板中对应孔的细胞数量,C(每个细胞中含有的慢病毒个数)=(A拷贝数/B拷贝数)×2,V为对应孔中感染的慢病毒体积。
1.5 PC12细胞感染及稳转细胞株筛选 PC12细胞培养于含10% FBS的1640培养基中,取对数生长期的PC12细胞接种于6孔板中,第2天细胞密度50%左右进行病毒感染。将细胞随机分为三组,空白对照组、空载体阴性对照组、PC12-DKK1组,空载体阴性对照组、PC12-DKK1组分别用制备的空载体慢病毒(GV358-Vector)及GV358-DKK1颗粒进行感染,24 h后更换为正常培养基继续培养;空白对照组常规培养。经嘌呤霉素(终浓度1.5 μg/mL)筛选2周后获得稳定感染的细胞株。
1.6 PC12细胞中DKK1 mRNA表达检测 采用qRT-RCR技术。收集三组细胞,分别加入TRIzol等提取总RNA,琼脂糖凝胶电泳确定RNA完整性,紫外分光光度计检测RNA的浓度和纯度;RNA逆转录获得cDNA,再以适量cDNA为模板进行PCR扩增。内参GAPDH引物序列:上游5′-TCCCTCAAGATTGTCAGCA-3′、下游5′-AGATCCACAACGGATACATT-3′;DKK1引物序列上游5′-TTGACAACTACCAGCCCTACCC-3′、下游5′-CTCGAGGTAAATGGCTGTGGTC-3′。扩增条件:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环35次,72 ℃ 10 min,4 ℃保存。采用2-ΔΔCt法计算基因相对表达量。
1.7 PC12细胞内DKK1蛋白表达检测 采用Western blotting法。收集三组细胞,用细胞裂解液进行裂解,提取总蛋白,BCA法测定蛋白浓度,计算上样量,配制10% SDS-PAGE凝胶,常规电泳、转膜、封闭,随后分别用一抗DKK1(1∶1 000)和β-actin(1∶1 000)4 ℃孵育过夜,室温孵育二抗2 h,Odyssey双色红外激光成像系统进行条带扫描。采用Image J软件分析条带灰度值,用DKK1灰度值比内参灰度值作为DKK1蛋白的相对表达量。
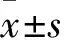
2 结果
2.1 GV358-DKK1慢病毒载体的构建结果 用设计的DKK1引物进行PCR扩增,琼脂糖凝胶电泳图谱可见大小约为854 bp的特异性条带。抗生素筛选菌落,PCR对重组子进行鉴定,扩增出大小为1 005 bp的阳性克隆片段,对阳性克隆菌进行测序,测序结果与目标序列完全一致。证明GV358-DKK1慢病毒载体构建成功。
2.2 慢病毒包装及病毒滴度测定结果 三质粒(GV358-DKK1/GV358-vector、Helper1.0、Helper2.0)共同转染293T细胞48 h后荧光显微镜下见大量绿色荧光,约95%以上且荧光强度高,293T细胞生长状态好,表明慢病毒包装成功且转染效率高。收集、浓缩病毒后逐孔稀释滴度测定法测定GV358-vector和GV358-DKK1的滴度分别为6×108、2×108TU/mL。
2.3 PC12细胞慢病毒感染结果 慢病毒感染PC12细胞72 h后可见少许荧光。用嘌呤霉素连续筛选2周后,荧光显微镜下所有细胞可见绿色荧光,感染效率大于95%。
2.4 感染后各组细胞内DKK1 mRNA及蛋白表达比较 空白对照组、空载体阴性对照组、PC12-DKK1组细胞DKK1 mRNA相对表达量分别为1.02±0.27、0.97±0.24、133.74±0.93,DKK1蛋白相对表达量分别为1.02±0.14、1.06±0.12、1.48±0.21。PC12-DKK1组DKK1 mRNA及蛋白相对表达量均较空载体阴性对照组和空白对照组高(P均<0.05)。
3 讨论
DKK家族由4个成员(DDK-1、DDK-2、DDK-3、DDK-4)组成[10,11]。1998年,Glinka等首次在两栖动物非洲蟾蜍胚胎头部发育的诱导机制中发现、克隆并定义了DKK1及其家族。DKK1是DKK家族中被研究最多的成员。研究发现,人类DKK1基因位于10号染色体10q11,约3.5 kb,由266个氨基酸组成的分泌型糖蛋白[12]。DKK1结构包含两个保守的半胱氨酸区域,辅脂肪酶折叠区域可与膜受体LRP5/6及另一类穿膜蛋白Kremen1/2结合形成三聚体、内吞,阻断Wnt-Frizzled-LRP5/6复合物形成,进而促进胞内信号分子β-catenin磷酸化,使其泛素化,在胞质内被水解,阻断β-catenin进入细胞核与转录因子TCF、LCF结合,起到负性调节Wnt信号通路的作用[13]。Wnt信号通路在神经发生、神经可塑性中起重要作用,并且与记忆学习功能关系密切,Wnt通路的异常可能是认知损伤的潜在发生机制[14,15]。研究发现,DKK1基因可能作为各种刺激诱导细胞凋亡的重要介质,参与该机制的调控[16]。DKK1基因启动子包含1个p53应答元件,诱导DKK1基因的表达[17]。此外,紫外线和化学治疗剂引起的基因毒性增强了DKK1基因表达,DKK1基因使神经胶质瘤细胞对神经酰胺诱导的细胞凋亡敏感。本课题组前期亦发现DKK1基因可降低PC12细胞活性、促进PC12细胞凋亡[18]。目前未见类似DKK1过表达重组慢病毒转染PC12细胞的研究报道。
近期研究发现,DKK1基因与许多中枢神经系统疾病的神经退化有关,包括AD、脑缺血和颞叶癫痫等。在细胞和动物的兴奋毒性、β淀粉样毒性、短暂性脑缺血和诱发癫痫的动物模型中DKK1基因的产生早于神经元退化[19]。随着人们对DKK1基因在神经精神疾病中所起作用认识的深入,以DKK1基因为靶点的机制研究不断增加。使用慢病毒作为载体可以提高病毒转染效率,具有获得病毒周期短、滴度高的优点,实现了在细胞中长期稳定表达。本实验通过三质粒系统构建高表达GV358-DKK1的慢病毒载体,用适当浓度病毒液感染PC12细胞,嘌呤霉素连筛2周后荧光显微镜下均见绿色荧光,说明GV358-DKK1成功感染PC12细胞。随后证实DKK1 mRNA及蛋白相对表达量均提高,进一步说明本实验成功获得DKK1基因高表达PC12细胞株。为后续探讨DKK1基因的功能、特性及在神经精神疾病中的作用提供理想的细胞模型。
[1] De Robertis EM, Kuroda H. Dorsal-ventral patterning and neural induction in Xenopus embryos[J]. Annu Rev Cell Dev Biol, 2004,20:285-308.
[2] Choi HJ, Park H, Lee HW, et al. The Wnt pathway and the roles for its antagonists, DKKS, in angiogenesis[J]. IUBMB Life, 2012,64(9):724-731.
[3] Seib DR, Corsini NS, Ellwanger K, et al. Loss of Dickkopf-1 restores neurogenesis in old age and counteracts cognitive decline[J]. Cell Stem Cell, 2013,12(2):204-214.
[4] Gould TD, Dow ER, O′Donnell KC, et al. Targeting signal transduction pathways in the treatment of mood disorders: recent insights into the relevance of the Wnt pathway[J]. CNS Neurol Disord Drug Targets, 2007,6(3):193-204.
[5] Vallee A, Lecarpentier Y. Alzheimer disease: crosstalk between the canonical Wnt/Beta-Catenin pathway and PPARs alpha and gamma[J]. Front Neurosci, 2016,10:459.
[6] Wan W, Xia S, Kalionis B, et al. The role of Wnt signaling in the development of Alzheimer′s disease: a potential therapeutic target[J]. Biomed Res Int, 2014,2014:301575.
[7] Wang X, Luo E, Bi R, et al. Wnt/beta-catenin signaling is required for distraction osteogenesis in rats[J]. Connect Tissue Res, 2017,1:1-10.
[8] Mazon M, Masi D, Carreau M. Modulating dickkopf-1: a strategy to monitor or treat cancer[J]. Cancers(Basel), 2016,8(7):62.
[9] Mao QQ, Zhong XM, Li ZY, et al. Paeoniflorin protects against NMDA-induced neurotoxicity in PC12 cells via Ca2+antagonism[J]. Phytother Res, 2011,25(5):681-685.
[10] Glinka A, Wu W, Delius H, et al. Dickkopf-1 is a member of a new family of secreted proteins and functions in head induction[J]. Nature, 1998,391(6665):357-362.
[11] Krupnik VE, Sharp JD, Jiang C, et al. Functional and structural diversity of the human Dickkopf gene family[J]. Gene, 1999,238(2):301-313.
[12] Fedi P, Bafico A, Nieto Soria A, et al. Isolation and biochemical characterization of the human Dkk-1 homologue, a novel inhibitor of mammalian Wnt signaling[J]. J Biol Chem, 1999,274(27):19465-19472.
[13] Menezes ME, Devine DJ, Shevde LA, et al. Dickkopf1: a tumor suppressor or metastasis promoter[J]. Int J Cancer, 2012,130(7):1477-1483.
[14] Cerpa W, Gambrill A, Inestrosa NC, et al. Regulation of NMDA-receptor synaptic transmission by Wnt signaling[J]. J Neurosci, 2011,31(26):9466-9471.
[15] Pan YY, Deng Y, Xie S, et al. Altered Wnt signaling pathway in cognitive impairment caused by chronic intermittent hypoxia: focus on glycogen synthase Kinase-3beta and beta-catenin[J]. Chin Med J(Engl), 2016,129(7):838-845.
[16] Kawano Y, Kypta R. Secreted antagonists of the Wnt signalling pathway[J]. J Cell Sci, 2003,116(Pt 13):2627-2634.
[17] Wang J, Shou J, Chen X. Dickkopf-1, an inhibitor of the Wnt signaling pathway, is induced by p53[J]. Oncogene, 2000,19(14):1843-1848.
[18] Zhang CY, Chen R, Wang F, et al. EGb-761 attenuates the anti-proliferative activity of fluoride via DDK1 in PC-12 cells[J]. Neurochem Res, 2017,42(2):606-614.
[19] Caraci F, Busceti C, Biagioni F, et al. The Wnt antagonist, Dickkopf-1, as a target for the treatment of neurodegenerative disorders[J]. Neurochem Res, 2008,33(12):2401-2406.
