能量代谢与阿尔茨海默病研究进展*
2018-03-19高丽娟魏江平秦莉霞文跃强徐世军
文 雯,高丽娟,魏江平,秦莉霞,文跃强,徐世军**
(1.成都中医药大学药学院 成都 611137;2.成都中医药大学中医脑病药物整合转化研究所 成都611137;3.成都中医药大学基础医学院 成都 611137)
阿尔茨海默症(Alzheimer's Disease,AD)是一种老年期常见的神经退行性疾病,随着AD的发病率和患病率逐年上升,每年在治疗上的花费也与日俱增,我国患病情况同样不可忽视,形势十分严峻[1]。因为其发病机制尚不明确,低早期诊断率、高发病率与药物缺乏成为本病防治的主要矛盾问题,寻找潜在发病机制和有效治疗靶点成为目前最迫切的任务。现有研究发现AD及其风险性疾病过程中能量代谢存在异常,与本课题组前期提出的:老年痴呆是一个“渐进的、三维的、由脑能量代谢障碍启动的、由功能性改变缓慢演变为器质性改变的、存在物质流、能量流和信息流障碍并相互影响的慢性神经退行性疾病”假说相符合[2]。但在AD高风险疾病和AD进程中能量代谢变化规律尚不明确,现以此为研究目标进行综述。
1 能量代谢异常是阿尔茨海默症高风险基础疾病的主要特征
基于人群分析,AD的高风险基础疾病有三大类别:①心血管疾病,如动脉粥样硬化、脑缺血、缺血性心脏病等;②代谢性疾病,如2型糖尿病、血脂代谢异常等;③炎性疾病,如自身免疫性疾病与骨关节炎等[3]。炎症性疾病是病理基础[4]。以下简述此三类风险性疾病中的能量代谢过程。
1.1 心血管疾病与能量代谢
1.1.1 动脉粥样硬化
动脉粥样硬化中巨噬细胞局部糖摄取量增加,大多通过Warburg效应代谢为乳酸,在动脉粥样硬化大鼠主动脉组织细胞中能量负荷明显降低[5],同时线粒体功能障碍也是产能减少的一个重要因素,糖酵解产生的过多ROS损伤线粒体功能,线粒体氧化应激增强,线粒体合成酶活性不足[6]。随着动脉壁的逐渐变硬变厚,整个动脉失去弹性,会突然以局部脑缺血、心绞痛、心肌梗塞、中风或心力衰竭等致命病爆发,是其他心血管疾病的诱因
1.1.2 脑缺血
线粒体功能障碍是脑缺血最重要的机制之一。脑缺血首先出现的是Na+-K+-ATP酶活性和能荷EC比值下降,线粒体形态异常,数量减少,NAD+/NADH比率降低,UCP2-PGC-1α,PI3K-AKT信号通路减弱,对葡萄糖代谢的需求大大减少,供能减少[7-9]。腔隙性脑梗占缺血性卒中比例较高,病理情况随着梗死点增多而升高。脑血管腔栓塞导致脑组织缺氧,AMP/ATP下降,脑细胞受损[10]。
1.1.3 心肌缺血
在正常情况下成人心肌细胞能量来源70%为脂肪酸,心肌缺血后,心脏供氧不足,耗氧较多的脂肪酸代谢受到抑制,出现ATP含量减少和脂肪酸代谢紊乱[11]。清除代谢产物耗能导致心肌正常供能的能量更加不足。线粒体功能障碍是疾病发展的关键因素,心肌缺血所致心衰动物模型中,PGC-1α和PPAR信号被抑制,线粒体的增殖减少[12],线粒体电子传递链解偶联和NADPH氧化酶导致的ROS增多致线粒体功能障碍。
1.2 代谢性疾病与能量代谢
1.2.1 肥胖和高脂血症
肥胖常导致细胞功能障碍和脂毒性,进而导致代谢性疾病发生。研究表明肥胖小鼠肝糖元酵解和三羧酸循环减弱,PPARα表达不足[13],与脂肪酸氧化相关的基因下调,代谢减少;体内脂肪合成关键基因SREBP1c、ACC等异常高表达,胰脂肪酶活性增高,合成增加。高脂血症患者血浆中甘油三酸酯含量相比健康人更高,而血清素分泌下降,AMPK-SIRT1-PGC1α脂质代谢信号通路和AMPK信号通路被抑制[14],代谢过程中能量消耗和产热反而不足,出现局部能量不足的情况。下丘脑中POMC基因表达降低是其可能的机制[15]。
1.2.2 2 型糖尿病
胰岛素抵抗与胰岛β细胞病变是2型糖尿病的主要特征,常伴有肥胖、血脂代谢异常和ATP减少[16]。2型糖尿病患者胰岛供能不足导致胰岛β细胞分泌功能受损,脂联素-AMPK-GLUT和AMPK/PGC-1α/GLUT4通路受阻,阻止葡萄糖的摄取和氧化供能,餐后血糖ATP转化率仅达到正常1/6水平。AMPK信号通路与胰岛素信号通路相互制约,激活AMPK信号通路可作为保护胰岛β细胞的靶标。
2型糖尿病患者机体脂肪酸利用率从70%上升至90%以上[17]。虽然每分子脂肪酸氧化会比葡萄糖供能更多,但由于2型糖尿病患者线粒体结构功能改变、解偶联蛋白下降等原因,ATP产生水平减少约30%,并且脂肪生成和糖异生等能量需求增加导致ATP含量紊乱[18];在脂肪酸氧化过程中会产生过量的ROS,间接导致细胞内Ca2+蓄积,进一步加剧线粒体功能障碍,降低代谢率[19],有研究表明线粒体可作为二甲双胍的作用靶标。骨代谢和SIRT1基因表达在2型糖尿病发病过程中的代谢也起着重要的调节作用[20]。
1.3 慢性炎症疾病与能量代谢
1.3.1 骨关节炎
骨关节炎(OA)等外部炎症会诱导脑中的胶质细胞激活,导致神经炎症并且加速AD病程的恶化[21]。正常情况下,葡萄糖转运到关节软骨后主要采用Warburg效应方式供能,在营养应激期间以三羧酸循环支持细胞外基质生物合成,具有代谢灵活性[22]。在OA的病理情况下,软骨细胞ATP产生减少,消耗增多,局部乳酸堆积,细胞代谢灵活性减弱,糖酵解也是关节炎潜在的治疗靶点。OA患者软骨线粒体损伤增加,膜电位电子传递链活性下降。
1.3.2 类风湿性关节炎
类风湿性关节炎(RA)临床表现为关节局部存在低氧和低血糖症状。低氧导致氧化磷酸化途径产能障碍,呼吸链ATP 5O/6V1B2基因表达降低[23];局部低血糖导致糖酵解产生ATP的效率低下;总体表现为关节局部产能不足[24]。RA患者由于炎症反应,炎症因子如TNF-α,IL-1等分泌导致机体发热,促神经肽释放增多,并可刺激其它促炎细胞因子的分泌;RA患者体内瘦素分泌增多可诱导NK细胞,单核巨噬细胞和T/B细胞增殖活化参与免疫,表现出静息状态下代谢水平增高的现象[25,26]。
1.3.3 过敏性哮喘
临床发现治疗过敏性哮喘的药物也能在不影响Aβ产生的情况下,有效抑制Aβ单体在体外聚集成更高级的寡聚体和原纤维[27]。过敏性哮喘者气道上皮中精氨酸合成酶ARG2和线粒体呼吸复合物III和IV的表达升高。ARG2在人支气管上皮细胞系中的过表达加速了氧化生物能量通路[28]。
以上三类AD高风险疾病发生在AD之前,均存在能量产生下降,线粒体障碍的主要共同点。
2 脑能量代谢异常贯穿阿尔茨海默症发生发展的全过程
脑组织能量消耗相对较大,极易受到能量代谢紊乱的影响,AD患者常伴随脑能量不足。神经元能量危象会导致脑中淀粉样蛋白β(Aβ)的清除受损和tau蛋白过度磷酸化最终导致Aβ斑块沉积和神经元纤维缠结的形成,是导致AD病程启动与恶化演进的核心因素之一[29]。在AD不同阶段能量代谢大都呈减少状态,研究发现线粒体功能障碍发作先于Aβ斑块的形成,涉及能量供应的主要通路AMPK、胰岛素信号通路,Ca2+信号[30]。阿尔茨海默症分为AD前期和AD阶段。AD患者静息能量消耗,进食后产能和总能量消耗水平均呈下降趋势[31]。MRI影像显示阿尔茨海默症患者出现广泛的双侧萎缩,影像学和认知测试发现轻度AD患者血浆中葡萄糖和乙酰乙酸浓度和流入速率降低[32],AD患者脑组织尸检发现突触中苹果酸脱氢酶和肌酸激酶表达下降,显示糖代谢功能低下[33]。3月龄APP转基因小鼠显示线粒体膜电位和ATP水平降低[34]。
2.1 AD前期
AD前期分为主观认知下降阶段(SCD)和轻度认知障碍阶段(MCI)。主观认知下降阶段患者的脑脊液氟脱氧葡萄糖-正电子发射断层扫描发现葡萄糖代谢呈现偏高的趋势[35],MCI早期能量代谢开始下降,表现为丙酮酸脱氢酶复合物(PDHC),α-酮戊二酸脱氢酶复合物(KGDHC),异柠檬酸脱氢酶(NAD+)降低,琥珀酸脱氢酶(SD)和苹果酸脱氢酶(MDH)的活性升高[36],所以产能与正常水平相比变化并不显著。随着Aβ沉积的程度增高,Aβ会成为AD患者能量代谢减少的驱动力,葡萄糖代谢呈现下降趋势。MCI后期患者大脑后扣带回、顶叶、颞叶和前额叶皮质双侧脑葡萄糖代谢率低,ATP利用率降低。后皮质和海马区域与AD的发病密切相关,这两个区域能量生成和代谢水平均下降,呈现能量流通缓慢的情况[37-39]。可能的机理是线粒体损伤,表现为COX活性和线粒体膜电位降低等,上述脑区约70%线粒体电子传递链基因的表达显著降低,大部分脑区线粒体转位酶的基因表达降低,呼吸链和复合物Ⅳ的活性大幅下降,健康神经元凋亡明显,加剧AD进程。
2.2 AD期
以线粒体为中心的代谢减退是大脑衰老和AD的一个关键特征。在AD早期四个脑区中的葡萄糖转运体表达降低,摄取速率下降约11%,代谢率降低。PI3K-AKT途径、GAPDH水平与AD脑中的葡萄糖利用率降低相关[40]。
葡萄糖代谢通过糖酵解和三羧酸循环,线粒体是重要的细胞器。AD患者体内的线粒体数量减少、功能受损且氧化磷酸化(OXPHOS)基因下调,神经元处于低代谢状态。Aβ水平与线粒体OXPHOS基因表达呈负相关,包括但不限于复合物Ⅰ和Ⅳ,KGDHC的活性下降可能是脑能量降低的重要原因[41,42]。线粒体H2O2产生的增加伴随着胰岛素抵抗,胰岛素信号通路中PI3K和Akt阳性细胞数量在海马区明显减少,JNK磷酸化增加,Prx3表达降低,促进Aβ沉积,进一步研究发现伴随着胰岛素信号改变和胰岛素抵抗,脑中胶质细胞代谢表型也发生改变[43]。正常情况下包裹着Aβ的小胶质细胞可以清除病理产物Aβ,但在出现Aβ沉积的大脑中,本应通过葡萄糖供能的小胶质细胞能量供应不足,活力减弱,无法正常行使清除功能[44]。脑长期处于能量低能状态可诱导神经元凋亡和ROS生成,导致神经信号传递障碍等[45]。
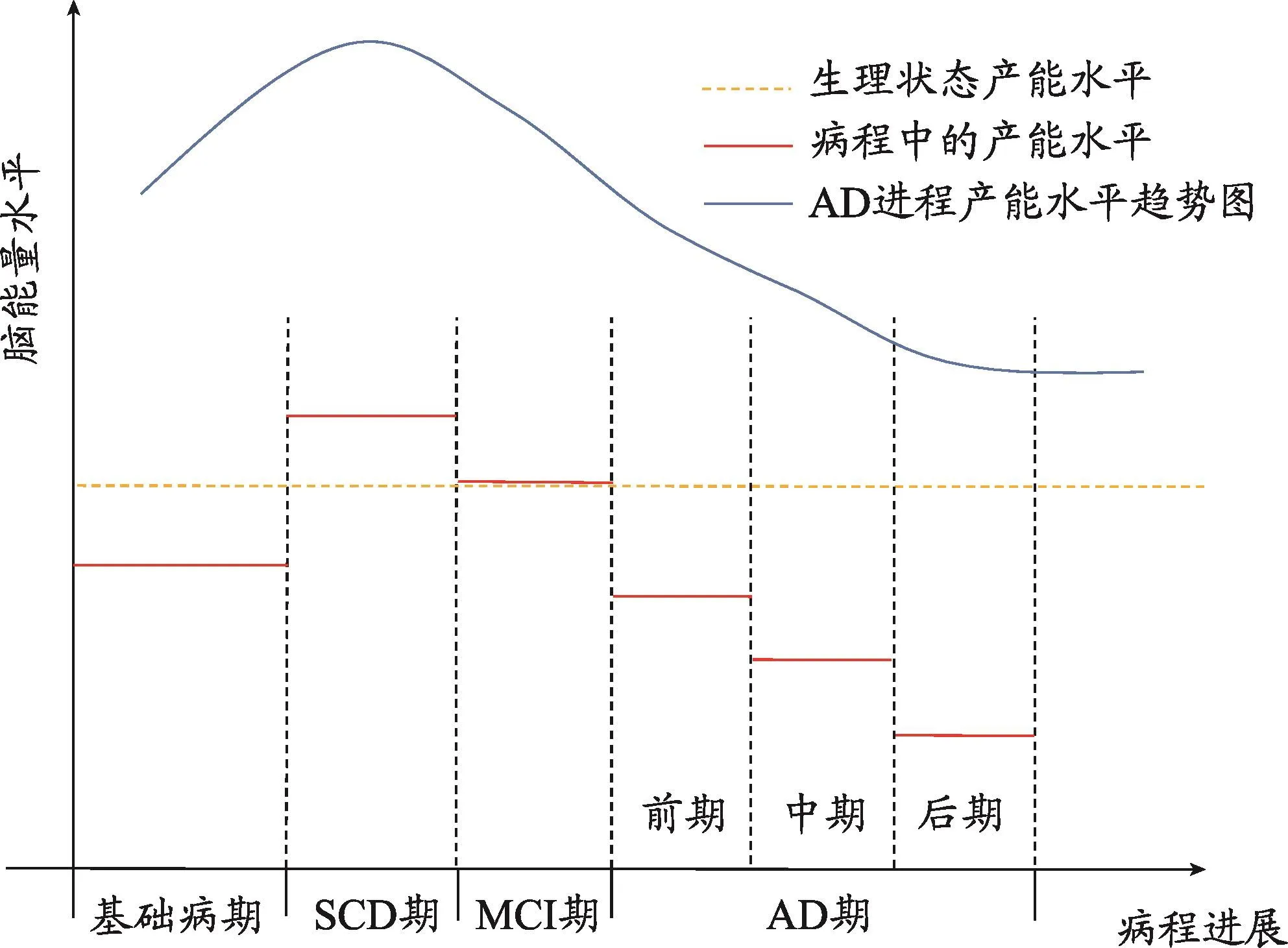
图1 AD进程中的脑能量水平变化规律
综上,AD的高风险疾病和AD的各个阶段都存在能量代谢的紊乱,并随着疾病的发展呈现趋势一致性。能量代谢障碍可能是AD的早期发病和疾病进展的共性环节,研究表明能量代谢障碍会促进氧化应激和AD病理产物累积。我们认为在AD危险性疾病中,病变局部或外周的葡萄糖摄取与产能低下到一定的程度时会导致中枢神经系统产能紊乱并导致AD的发生,在脑部环境被干扰后出现一段应激性产能增加,随后降低,并在AD的全过程逐渐降低。因此,干预机体能量代谢障碍可能防止AD高危疾病向AD发展或AD防治的一个良好的潜在靶标。
