木瓜酒发酵过程中多酚类物质的高效液相色谱测定及含量变化分析
2018-03-16谭悦王晓静陈光静徐瑶阚建全
谭悦,王晓静,陈光静,徐瑶,阚建全,2,3*
1(西南大学 食品科学学院,重庆,400715) 2(重庆市农产品加工及贮藏重点实验室,重庆 ,400715) 3(农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆, 400715)
木瓜(Chaenomelessinensis(Thouin) Koehne),又称海棠梨、铁脚梨,品种多样[1],药食两用,营养丰富,有重要的药用价值,俗称“百益之果”,富含多酚类物质、维生素、矿物质、氨基酸、蛋白质和类胡萝卜素等营养元素[2-3]。相关研究证实,木瓜具有抗氧化、抗衰老、抗肿瘤、降血压和降血脂等功效,这些功效与其含有的抗氧化活性物质紧密相关[4]。木瓜中的多酚类物质是天然的抗氧化剂,包括类黄酮和非类黄酮类,非类黄酮主要是酚酸类化合物,有抑制脂质过氧化,清除自由基等功效[5-6]。木瓜除果肉外,木瓜籽、木瓜叶、木瓜梗、木瓜果皮均含大量酚类物质[7],是提取天然抗氧化剂的良好资源,具有重要应用价值。
近年来,以木瓜为原料生产的食品种类增多,其中木瓜酒以木瓜为原料发酵而成,保留了木瓜丰富的营养成分,其中含有的大量酚类物质具有重要的生物活性,有重要保健作用。同时,酚类物质也会影响木瓜酒的品质,改变其口感、风味、色泽等。研究表明,多酚类物质是导致果酒出现褐变的原因之一,其与蛋白质结合形成的缔合物还会导致果酒出现沉淀,且此类聚合物有较强的吸附能力,会吸附酒中其他物质,从而加重果酒的浑浊现象[8]。因此,研究果酒中酚类物质的种类及其含量变化情况,有助于解释果酒褐变机理[9]和浑浊现象[8],对改善果酒品质具有重要意义。
目前木瓜的研究主要集中在木瓜多酚物质提取、纯化、总多酚含量的测定及其抗氧化性等[5,10-11]。木瓜酒的研究主要为发酵条件[3-12]、酿酒酵母的筛选与应用[13-14]、发酵酒中主要成分如有机酸、含糖量、齐墩果酸和可溶性固形物等的含量分析[3-15]以及木瓜酒的药理学功效[16],而对于木瓜酒中单体酚物质的含量及其发酵过程中变化情况的研究还鲜有报道。本实验拟以光皮木瓜、皱皮木瓜和野木瓜为原料发酵木瓜酒,首先优化高效液相色谱法同时测定木瓜酒中没食子酸、儿茶素、原儿茶酸、表儿茶素、绿原酸、香豆酸、咖啡酸、槲皮苷、芦丁、槲皮苷、山奈素的测定条件;在此基础上分析3个品种的木瓜酒发酵过程中总酚和上述10种单体酚的含量变化情况,以了解木瓜酒发酵过程中多酚类物质的变化情况,以期为木瓜酒的酿酒原料品种的选择及营养评价提供基础实验数据。
1 材料与方法
1.1 材料与试剂
野木瓜(样品1)、皱皮木瓜(样品2)和光皮木瓜(样品3):重庆綦江,采后立刻运回实验室洗净,去皮去籽,切块打浆,-4 ℃冰箱保存。
芦丁:美国SIGMA公司;咖啡酸、绿原酸:瑞士FLUKA公司;P-香豆酸、没食子酸、儿茶素、表儿茶素、原儿茶酸:中国药品生物制品检定所;槲皮苷、山奈素:成都曼思特公司;果胶酶:食品添加剂级,活力(70 000 U/g),诺维信(中国)生物技术有限公司;酵母膏:生物试剂,天津市大茂化学试剂厂。
1.2 仪器与设备
LC-20A 高效液相色谱仪(配SPD-M20A DAD检测器),日本岛津公司;KQ3200DB型数控超声波清洗器,昆山市超声仪器有限公司;RE52-98旋转蒸发仪、SHZ-Ⅲ型循环水真空泵,上海亚荣生化仪器厂;榨汁机,上海康赛电器有限公司。
1.3 方法
1.3.1 木瓜酒制作工艺流程

1.3.2 木瓜酒测试样品溶液的制备
吸取10 mL木瓜酒,用1 mol/L NaOH调节至pH 7左右,再用20 mL丙酮萃取试液。重复萃取3次并收集上清液(此为中性酚)。上述萃取酒样再用2 mol/L HCl调节为pH 2左右。重复上述萃取操作(此为酸性酚)。合并中性酚和酸性酚,在旋转蒸发仪中40 ℃温度下蒸发至近干,用 4 mL甲醇复溶,过0.45 μm有机滤膜,待测[17]。
1.3.3 木瓜酒样品总酚含量的测定
木瓜酒样品总酚含量采用福林酚比色法测定[18],多酚类化合物在碱性溶液中可将磷钨酸钠还原并生成蓝色化合物,根据颜色的变化进行比色测定。
精密称取0.005 0 g没食子酸标准品,用蒸馏水溶解并定容至50 mL,得0.1 mg/mL没食子酸标准溶液。分别吸取该标准溶液0.1、0.2、0.3、0.4和0.5 mL于10 mL容量瓶中,再加入2 mL福林酚试剂,摇匀后,在30 s内加入4 mL 120 g/L的Na2CO3溶液摇匀,用水定容至10 mL。25 ℃下避光反应2 h,同时做试剂空白,于760 nm波长下测定吸光度值。以没食子酸浓度为横坐标(x,mg/mL),吸光度值为纵坐标(y)绘制标准曲线,所得回归方程为:y=15.33x-0.011 5(R2=0.999 4)。
精密吸取0.1 mL待测提取液于10 mL容量瓶中,按照上述测定标准曲线的方法测定木瓜酒样品吸光度值,然后根据标准曲线计算出样品总酚浓度。
1.3.4 混合标准品溶液的配制
准确称取各单体酚标准品2.5 mg,甲醇定容至10 mL,得250 mg/L各标准品储备液。取各标准品溶液1.00 mL混合,甲醇定容至25 mL,为混合标准储备液。0~4 ℃下避光保存。
1.3.5 色谱条件的考察
分别考察不同流动相的类型(水-甲醇、水-乙腈、0.05%磷酸水溶液-甲醇、0.05%磷酸水溶液-乙腈)、梯度洗脱程序及流速(0.6、0.8、1.0、1.2 mL/min)对10种多酚类物质的分离效果,以确定最优的HPLC分离条件。
1.3.6 色谱条件
色谱柱Shim-pack VP-ODS(150 mm×4.6 mm,5 μm);流动相A: 0.05%磷酸水溶液,流动相B:甲醇;采用表1中的梯度洗脱程序;流动相流速0.8 mL/min;进样量10 μL;紫外检测波长280 nm;柱温35 ℃。

表1 分离10种多酚物质的流动相梯度洗脱程序 Table 1 Elution gradient of mobile phase for the separation of 10 polyphenols
1.3.7 数据统计分析
实验取3次重复试验平均值,数据以(平均值±标准差)形式表示。使用SPSS 19.0进行显著性分析(p<0.05);并使用Origin 9.0和EXCEL进行图、表的绘制。
2 结果与分析
2.1 多酚类物质测定的色谱条件考察
实验首先比较多酚物质HPLC测定常用的水-甲醇和水-乙腈流动相对10种多酚物质的分离效果,在逐渐增加有机相比例的条件下,发现2种流动相中均有多酚类物质未被完全分离开。考虑酸性酚中的氢离子及多酚酚羟基易电离,增加溶液酸度抑制电离程度[19],并采用梯度洗脱程序可提高各个物质分离度,因此在水相中添加0.05%磷酸。梯度洗脱程序下(表1),0.05%磷酸水溶液-乙腈体系中基线不平(图1-B),0.05%磷酸水溶液-甲醇流动相分离效果更佳(图1-A),但绿原酸和表儿茶素,芦丁和槲皮苷未分开。
在一定范围内,流速会影响色谱柱柱效。流速减小,分离度变大,柱效增高,过慢时,受纵向扩散的影响,柱效降低。提高流速可以缩短分析时间,但柱压变高,待分离物质未被分离就洗脱出来,分离效果不好。实验设计了4个流动相流速,分别为0.6、0.8、1.0、1.2 mL/min。流速为0.6、0.8 mL/min 时,各物质分离度较好(图1-C,图1-D),峰型对称,无拖尾现象。为缩短分析时间,选0.8 mL/min(图1-D)作为最佳流动相流速。

A-0.05%磷酸-甲醇梯度洗脱,流速1 mL/min;B-0.05%磷酸-乙腈梯度洗脱,流速1 mL/min; C-0.05%磷酸-甲醇梯度洗脱,流速0.6 mL/min; D-0.05%磷酸-甲醇梯度洗脱,流速0.8 mL/min1-没食子酸;2-原儿茶酸;3-儿茶素;4-绿原酸;5-表儿茶素;6-咖啡酸;7-香豆酸;8-芦丁;9-槲皮苷;10-山奈素图1 不同条件下10种多酚组分标准品HPLC色谱图Fig.1 The HPLC Chromatogram of 10 standards under different conditions
图2中A和B分别为10种单体酚物质标准品液相色谱图和木瓜酒样品1色谱图。由图2可以看出,优化的色谱条件下, 10种酚类物质可被有效分离,分离度高,无干扰。根据单标定性所得的保留时间,可确定各峰对应的多酚类物质。
2.2 多酚类物质测定的方法学考察
2.2.1 标准曲线与检出限
用甲醇将混合标准多酚溶液稀释后进行测定,质量浓度分别为0.1、0.5、1、5、8、10 mg/L,以确定各种多酚的保留时间;以各组分的质量浓度(X, mg/L),峰面积(Y)绘制标准曲线。结果见表2,各酚类物质在0.1~10 mg/L的质量浓度范围内相关系数R2大于0.993 6,线性关系良好,检出限在0.01~0.02 mg/L之间,方法灵敏,可满足木瓜酒中10中多酚类物质的测定要求。

A-10种多酚组分标准品HPLC色谱图; B-木瓜酒样品HPLC色谱图图2 10种多酚物质标准品及木瓜酒样品HPLC色谱图Fig.2 The HPLC Chromatogram of 10 standards and papaya wine

多酚组分保留时间/min线性方程R2线性范围/(mg·L-1)检出限/(mg·L-1)没食子酸8.2Y=2.247x+9.6620.99980.1~100.02原儿茶酸10.818Y=4.418x+9.4320.99980.1~100.01儿茶素11.816Y=1.008x+1.8150.99990.1~100.01绿原酸12.513Y=4.097x+0.7570.99360.1~100.01表儿茶素13.277Y=9.246x+7.0260.99990.1~100.02咖啡酸13.645Y=1.787x+0.1190.99970.1~100.01P⁃香豆酸15.252Y=1.194x+0.1060.99970.1~100.01芦丁16.272Y=9.660x+6.9280.99970.1~100.02槲皮苷17.433Y=6.227x-0.1150.99980.1~100.01山奈素29.385Y=4.403x+0.2930.99970.1~100.01
2.2.2 加标回收率试验
取已知多酚含量的酒样,分别添加一定量的标准溶液,处理后稀释10倍,按1.3.5的色谱条件测定各多酚物质的加标回收率。由表3可知,各类多酚物质的加标回收率在96.0%~104.85%之间,回收率的RSD值在1.87%~3.41%之间,说明此方法回收率高。

表3 木瓜酒中添加10种多酚物质的回收率测定结果(n=6)Table 3 Recoveries of 10 polyphenols spiked in papaya wine(n=6)
2.2.3 精密度试验
取10 mg/L的混合标准溶液,前处理后按照1.3.5优化后的色谱条件连续测定6次,10种酚类物质的重复测定结果的RSD值在1.28%~2.99%之间,均小于3%,表明该方法精密度的符合测定的要求。
2.2.4 稳定性试验
取同一样品溶液,前处理后分别在0、2、4、8、12和24 h时按照1.3.5优化后的色谱条件测定。10种多酚物质各次测定值的RSD值在1.92%~3.74%之间,表明样品提取液在24 h内稳定性良好。
2.3 木瓜酒样品中多酚物质含量及变化情况分析
2.3.1 木瓜酒发酵过程中总酚含量及变化情况分析
木瓜酒的发酵过程分为两个阶段[20]:前7天为主发酵时期,此阶段酵母和其他固体物质沉降,原酒澄清而透明,之后发酵进入缓慢的后发酵期。发酵期间,多酚类物质发生复杂的化学变化,影响酒类的风味及品质。
由图3可知,3种木瓜酒样品总酚含量在发酵期间均显示出先增加而后缓慢下降的趋势,含量变化显著(p<0.05)。王胜利[21]、黄佳[22]对猕猴桃酒发酵过程中多酚含量变化情况也表明,发酵期间,多酚含量的变化先缓慢上升后下降,最后趋于平稳,与本研究结果相似。出现此现象的原因主要可能是木瓜酒在发酵前期,由于酒精发酵,逐渐产生的酒精和二氧化碳,有利于发酵液中的多酚类物质被浸提出来,导致其含量的增加。随着发酵过程的进行,多酚类物质发生氧化、水解反应,形成黑色素或褐色素等物质,使得含量下降[17-22]。
3种木瓜酒中总酚含量达到峰值的时间分别在第15、30和11天,发酵4个月后各样品总酚含量显著增加(p<0.05),较发酵前分别增加了47.3%、56%、54.7%。其中,样品2的酒样中总酚含量最高,达到117 8 mg/100 mL。总酚含量出现差异的原因可能与木瓜的品种、生长环境等条件不同有关。张淑娟等[7]测得光皮木瓜汁中总酚含量为554 mg/100 mL。袁竹连[23]提取番木瓜不同部位的多酚物质时发现番木瓜果肉中多酚含量为6.87 mg/g,果皮中多酚含量为15.42 mg/g。从以上研究可知,影响木瓜多酚物质含量的因素众多。

图3 3种木瓜酒总多酚在发酵过程中的含量变化Fig.3 Total polyphenol content of three papaya wine in fermentation process注:图中柱状图上所标小写字母表示同一样品不同发酵时间多酚含量的显著性差异,相同字母表示差异不显著(p>0.05),不同字母表示差异显著(p<0.05),图4同。
2.3.2 木瓜酒发酵过程中各单体酚类物质含量及变化情况分析
木瓜酒各单体酚类物质发酵期间的含量测定结果见图4。由图4可知,各类单体酚物质在主发酵期间含量均逐渐增加;后发酵过程中,随着发酵时间的延长,含量逐渐降低,变化趋势与总酚含量相对应。3种木瓜酒在发酵4个月后,其没食子酸、绿原酸、表儿茶素、芦丁、槲皮苷和山奈素含量均显著增加(p<0.05);原儿茶酸含量在样品1和样品3中增量明显(p<0.05),在样品3中变化不显著(p>0.05);儿茶素在样品3中增量显著(p<0.05),在样品1和样品2中无显著变化(p>0.05);咖啡酸含量在3种木瓜酒中均无显著变化(p>0.05)。木瓜酒在发酵的过程中,酚类物质会发生一系列复杂的化学反应,如氧化、聚合等,影响木瓜酒的风味和品质。研究表明,咖啡酸可与酒石酸结合生成酒石咖啡酸;香豆酸与酒石酸结合生成酒石香豆酸,因而含量发生变化。某些化合物水解也会释放游离的酚酸类物质,如五倍子单宁水解释放出没食子酸,导致没食子酸含量的上升[24]。多酚类物质的氧化聚合反应是一个动态平衡的过程,两种反应同时存在。当水解反应占优势时,酚类物质的含量会增加,当聚合反应占优势时,酚类物质的含量相应减少[17]。
发酵4个月后,3种木瓜酒中,10种酚类物质均有检出,但含量有所差异。木瓜酒样品1所含的原儿茶酸、儿茶素、绿原酸、表儿茶素、槲皮苷和芦丁高于样品2和样品3,分别为25.2、73.5、27.5、10.3、1.75、8.9 mg/L;样品2中没食子酸含量高于样品1和样品3,为10.2 mg/L;样品3中咖啡酸、香豆酸和山奈素含量高于样品1和样品2,分别为4.1、1.6、0.5 mg/L。3种木瓜酒中主要含有的4类酚类物质相同,均为儿茶素、原儿茶酸、表儿茶素和绿原酸,具体含量见表4。原儿茶酸和儿茶素的含量在3个样品中含量差异显著(p<0.05),而绿原酸含量在样品1和样品3中差异不显著(p>0.05),表儿茶素含量在样品1和样品2中差异不显著(p>0.05)。儿茶素在3种木瓜酒中含量最高且差异显著(p<0.05),可以用来区分3种木瓜品种。
3 讨论


A-没食子酸;B-原儿茶酸;C-儿茶素;D-绿原酸;E-表儿茶素;F-咖啡酸;G-香豆酸;H-芦丁;I-槲皮苷;J-山奈素图4 3种木瓜10种酚类物质在发酵过程中的含量变化Fig.4 10 polyphenols contents of three papaya wine in fermentation process
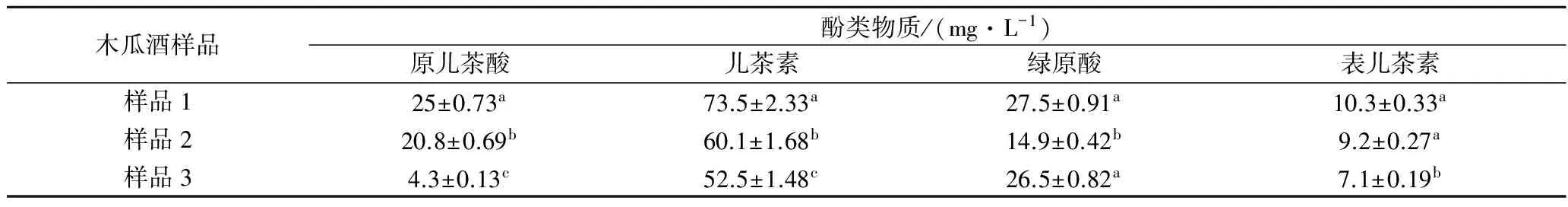
木瓜酒样品酚类物质/(mg·L-1)原儿茶酸儿茶素绿原酸表儿茶素样品125±0.73a73.5±2.33a27.5±0.91a10.3±0.33a样品220.8±0.69b60.1±1.68b14.9±0.42b9.2±0.27a样品34.3±0.13c52.5±1.48c26.5±0.82a7.1±0.19b
注:同列肩标小写字母相同表示差异不显著,不同表示差异显著(p<0.05)。
木瓜酒营养丰富,具有良好的保健作用,尤其是其中含有的大量酚类物质,具有重要生物活性。总酚含量与ABTS、DPPH 自由基清除能力和卵黄脂蛋白脂质过氧化抑制能力有关[7]。本实验比较了3种品种木瓜酒中多酚含量的差异,发现以皱皮木瓜酒(样品2)中总酚含量最高,达1 178 mg/100 mL,与光皮木瓜酒和野木瓜酒中总酚含量比较差异显著(p<0.05)。从总酚含量来评价,皱皮木瓜是3种木瓜品种中发酵木瓜酒的最佳原料。杨建荣等[25]测定发酵4个月后的苹果酒中总酚含量在260~300 mg/L;耿彦彦等[26]对干红葡萄酒中的多酚含量进行测定时发现,传统酿造工艺发酵的葡萄酒总酚含量为2 216.67 mg/L,闪蒸处理后发酵的葡萄酒总酚含量达3 713.33 mg/L;梁晨等[27]测定不同品种蓝莓酒中总酚含量在482~930 mg/L;游义琳等[28]测定6种不同品种桑葚酒的总酚含量范围为2 261~3 574 mg/L没食子酸当量。比较各类果酒中总酚含量可知,本实验发酵的木瓜酒中含有的总酚含量显著高于其他类果酒,说明木瓜酒多酚含量高,具有重要的开发价值。
4 结论
实验优化了同时测定木瓜酒中10种多酚物质的HPLC检测条件,优化结果为:色谱柱Shim-pack VP-ODS(150 mm×4.6 mm,5 μm);流动相0.05%磷酸水溶液-甲醇;梯度洗脱程序见表1;流速0.8 mL/min;柱温35℃;进样量10 μL;紫外检测波长280 nm。在此条件下,10种多酚物质能在60 min之内得到有效分离,各酚类物质在0.1~10 mg/L的浓度范围内R2大于0.993 6,线性关系良好,检出限在0.01~0.02 mg/L之间,加标回收率在97.04%~107.32%之间,回收率高、准确可靠,适用于同时检测木瓜酒中10种酚类物质。
经HPLC测定,3种木瓜酒中,总多酚含量在发酵4个月后较发酵初始含量均显著增加(p<0.05),呈现先增加而后缓慢减少的趋势。经4个月发酵,野木瓜酒(样品1)、皱皮木瓜酒(样品2)和光皮木瓜酒(样品3)的总多酚含量分别为903、1 178、1 057 mg/100 mL。3种木瓜酒中各单体酚类物质在发酵过程中变化趋势与总酚含量基本一致,主要含有的多酚物质为儿茶素、原儿茶酸和绿原酸;其中以儿茶素含量最高且差异显著(p<0.05),可用于区分这3种木瓜品种。
[1] 吴虹,魏伟,吴成义.木瓜化学成分及药理活性的研究[J].安徽中医学院学报,2004,23(2):62-64.
[2] SCHWEIGGERT R M,STEINGASS C B,MORA E,et al.Carotenogenesis and physico-chemical characteristics during maturation of red fleshed papaya fruit (CaricapapayaL.)[J].Food Research International,2011,44(5):1 373-1 380.
[3] 向进乐,罗磊,马丽苹,等.木瓜酒和木瓜醋发酵工艺及其有机酸组成分析[J].食品科学,2016,37(23):191-195.
[4] ZUHAIR R A,AMINAH A,SAHILAH A M,et al.Antioxidant activity and physicochemical properties changes of papaya (CaricapapayaL.cv. Hongkong) during different ripening stage[J].International Food Research Journal,2013,20:1 653-1 659.
[5] 张淑娟,徐怀德,米林峰.光皮木瓜汁体外抗氧化活性研究[J].食品科学,2011,32(21):56-61.
[6] ZUNJAR V, MAMMEN D, TRIVEDI B M.Antioxidant activities and phenolics profiling of different parts ofCaricapapayaby LCMS-MS.[J].Natural Product Research,2015,29(22):2 097-2 099.
[7] MAISARAH A M,AMIRA B N,ASMAH R,et al.Antioxidant analysis of different parts ofCaricapapaya[J].International Food Research Journal,2013,20:1 043-1 048.
[8] 胡静.野木瓜发酵酒酒体澄清机制研究[D].重庆:西南大学,2012:4-5.
[9] 胡靖,谢邦祥,何斌,等.果酒发酵中褐变机理及其控制的研究进展[J].食品与发酵科技,2013,49(6):94-98.
[10] IRONDI A E,ANOKAM K K,NDIDI U S.Effect of drying methods on the phytochemicals composition and antioxidant activities ofCaricapapayaseed.[J].International Journal of Biosciences,2013,3:1-7.
[11] ANG Y K,SIA W C M,KHOO H E,et al.Antioxidant potential ofCaricapapayapeel and seed[J].Focusing on Modern Food Industry, 2012,1(1):12-17.
[12] 黄世英,欧根友.木瓜酒发酵工艺条件的初步研究[J].现代食品科技,2009,25(7):822-824.
[13] MARAGATHAM C,PANNEERSELVAM A.Isolation,identification and characterization of wine yeast from rotten papaya fruits for wine production[J].Advances in Applied Science Research,2011,115(3-4):853-872.
[14] 古其会,刘四新,李从发.番木瓜酒产香酵母的筛选与鉴定[J].食品科学,2013,34(21):193-197.
[15] AWE S.Production and microbiology of pawpaw (CaricapapayaL) wine[J].Current Research Journal of Biological Sciences,2011, 3(5):443-447.
[16] 叶锡兰,邱碧辉,夏运风,等.木瓜酒保护动静脉内瘘效果观察[J].护理学杂志,2010,25(9):12-14.
[17] 郝慧英,赵光鳌,陈蕴.用HPLC测定苹果酒贮藏过程中多酚的变化[J].食品科技,2005(5):74-76,93.
[18] 王行,张海宁,马永昆,等.蓝莓酒发酵过程中酚类物质动态变化及其抗氧化活性研究[J].现代食品科技,2015,31(1):90-95.
[19] 张甜,董学畅,吴方评,等.固相萃取-高效液相色谱法测定烟草样品中10种多酚[J].分析化学,2005,22(3):359-362.
[20] 李正涛.树莓果酒发酵工艺研究[J].安徽农业科学,2010,38(36): 20 729-20 731,20 758.
[21] 王胜利.猕猴桃酒中多酚、抗氧化性及香气成分的研究[D].杨凌:西北农林科技大学,2013:20-21.
[22] 黄佳.猕猴桃酒发酵及陈酿过程中多酚及多糖的变化规律[D].杨凌:西北农林科技大学,2016:26-32.
[23] 袁竹连.番木瓜不同部位多酚物质的提取及其抗氧化活性研究[J].广东农业科学,2012,39(16):105-108.
[24] 李岳珍.发酵前处理对桑椹紫酒多酚物质含量影响的研究[D].呼和浩特:内蒙古农业大学,2012:17-20.
[25] 杨建荣,司芝坤,赵玉平.果浆处理对苹果酒发酵过程中多酚的影响[J].农产品加工学刊,2005(12):28-30.
[26] 耿彦彦,张先舟,马晓燕,等.闪蒸工艺对干红葡萄酒中多酚含量和感官特性的影响[J].食品与发酵工业,2013,39(1):142-145.
[27] 梁晨,张倩雯,盛启明,等.不同品种蓝莓酒抗氧化能力及其多酚含量分析[J].中国酿造,2013,32(8):46-49.
[28] 游义琳,张倩雯,梁晨,等.不同品种桑椹酒抗氧化能力及其多酚含量分析[J].中国酿造,2014,33(9):53-57.
