草鱼鳞和草鱼皮胶原蛋白性质及自聚集行为对比研究
2018-03-16兰文婷金若芸刘耀文王淑瑶马东辉何利
兰文婷,金若芸,刘耀文,王淑瑶,马东辉,何利
(四川农业大学 食品学院,四川 雅安,625014)
草鱼(Ctenopharyngodonidellus)是中国产量最大的淡水鱼之一,年产量超过300万t,占淡水鱼总产量的20%,在加工过程中鱼皮鱼鳞等副产物利用率较低,造成极大的资源浪费。鱼皮、鱼鳞中含有丰富的胶原蛋白,它具有安全易得等特点,是一种较好的可再生生物资源[1]。胶原蛋白可应用于功能性材料、食品、生物医学等领域[2]。其中含量最多、应用最为广泛的是I型胶原蛋白,其3条多肽链组成的三螺旋结构有很高的抗张强度。有研究报道I型胶原蛋白分子在中性溶液中和室温下可以在体外自发聚集成原纤维,通过自聚集能提高胶原基材料的比表面积、耐酶降解性以及热稳定性[3-4]。不同原料中提取得到的胶原蛋白在结构和性质上存在差异[5],可能在自聚集过程中形成不同的微观结构,从而影响在生物材料中的应用。因此本文以草鱼鳞与草鱼皮为原料,经酸-酶结合法提取胶原蛋白,在对胶原蛋白结构性质表征的基础上,开展自聚集行为的比较研究,力图揭示草鱼鳞与草鱼皮胶原蛋白自聚集行为的差异性,为不同来源I型胶原蛋白在生物材料领域的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
10月于四川省雅安市苍平山农贸市场购买重1.5 kg左右的鲜活草鱼,取鱼鳞与鱼皮进行脱脂(鱼鳞还需进行脱钙),去除杂蛋白、色素处理,洗净沥干,备用[6-7]。
胃蛋白酶(BR 10 000 U/g),购于上海瑞永公司;十二烷基硫酸钠、四甲基乙二胺、过硫酸铵、考马斯亮蓝R-250,购于Bio Basic公司;3H2O·N-对甲苯磺酰胺钠盐(氯胺T)、高氯酸、对二甲氨基苯甲醛及其他常见试剂等均为国产分析纯,购于成都市科龙化工试剂厂。
1.2 仪器与设备
Milli-Q超纯水系统,美国密理博公司;Thermo BR4i 型冷冻离心机,美国赛默飞世尔科技有限公司;PB-2B pH计,北京赛多利斯仪器系统有限公司;Gel Doc XR+凝胶成像分析系统,美国Bio-RAD公司;NICOLET iS 10型傅里叶变换红外光谱仪,美国赛默飞世尔科技有限公司;Q200差示扫描量热仪DSC,美国TA仪器公司;Thermo PL3000冷冻干燥机,美国赛默飞世尔科技有限公司;JSM-7500F型扫描电镜,日本电子公司;UV-1800PC型紫外分光光度计,上海美谱达仪器有限公司。
1.3 方法
1.3.1 胶原蛋白的提取与纯化
参考李国辉、熊善柏的方法[6-7],在4 ℃条件下,以0.5 mol/L醋酸作为介质,胃蛋白酶用量2 000 U/g提取鱼皮、鱼鳞中的胶原蛋白。酶解液抽滤,滤液于10 000 r/min,4 ℃下离心30 min,取上清液边搅拌边加入固体NaCl盐析,4 ℃静置过夜,10 000 r/min冷冻离心20 min,收集沉淀,以0.5 mol/L醋酸复溶。复溶物用0.1 mol/L的醋酸透析24 h,超纯水透析48 h,最后冻干得到纯化的胶原蛋白样品。
1.3.2 胶原蛋白的结构性质表征
通过紫外光谱(ultraviolet spectrum,UV)、傅里叶变换红外光谱(fourier transform infrared spectroscopy,FTIR)、聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDS-PAGE)、差示扫描量热法(differential scanning calorimetry,DSC)分析手段对纯化后的胶原蛋白样品结构性质进行表征。
1.3.2.1 紫外光谱分析
将冻干的胶原蛋白溶于0.5 mol/L的醋酸,配成1 mg/mL胶原溶液,在190~400 nm进行紫外扫描,确定样品图谱及紫外最大吸收波长[8]。
1.3.2.2 FTIR分析
称取1 mg样品与1 g溴化钾(KBr)混合研磨,于40 ℃下烘干后压片,用红外光谱仪进行检测。检测条件:室内温度为25 ℃,扫描范围:450~4 000 cm-1,扫描次数:32,分辨率4 cm-1[9]。
1.3.2.3 SDS-PAGE分析
取5 mg样品与5 mL SDS样品缓冲液混合,于100 ℃加热5 min,4 000 r/min离心10 min后取上清液20 μL点样,选择浓缩胶胶浓度为5%,分离胶胶浓度为12%,开始电泳。使用考马斯亮蓝R-250染色。
1.3.2.4 DSC检测
称取胶原蛋白冻干样品约3~5 mg,用铝坩锅封存。初始温度20 ℃,在氮气流速20 mL/min条件下,以5 ℃的速率升至60 ℃,记录吸热曲线[7]。
1.3.3 胶原蛋白自聚集行为研究
1.3.3.1 浊度实验
参考YAN的方法[10],称取冻干的胶原蛋白溶于0.5 mol/L的醋酸溶液中配成浓度为1 mg/mL初始胶原蛋白溶液,取10 mL置于透析袋中,在pH 7.0含150 mmol/L NaCl的磷酸盐缓冲液(PBS)中透析24 h,取3 mL透析袋内样品在30 ℃水浴,于310 nm处测定其吸光度值,并绘制吸光度随时间变化的浊度曲线。
1.3.3.2 聚集程度的测定
样品按1.3.3.1方法透析后于30 ℃水浴条件下自聚集10 h,参考ZHANG的方法[11],4 ℃下经12 000 r/min离心30 min后取上清液测定其羟脯氨酸含量[12],同时测定1.3.6中初始胶原蛋白溶液中羟脯氨酸含量。根据羟脯氨酸含量变化计算聚集程度,公式如下:
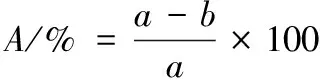
(1)
式中:A,胶原聚集程度,%;a,胶原聚集前羟脯氨酸的含量,%;b,胶原聚集后羟脯氨酸的含量,%。
1.3.3.3 SEM表征
样品按1.3.3.1方法透析后于30 ℃水浴条件下自聚集10 h后,4 ℃下经12 000 r/min离心20 min后取沉淀部分25 μL滴于刚剥离的云母片上(1 cm×1 cm),经初步干燥后滴加少量蒸馏水清洗盐结晶,于室温下干燥,同时将1.3.3.1中初始胶原蛋白溶液滴于云母片上制备对照样品。用乙醇梯度脱水、冷冻干燥,喷金处理后观察自聚集前后结构的变化[13]。
2 结果与分析
2.1 紫外光谱分析


图1 草鱼鳞与草鱼皮胶原蛋白的紫外光谱图Fig.1 UV spectrum of collagens from grass carp scale and skin
2.2 FTIR分析
由红外谱图(图2)可以看出,2种来源的胶原蛋白均具有I型胶原蛋白的5个特征吸收带:酰胺A带、酰胺B带、酰胺I带、酰胺II带和酰胺III带。酰胺A带主要是由N—H伸缩振动产生,吸收峰出现在3 400~3 440 cm-1[18],鱼鳞、鱼皮胶原蛋白的酰胺A带分别在3 323 cm-1和3 322 cm-1处均小于3 400 cm-1,可能是由于NH基团与氢键缔合后,吸收峰发生蓝移[19]。鱼鳞、鱼皮胶原蛋白的酰胺B带分别在2 927 cm-1和2 925 cm-1处,这与CH2的不对称伸缩振动有关,此外鱼皮在2 854 cm-1还存在CH2对称伸缩振动产生的吸收峰[20]。鱼皮和鱼鳞的酰胺A带、酰胺B带有频率、振幅的差异,表明两种胶原蛋白的二级结构存在不同[18,21],这种差异可能对胶原蛋白自聚集微观形貌有一定影响。
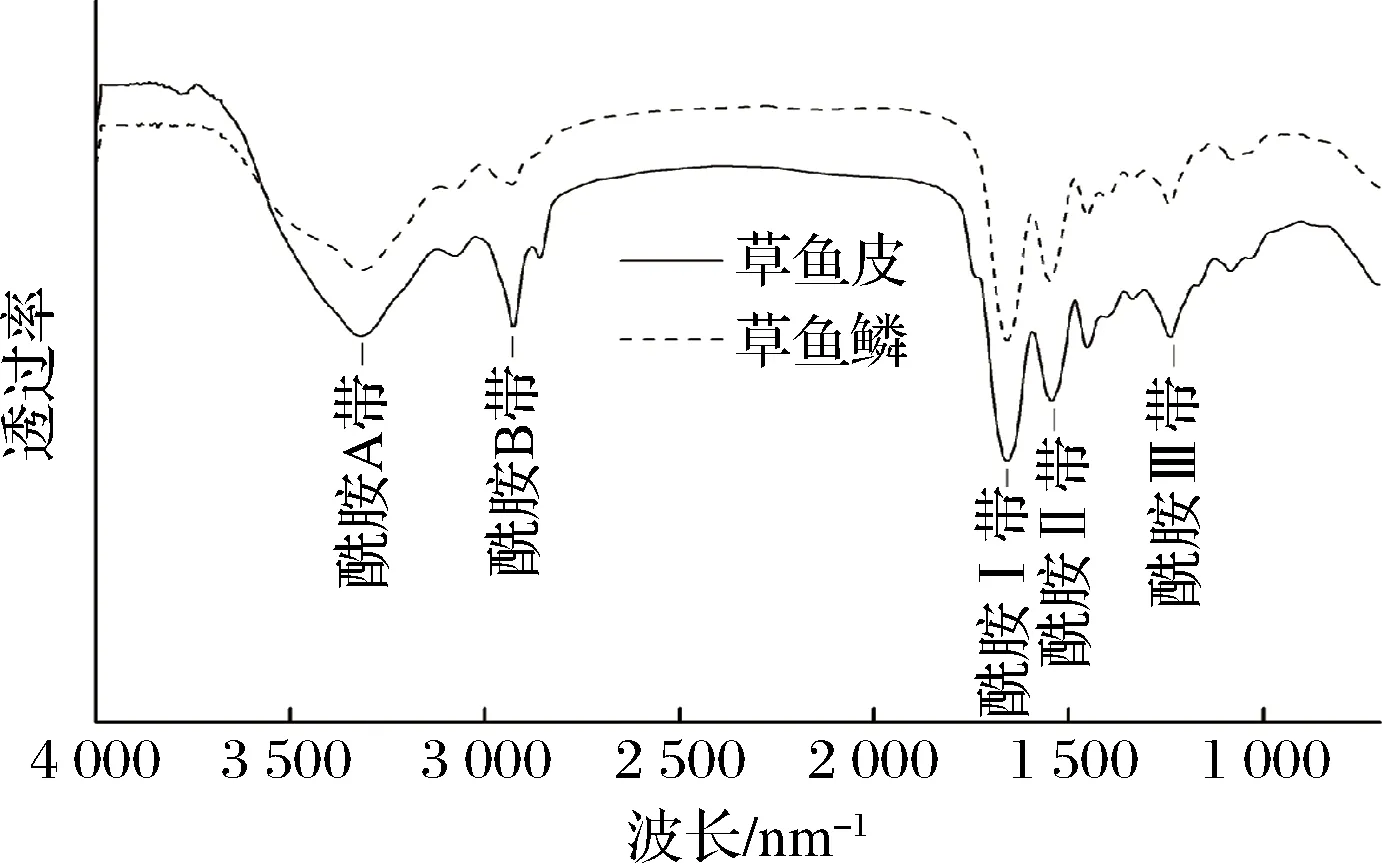
图2 草鱼鳞与草鱼皮胶原蛋白的红外光谱图Fig.2 Fourier-transform infrared spectra of collagens from grass carp scale and skin
2.3 SDS-PAGE分析
I型胶原蛋白是由至少2条不同的α链(α1链和α2链)和1条β链组成[26]。由图3可以看到,2种胶原蛋白在相对分子质量为120 kDa处含有2条α链,并且α1链的带强度约为α2链的2倍,符合I型胶原蛋白[αl(I)]2α2(I)结构,同时在200 kDa处均有高分子质量的β链(α链的二聚体)。在α2链下方无其他电泳带,表明胶原蛋白未被水解为小分子组分,保持了胶原蛋白的基本结构。用胃蛋白酶提取的胶原蛋白含α1、α2、β链是典型的I型胶原蛋白。
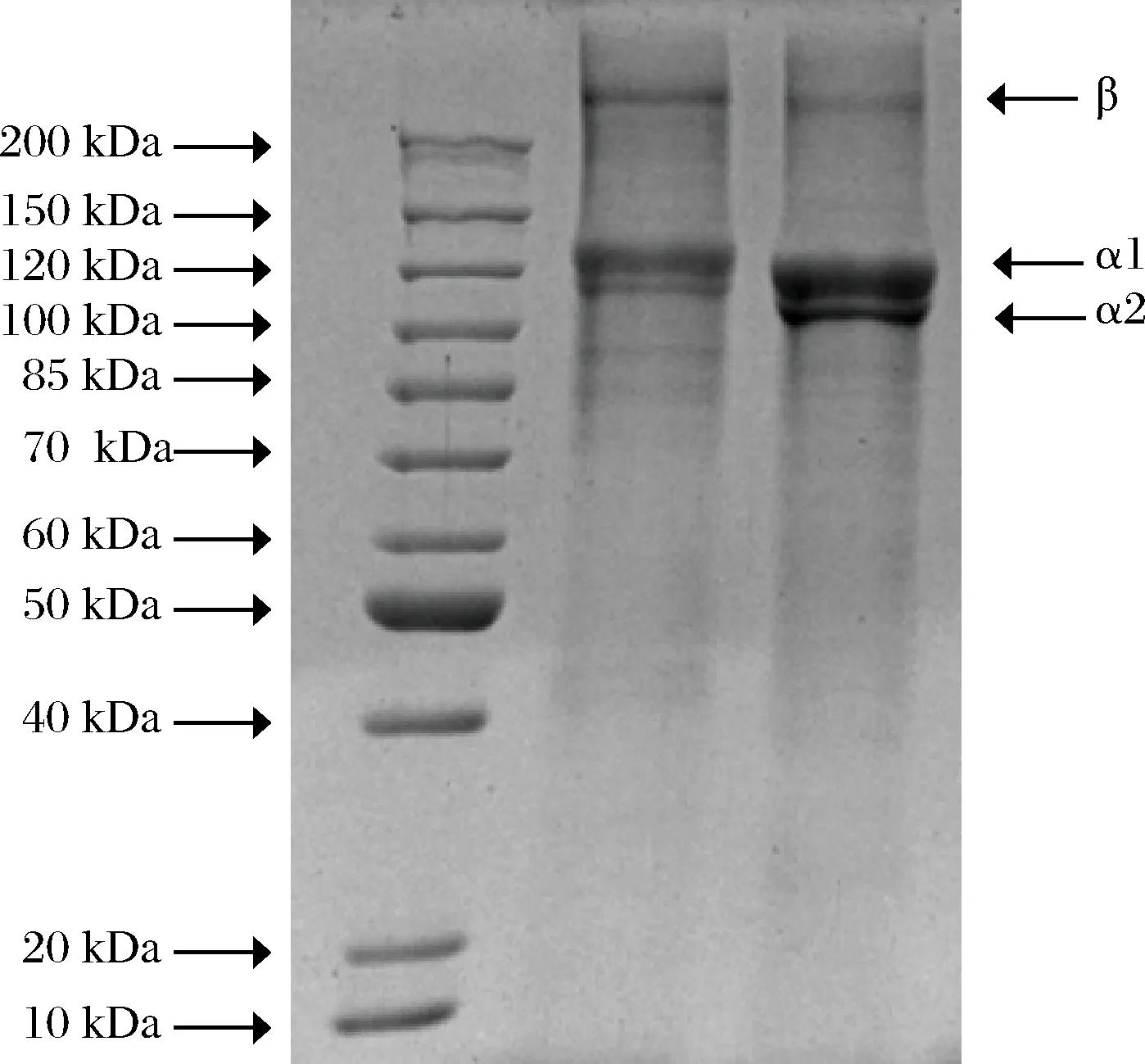
泳道1-标准蛋白;泳道2-草鱼皮胶原蛋白;泳道3-草鱼鳞胶原蛋白图3 草鱼鳞与草鱼皮胶原蛋白的SDS-PAGE图Fig.3 SDS-PAGE patterns of collagens
2.4 DSC分析
胶原蛋白的热转换是来自于胶原蛋白三螺旋结构解体成随机线圈,伴随着黏度、沉降、扩散等一系列物理变化。由图4看到,鱼皮胶原蛋白变性温度为39.75 ℃,与鲶鱼皮39.6 ℃[27]一致,但与喀拉鱼皮35.19 ℃[28]相比有一定差异。这是由于一方面鱼物体温及其栖息地温度可能对该物种胶原蛋白热稳定性产生影响[29];另一方面胶原蛋白提取方法不同也会导致其稳定性有些微差异[30]。鱼鳞胶原蛋白变性温度为34.49 ℃,与汪海波等[31]研究结果一致。鱼皮胶原蛋白变性温度高于鱼鳞胶原蛋白,与LIU等[1]研究相吻合,这可能是由于不同组织来源的胶原蛋白亚氨基酸(脯氨酸和羟脯氨酸)含量不同,从而导致胶原蛋白的热稳定性有一定差异[32]。
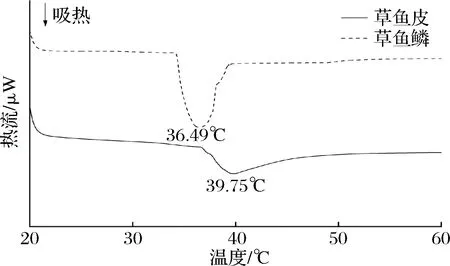
图4 草鱼鳞与草鱼皮胶原蛋白的DSC图谱Fig.4 DSC thermogram of collagens from grass carp scale and skin
2.5 浊度实验
浊度实验通过检测310 nm处浊度的变化,对胶原蛋白自聚集进行监测。由图5可以看到,在相同的自聚集条件下,2种来源的胶原蛋白均有自聚集能力,表现为浊度值随时间逐渐增加。自聚集过程分为3个阶段[33],成核期(此阶段吸光度基本保持不变);自聚集期(此阶段吸光度快速增加,胶原蛋白自聚集形成纤维);平衡期(吸光度达到最大值且保持恒定,揭示胶原纤维的三维网状结构形成)。由图5中可以看出鱼鳞成核期很短,说明成核快速,能够在短时间内迅速成核。鱼皮有10 min的成核期,与赵燕等[13]报道一致,其浊度整体变化小于鱼鳞,这可能由于鱼鳞在自聚集时会快速产生类似于胶体的状态,致使其吸光度变化较大。
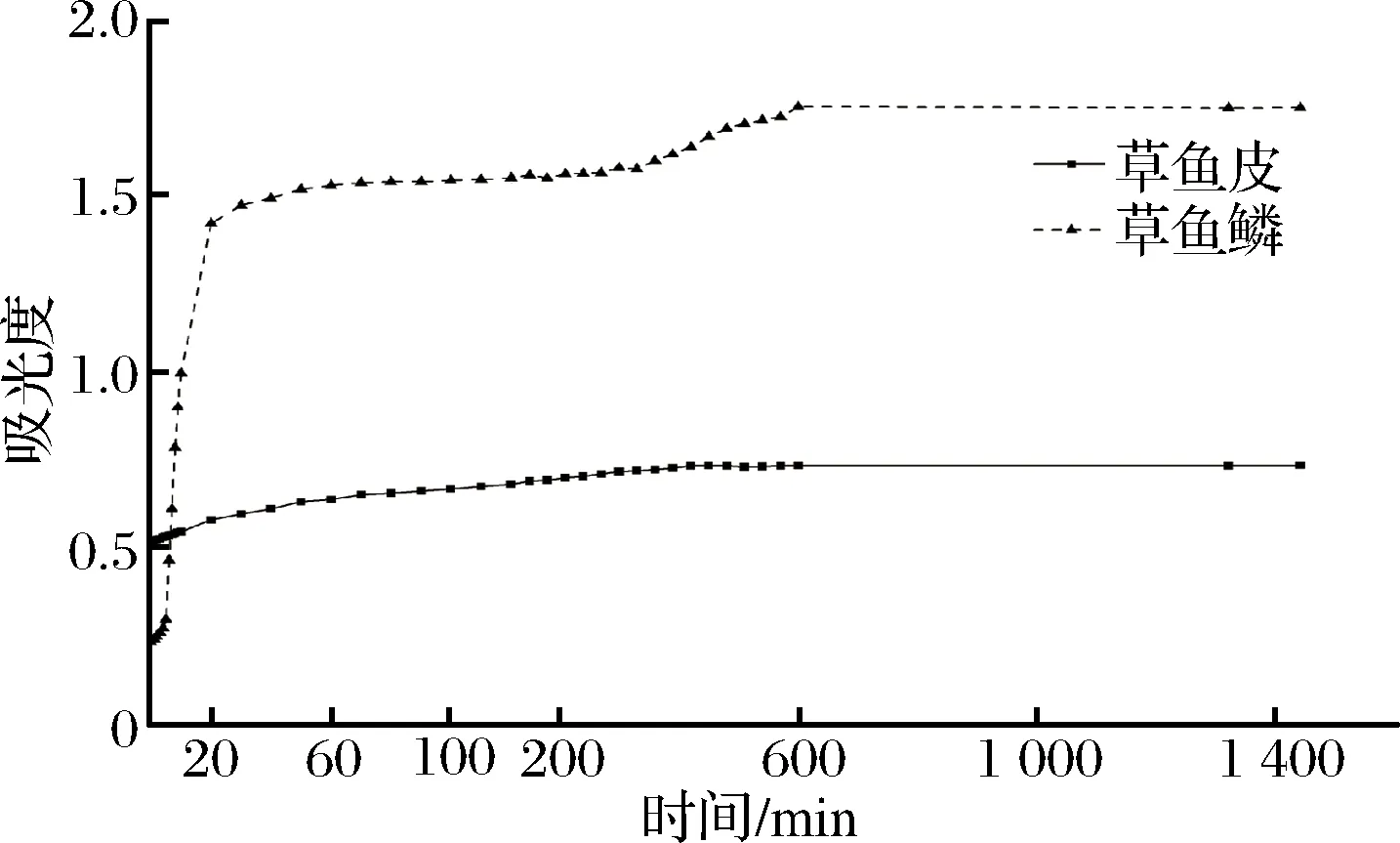
图5 草鱼鳞与草鱼皮胶原蛋白的自聚集曲线Fig.5 Self-assembly curves of collagens from grass carp scale and skin
2.6 聚集程度分析
由图5中可以看到在相同条件下经过10 h的自聚集后,2种胶原蛋白的聚集程度较为接近,鱼皮胶原蛋白为28%,鱼鳞胶原蛋白为27.33%,而2种胶原蛋白在浊度实验中浊度变化差异较大,可能是由于聚集状态与聚集微观结构不同所导致。不同物种来源的胶原蛋白在相同自聚集条件下聚集程度存在一定差异,而同一物种不同部位的胶原蛋白聚集程度十分接近,通过调节自聚集温度、pH、盐离子浓度等可提高胶原蛋白自聚集程度[4]。相同自聚集条件下,YAN对罗非鱼皮胶原蛋白自聚集程度测定为19.6%[10],姚攀测得鳙鱼皮胶原蛋白自聚集程度为35%,而随着改变自聚集条件:适量升高温度、pH,降低离子强度,延长聚集时间,鳙鱼皮胶原蛋白的聚集程度可达到80%[4],ZHANG对比贝斯特鲟鱼鱼皮与鱼膘自聚集程度分别为92.5%与96%[11],本课题组对牛皮与牛肌腱中胶原蛋白聚集程度进行测定分别为53%与59%。
2.7 SEM表征
草鱼鳞及草鱼皮胶原蛋白聚集前后的扫描电镜图如图6所示,由图6中以看到2种胶原蛋白聚集前都无序的分布在基底上形成多孔膜结构,其中草鱼皮胶原蛋白膜结构孔隙多且较大,草鱼鳞胶原蛋白孔隙相对较少且存在少量的细小纤维;而聚集后则均出现纤维网状聚集形貌。胶原蛋白聚集前后结构的差异说明自聚集行为可以显著改变其超微结构。这是因为胶原蛋白是典型的两性分子拥有大量的亲水性氨基酸,随着中性盐的加入胶原蛋白的水合层会被破坏,带电残基和疏水基团暴露,从而因静电力和疏水相互作用发生快速聚集[34]。2种胶原蛋白聚集后均形成相互交错的纤维,但其形貌存在一定差异。鱼鳞胶原蛋白形成的网状结构更加明显,可以清晰看到形状分明的纤维状聚集结构,并且SEM能观测到其聚集后形成胶原原纤维的周期性横纹D带,具有较大的表面积。鱼皮胶原蛋白形成的胶原纤维聚集形态周期性横纹结构不明显,纤维网状结构虽呈一定坍塌状态,但聚集行为仍具有一定规模。胶原蛋白分子在体内通过侧向聚集和轴向聚集形成具有周期性超分子结构的原纤维,这种结构赋予了胶原蛋白韧性好、抗张力强等生物学特性,也一定程度上决定了胶原蛋白在生物、材料等领域的重要应用价值[35]。由此可见,草鱼鳞胶原蛋白自聚集形貌更有利于其进一步改性及利用,可用于吸附分离材料、催化剂载体及生物材料等领域的研究。

(a)草鱼鳞胶原蛋白聚集10 h;(b)草鱼鳞胶原蛋白;(c)草鱼皮胶原蛋白聚集10 h;(d)草鱼皮胶原蛋白图6 草鱼鳞与草鱼皮胶原蛋白扫描电镜图(×20 000)Fig.6 Scanning electron micrographs of collagens from grass carp scale and skin(×20 000)
3 结论
提取草鱼鳞、草鱼皮中胶原蛋白,对其结构性质进行表征并比较体外自聚集行为。结果表明,鱼皮、鱼鳞胶原蛋白均为典型的I型胶原蛋白,但二级结构存在一定差异。2种胶原蛋白均可产生体外自聚集行为且聚集程度基本一致。SEM图像显示鱼鳞胶原蛋白形成形状分明的纤维网状聚集结构,且能观测到胶原原纤维的周期性横纹D带,这种结构将能提高胶原基材料的生物性能,有利于其进一步改性及利用,可望应用于吸附分离材料、催化剂载体及生物材料等领域。2种不同来源胶原蛋白二级结构的差异可能对其自聚集微观形貌有一定影响,具体作用机制仍需进一步研究。该研究结果对于解释不同来源胶原蛋白自聚集能力行为差异具有一定理论意义。
[1] LIU Da-song, ZHANG Xuan, LI Tian-cheng, et al. Extraction and characterization of acid-and pepsin-soluble collagens from the scales, skins and swim-bladders of grass carp (Ctenopharyngodonidella)[J]. Food Bioscience, 2015, 9: 68-74.
[2] MOHAMMADI R, MOHAMMADIFAR M A, MORTAZAVIAN A M, et al. Extraction optimization of pepsin-soluble collagen from eggshell membrane by response surface methodology (RSM)[J]. Food Chemistry, 2016, 190:186-193.
[3] 魏香奕, 张文华, 石碧. 胶原重聚集纤维材料的制备和表征[J]. 功能材料, 2014, 45(15): 15 143-15 147.
[4] 姚攀. 鳙鱼皮胶原蛋白的提取, 性能分析及体外自组装行为研究[D]. 武汉: 武汉轻工大学, 2013.
[5] 李国辉, 危冬发, 苏彩秀. 胶原蛋白理化性质的研究[J]. 江西化工, 2011(3):117-121.
[6] 熊善柏. 鱼鳞胶原蛋白的提取与胶原海绵的制备研究[D]. 武汉: 华中农业大学,2008.
[7] 王艳. 草鱼皮胶原蛋白的提取、性质研究及膜性能表征[D]. 天津: 天津科技大学,2014.
[8] 黄石溪. 草鱼不同部位胶原蛋白的提取及特性研究[D]. 长沙: 湖南农业大学, 2013.
[9] 于玮, 王雪蒙, 马良, 等. 猪皮胶原蛋白提取过程中酶解条件优化及其结构鉴定[J]. 西南大学学报(自然科学版), 2015, 37(4): 106-113.
[10] YAN Ming-yan, LI Ba-fang, ZHAO Xue, et al. Effect of concentration, pH and ionic strength on the kinetic self-assembly of acid-soluble collagen from walleye pollock (Theragrachalcogramma) skin[J]. Food Hydrocolloids, 2012, 29(1):199-204.
[11] ZHANG Xi, OKAWA M, TAN Yong-kai, et al. Biochemical characterisation and assessment of fibril-forming ability of collagens extracted from Bester sturgeon Huso huso× Acipenser ruthenus[J]. Food Chemistry, 2014,160: 305-312.
[12] FRIESS W. Collagen-biomaterial for drug delivery[J]. European Journal of Pharmaceutics and Biopharmaceutics, 1998,45(2):113-136.
[13] 赵燕, 鲁亮, 杨玲, 等. 草鱼和乌鳢鱼皮胶原体外自组装过程中的凝胶化行为比较研究[J]. 食品科学, 2014,35(19):34-38.
[14] KUMAR N S S, NAZEER R A, JAIGANESH R. Wound healing properties of collagen from the bone of two marine fishes[J]. International Journal of Peptide Research and Therapeutics, 2012,18(3):185-192.
[15] CHEN Si-jin, CHEN Hui, XIE Quan-ning, et al. Rapid isolation of high purity pepsin-soluble type I collagen from scales of red drum fish (Sciaenopsocellatus)[J]. Food Hydrocolloids, 2016,52:468-477.
[16] ZHANG Min, LIU Wen-tao, LI Guo-ying. Isolation and characterisation of collagens from the skin of largefin longbarbel catfish (Mystusmacropterus)[J]. Food Chemistry, 2009,115(3):826-831.
[17] RAO K P, ALAMELU S. Effect of crosslinking agent on the release of an aqueous marker from liposomes sequestered in collagen and chitosan gels[J]. Journal of Membrane Science, 1992,71(1):161-167.
[18] DOYLE B B, BENDIT E G, BLOUT E R. Infrared spectroscopy of collagen and collagen-like polypeptides[J]. Biopolymers, 1975,14(5):937-957.
[19] KITTIPHATTANABAWON P, NALINANON S, BENJAKUL S, et al. Characteristics of pepsin-solubilised collagen from the skin of splendid squid (Loligoformosana)[J]. Journal of Chemistry, 2015, 2015(1):1-8.
[20] ABE Y, KRIMM S. Normal vibrations of crystalline polyglycine I[J]. Biopolymers, 1972,11(9):1 817-1 839.
[21] 钟朝辉. 鱼鳞酶溶性胶原蛋白的提取、特性及其二级结构的温度效应研究[D]. 武汉: 华中农业大学, 2006.
[22] KRIMM S, BANDEKAR J. Vibrational spectroscopy and conformation of peptides, polypeptides, and proteins[J]. Advances in Protein Chemistry, 1986, 38:181-364.
[23] CHEN Jun-de, LI Long, YI Rui-zao, et al. Extraction and characterization of acid-soluble collagen from scales and skin of tilapia (Oreochromisniloticus)[J]. Lebensmittel-Wissenschaft und-Technologie, 2015, 66: 453-459.
[24] PAYNE K J, VEIS A. Fourier transform IR spectroscopy of collagen and gelatin solutions: deconvolution of the amide I band for conformational studies[J]. Biopolymers, 1988, 27(11): 1 749-1 760.
[25] JACKSON M, WATSON P H, HALLIDAY W C, et al. Beware of connective tissue proteins: assignment and implications of collagen absorptions in infrared spectra of human tissues[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 1995,1270(1):1-6.
[26] TYLINGO R, MANIA S, PANEK A, et al. Isolation and characterization of acid soluble collagen from the skin of african catfish (Clariasgariepinus), salmon (Salmosalar) and baltic cod (Gadusmorhua)[J]. J Biotechnol Biomater, 2016, 6(234): 2.
[27] SINGH P, BENJAKUL S, MAQSOOD S, et al. Isolation and characterisation of collagen extracted from the skin of striped catfish (Pangasianodonhypophthalmus)[J]. Food Chemistry, 2011,124(1):97-105.
[28] PAL G K, NIDHEESH T, SURESH P V. Comparative study on characteristics and in vitro fibril formation ability of acid and pepsin soluble collagen from the skin of catla (Catlacatla) and rohu (Labeorohita)[J]. Food Research International, 2015,76:804-812.
[29] OKAZAKI E, OSAKO K. Isolation and characterization of acid-soluble collagen from the scales of marine fishes from Japan and Vietnam[J]. Food Chemistry, 2014,149:264-270.
[30] AHMAD M, BENJAKUL S. Extraction and characterisation of pepsin-solubilised collagen from the skin of unicorn leatherjacket (Aluterusmonocerous)[J]. Food Chemistry, 2010,120(3):817-824.
[31] 汪海波, 梁艳萍, 汪海婴, 等. 草鱼鱼鳞胶原蛋白的提取及其部分生物学性能[J]. 水产学报, 2012, 36(4): 553-561.
[32] MATMAROH K, BENJAKUL S, PRODPRAN T, et al. Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish (Parupeneusheptacanthus)[J]. Food Chemistry, 2011,129(3):1 179-1 186.
[33] NOITUP P, MORRISSEYORRISSE M T, GARNJANAGOONCHORN W. In vitro self-assembly of silver-line grunt type Ⅰ collagen: effects of collagen concentrations, pH and temperatures on collagen self-assembly[J]. Journal of Food Biochemistry, 2006,30(5):547-555.
[34] 魏香奕. 胶原聚集行为的原子力显微镜研究[D]. 成都: 四川大学, 2014.
[35] KADLER K E, HOLMES D F, TROTTER J A, et al. Collagen fibril formation[J]. Biochemical Journal, 1996, 316(1): 1-11.
