密度梯度离心法结合上游法优化精液对体外受精-胚胎移植临床结局的影响*
2018-03-16许文太周洪贵川北医学院附属医院妇产科四川南充637000解放军第101医院生殖医学中心江苏无锡14000
吴 斌,许文太,周洪贵(1.川北医学院附属医院妇产科,四川南充637000;.解放军第101医院生殖医学中心,江苏无锡14000)
体外受精-胚胎移植(IVF-ET)技术也称“试管婴儿”技术,是当今治疗不孕不育的重要方法,精液优化处理作为IVF-ET技术(ART)的关键步骤之一,其目的是分离出精液中的精浆,除去畸形精子、死精子、细胞碎片及其他有害的物质,最终优选出一定数量成熟且具有受精潜能的前线运动精子[1]。目前,临床上常用的优选方法主要包括上游法、密度梯度离心(DGC)法等。本研究比较了DGC法、上游法及DGC结合上游法处理精子的IVF-ET临床结局,旨在为优化IVF-ET技术过程中精子处理方法提供参考。
1 资料与方法
1.1 研究对象 选择解放军第101医院生殖医学中心2013年12月至2016年3月施行IVF-ET助孕的共206个IVF-ET治疗周期的患者,对其临床资料进行回顾性分析。纳入病例的不孕原因包括:盆腔、输卵管因素、免疫性因素、不明原因[2]。排除标准为男方中重度精子少、弱、畸形精子症患者。其中104个周期采用DGC法处理精液,为实验1组;30个周期采用上游法处理精子,为实验2组;72个周期采用DGC法结合上游法处理精子,为实验3组。
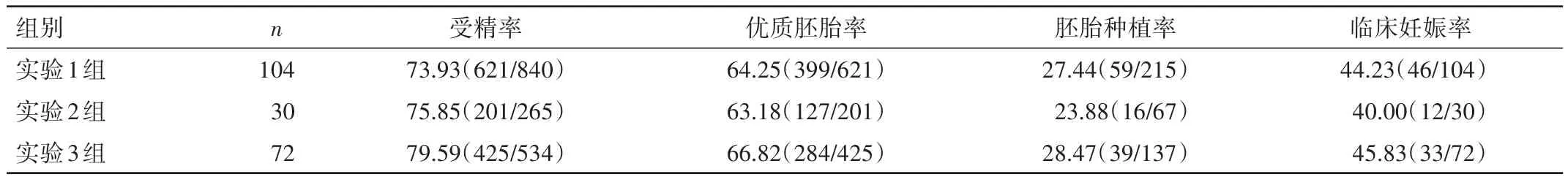
表3 3组患者的IVF-ET结局比较[%(n/n)]
1.2 方法
1.2.1 样本采集 女方给予常规促排卵方案[3],待体内卵泡发育成熟后对其注射人绒毛膜促性腺激素(HCG),剂量为 5 000 U 或 10 000 U,35~36 h后,经阴道超声引导下行卵泡穿刺取卵。男方禁欲2~7 d后在女方取卵手术当天通过手淫法取精液[4],收集于无菌取精杯中,液化后待处理。
1.2.2 DGC法[5]将Isolate精子梯度液(美国Irvine)的下层液(浓度80%)加入15 mL至锥底离心管底部,再将同体积浓度为40%的上层液缓慢置于其上,上下层可见明显分界面,再沿壁缓慢加入1.5 mL已液化的精液,1 338 r/min离心15 min,弃除上下层梯度液和精浆,精子沉淀物用人输卵管受精液(HTF,Quinn′s Advantage®Fertilization media)1 092 r/min离心洗涤 2次,弃上层,补充HTF液至1 mL,混匀后置于37℃、5%CO2培养箱内备用。
1.2.3 上游法[5]将液化后的精液充分混匀后,取1 mL加入5mL的圆底试管底部,在其上分层加入HTF液2mL,将离心管倾斜45°,置入37℃培养箱,培养上游30~60 min(时间根据精液质量来调整),避免晃动。用巴士德吸管吸出上层呈云雾状的液体,移入另一支圆底试管,添加HTF液 2 mL,混匀,1 092 r/min离心 5 min。吸出上清液,加HTF液0.5 mL,轻弹管底,使沉淀松散。分层加入HTF液1 mL,45°倾斜,置于37℃培养箱内20 min,吸取上部精子悬液,调整浓度,置入37℃培养箱待受精用。1.2.4 DGC法结合上游法 先用密度梯度离心液处理,弃除精浆和2层梯度液后,加HTF液2 mL混匀,1 092 r/min离心5 min,弃上清;再加HTF液0.3 mL,轻弹管底,使沉淀松散,分层加入HTF液1 mL,45°倾斜,置于37℃培养箱内30 min,吸取上部精子悬液转入另一支锥底离心管内,加HTF液1 mL混匀,调整精子浓度备用。
1.2.5 体外受精、胚胎培养和移植 3组均于取卵后3~5 h,将优化好的精子加入到含有卵子的培养皿中,调整好精子浓度,在37℃、5%CO2培养箱中共培养16~20 h后,机械法脱颗粒观察受精情况,第3天观察卵裂情况并记录,胚胎评分后行胚胎移植或胚胎冷冻。
1.2.6 胚胎评分标准 根据细胞数、细胞大小均匀与否、碎片多少等情况,参照2010年美国辅助生殖技术协会(SART)的胚胎评分系统[6]进行卵裂期胚胎质量评分,见表1。评分结果Ⅰ级或Ⅱ级的为优质胚胎。受精率=受精胚胎数/获卵数;优质胚胎率=优质胚胎数/正常受精卵裂数;胚胎种植率=着床胚胎总数/移植胚胎总数。移植后28 d B超检测到孕囊和胎心即为临床妊娠,临床妊娠率=妊娠周期数/移植周期数。

表1 卵裂期胚胎评分标准
1.3 统计学处理 应用SPSS19.0进行统计学分析,定量资料正态分布的数据以±s表示,采用t检验;率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 3 组患者的基本情况比较 3组患者女方年龄、不孕年限、男方年龄及获卵数比较,差异均无统计学意义(P>0.05),见表2。
表2 3组患者的基本情况比较(±s)
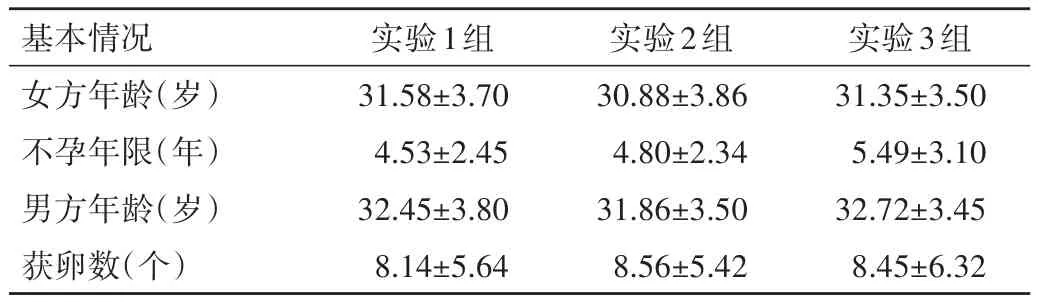
表2 3组患者的基本情况比较(±s)
基本情况女方年龄(岁)不孕年限(年)男方年龄(岁)获卵数(个)实验1组31.58±3.70 4.53±2.45 32.45±3.80 8.14±5.64实验2组30.88±3.86 4.80±2.34 31.86±3.50 8.56±5.42实验3组31.35±3.50 5.49±3.10 32.72±3.45 8.45±6.32
2.2 3 组患者的IVF-ET结局比较 实验3组的受精率显著高于实验1组,差异有统计学意义(P<0.05),高于实验2组,但差异无统计学意义(P>0.05)。3组优质胚胎率、胚胎种植率、临床妊娠率比较,差异均无统计学意义(P>0.05),见表3。
3 讨 论
精子被多种精液中的多种成分保护,如精浆、上皮细胞、未成熟或死的精细胞、红细胞、白细胞,甚至细菌,产生毒素或生物活性物质[7],如去能因子或氧自由基,损害受精能力[8-9]。基于以上原因,洗涤分离精子是非常必要的。
目前有多种方法用于分离活动的且形态正常的精子用于体外受精,应用最广泛的是DGC法和上游法[10],上游法的原理是活动精子有向上游到培养液中的能力,从而将活动精子与死精子、白细胞及杂质分开,其可显著提高精子活动率、存活率、正常形态百分率,操作简便,成本低廉,但是精子的回收率低[11]。DGC法的原理:用一定的介质在离心管内形成连续或非连续密度梯度,将精液置于介质的顶部,通过离心力场的作用使精子与精液其他组分分层、分离。本研究采用2层浓度分别为80%和40%的非连续密度梯度离心液,具有不同悬浮密度的细胞及其他类型的颗粒会慢慢沉淀至密度较高的溶液,离心将会加快其沉淀速度,由于DNA浓缩后的成熟精子密度高于80%,因而离心后活动力强的成熟精子可以通过这层液体到达离心管底部,而其他类型的细胞包括未成熟精子就会在40%和80%的液体交界面上终止沉淀[1]。已证实,与上游法比较,DGC法能回收更多形态正常的精子,并明显增加精子的活力和体外存活能力,尤其对于重度少、弱及畸形精子症,冷冻复苏后的精液可提高回收率[12-13]。ZINI等[14]和SAKKAS等[15]报道,DGC法可去除染色体浓缩差和DNA断裂的精子。EREL等[16]还认为处理质量较差的精液,DGC法得到精子的存活率、核成熟度和顶体反应率均高于上游法。
KARAMAHMUTOGLU等[17]研究使用DGC法结合上游法处理精液可以提高宫腔内人工授精周期的妊娠成功率。XUE等[18]报道DGC法结合上游法可以富集畸形精子症患者的形态正常、DNA完整的精子。STEVANATO等[19]和GHUMMAN等[20]的研究均显示DGC法结合上游法和上游法均可以收集较健康的精子,减少凋亡或DNA损伤的精子。KIM等[21]研究结果显示,DGC法结合上游法与上游法比较,临床妊娠率并无显著差异。基于以上研究,本中心继续探索了更理想的精液处理方法,DGC法结合上游法是在传统的非连续密度梯度离心后增加一个上游筛选过程。结合了2种精子处理方法的优点,精子回收率高且能对回收的精子二次筛选,不增加精子的DNA损伤,从而保证了用于体外受精的精子质量。
本研究分析比较了3种精液处理方法的受精率、优质胚胎率、胚胎种植率和临床妊娠率,结果显示,DGC法结合上游法的受精率高于单纯的DGC法,可能是由于精子穿过2层非连续梯度液到达离心管的底部,而精浆被隔离在梯度液上面,精液中影响受精和影响胚胎质量的成分被有效地去除,精子沉淀物用受精液离心洗涤1次,也可基本去除沉淀物中的梯度液,最后沉淀精子团还可能含有染色体浓缩差和DNA断裂的精子,接着精子团被转入含有HTF液的离心管底部,37℃孵育上游30 min,质量较好的精子分布在上层。总的来说,受精用的上层精子活力相对较好、精浆成分去除较彻底、核成熟度好、染色质完整性好。然而,本研究的3个实验组的优质胚胎率、胚胎种植率和临床妊娠率并无统计学上的显著差异,原因可能与本研究例数较少,抽样误差较大有关,今后需要增加样本例数进一步研究。
综上所述,作者认为DGC法结合上游法能筛选出活力、形态足够好和DNA损伤小的精子,值得在IVFET治疗中推广应用。
[1]黄国宁.辅助生殖实验室技术[M].北京:人民卫生出版社,2014:62-63.
[2]中华医学会,黄荷凤.临床诊疗指南-辅助生殖技术与精子库分册[M].北京:人民卫生出版社,2009:33-37.
[3]陈瑞玲,李庆琨,韦相才,等.体外受精-胚胎移植术中使用冷冻供精及夫精的临床效果观察[J].中国男科学杂志,2003,17(4):264-266.
[4]BRINSDEN PR.Texmook of in vitro fertilization and assisied reproduction[M].北京:人民卫生出版社,2009:22-234.
[5]World Health Organization.WHO laboratory manual for the examination and processing of human semen[M].5th ed.Cambridge:Cambridge University Press,2010:138-139.
[6]RACOWSKY C,VERNON M,MAYER J,et al.Standardization of grading embryo morphology[J].J Assist Reprod Genet,2010,27(8):437-439.
[7]ARAKI Y,YAO T,ASAYAMA Y,et al.Single human sperm cryopreservation method using hollow-core agarose capsules[J].Fertil Steril,2015,104(4):1004-1009.
[8]LYU BN,ISMAILOV SB,ISMAILOV B,et al.Mitochondrial concept of leukemogenesis:key role of oxygen-peroxide effects[J].Theor Biol Med Model,2008,5:23.
[9]FORD WC.Regulation of sperm function by reactive oxygen species[J].Hum Reprod Update,2004,10(5):387-399.
[10]PRAKASH P,LEYKIN L,CHEN Z,et al.Preparation by differential gradient centrifugation is better than swim up in selecting sperm with normal morphology(strict criteria)[J].Fertil Steril,1998,69(4):722-726.
[11]ESTEVES SC,SHARMA RK,THOMAS AJ,et al.Improvement in motion characteristics and acrosome status in cryopreserved human spermatozoa by swim-up processing before freezing[J].Hum Reprod,2000,15(10):2173-2179.
[12]CLAASSENS OE,MENKVELD R,HARRISON KL.Evaluation of three substitutes for Percoll in sperm isolation by density gradient centrifugation[J].Hum Reprod,1998,13(11):3139-3143.
[13]HERNANDEZ-LOPEZ L,UMLAND N,MONDRAGON-CEBALLO S,et al.Comparison of the effects of percoll and puresperm on the common marmoset semen[J].J Med Primatol,2005,34(2):86-90.
[14]ZINI A,FINELLI A,PHANG D,et al.Influence of semen processing technique on human sperm DNA integrity[J].Urology,2000,56(6):1081-1084.
[15]SAKKAS D,MANICARDI GC,TOMLINSON M,et al.The use of two density gradient centrifugation techniques and the swim-up method to separate spermatozoa with chromatin and nuclear DNA anomalies[J].Hum Reprod,2000,15(5):1112-1116.
[16]EREL CT,SENTURK LM,IREZ T,et al.Sperm-preparation techniques for men with normal and abnormal semen analysis.A comparison[J].J Reprod Med,2000,45(11):917-922.
[17]KARAMAHMUTOGLU H,ERDEM A,ERDEM M,et al.The gradient technique improves success rates in intrauterine insemination cycles of unexplained subfertile couples when compared to swim up technique;a prospective randomized study[J].J Assist Reprod Genet,2014,31(9):1139-1145.
[18]XUE X,WANG WS,SHI JZ,et al.Efficacy of swim-up versus density gradient centrifugation in improving sperm deformity rate and DNA fragmentation index in semen samples from teratozoospermic patients[J].J Assist Reprod Genet,2014,31(9):1161-1166.
[19]STEVANATO J,BERTOLLA RP,BARRADAS V,et al.Semen processing by density gradient centrifugation does not improve sperm apoptotic deoxyribonucleic acid fragmentation rates[J].Fertil Steril,2008,90(3):889-890.
[20]GHUMMAN S,ADIGA SK,UPADHYA D,et al.Combination of swimup and density gradient separation methods effectively eliminate DNA damaged sperm[J].J Turk Ger Gynecol Assoc,2011,12(3):148-152.
[21]KIM EK,KIM EH,KIM EA,et al.Comparison of the effect of different media on the clinical outcomes of the density-gradient centrifugation/swim-up and swim-up methods[J].Clin Exp Reprod Med,2015,42(1):22-29.
