ZNF267在膀胱癌中的表达及其对细胞增殖和转移的影响
2018-03-16曹正邱明星
曹正,邱明星
(西南医科大学,四川 泸州 646000)
在中国膀胱癌发病率居泌尿生殖系统恶性肿瘤的首位[1-2]。膀胱移行细胞癌(transitional cell carcinoma,TCC)是膀胱癌最常见的类型,部分患者将发展为肌层侵袭性膀胱癌[1-2]。化疗可有效控制部分肌层侵袭性膀胱癌,但无法提高大部分患者的生存期[3]。因此,阐明膀胱癌发生、发展的分子机制显得尤为重要。Kruppel样因子家族分子可调控多项生理进程[4]。锌指蛋白267(zinc finger protein 267,ZNF267)是Kruppel锌指家族成员,研究显示ZNF267在多种肿瘤中发挥重要作用[5-6]。然而,尚无研究阐明ZNF267在膀胱癌中的表达及其功能。
1 材料与方法
1.1 材料与试剂
1640培养基(美国HyClone公司),青霉素-链霉素双抗(美国HyClone公司),胎牛血清(美国Gibco公司)。逆转录及RNA提取试剂盒、实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)所应用的 Real Master试剂盒购自北京天根生化科技有限公司,FITC标记的Annexin-V及PI抗体(美国Biolegend公司),Tranwell小室(美国Milipore公司),人膀胱癌细胞系T24、BIU87及人膀胱上皮永生化细胞系SV-HUC-1(中国科学院上海细胞库)。
1.2 主要仪器
液氮灌、细胞培养箱购自美国Thermo公司,ABI 7900型PCR仪(美国ABI公司),BD FACS Calibur流式细胞仪(美国BD公司)。
1.3 方法
1.3.1 组织标本 14例TCC组织及配对癌旁组织标本来自西南医科大学附属医院泌尿外科。14例患者在根治性切除术后经病理诊断为TCC。所有入组患者同意本研究使用其组织标本,并签署知情同意书及授权书。本研究经西南医科大学附属医院伦理委员会批准。标本收集后,储存于液氮罐中。
1.3.2 细胞培养 人膀胱癌细胞系T24、BIU87,以及人膀胱上皮永生化细胞系SV-HUC-1用含10%胎牛血清和1%青霉素-链霉素双抗的1640培养基,所有细胞置于37℃、5%二氧化碳CO2细胞培养箱中。
1.3.3 RNA提取 Trizol裂解人TCC组织或细胞系,4℃、12 000 r/min离心15 min,吸取水相层,加入等体积的异丙醇。4℃、12 000 r/min离心10 min,弃上清,所得胶状沉淀即为RNA。
1.3.4 qRT-PCR 采用qRT-PCR反应检测TCC组织和细胞系中ZNF267的相对表达量,以及ZNF267在TCC细胞中的干涉效率。将RNA逆转录为cDNA作为模板。将125μl 20xSYBR溶液加入1.0 ml 2.5x Real Master Mix中,所得溶液作为试剂A。实验采用20μl体系,内含 9μl试剂 A,1μl 20x ROX Reference Dye,1μl正向引物,1μl反向引物,cDNA模板2μl,6μl去离子水。qRT-PCR反应条件为:95℃预变性2 min;95℃变性20 s,60℃退火20 s,72℃延伸30 s,共35个循环。ZNF267正向引物:5′-ATGGGAGCTGTGATCTTGAGA,反向引物:5′-GCAATGATGAATGAGTAAAGACC;β-actin正向引物:5’-CTCCATCCTGGCCTCGCTGT-3’,反向引物:5’-GCTGTCACCTTCACCGTTCC-3’。ZNF267相对表达量 :2-ΔΔCt=CtZNF267-Ctβ-actin。
1.3.5 CCK-8法 采用CCK-8增殖试剂盒检测转染ZNF267-NC和ZNF267 siRNA的TCC细胞增殖情况。取对数生长期的人TCC细胞,制备单细胞悬液,以2.0×103个/孔的细胞密度接种于96孔板中,每组实验设8个复孔,分别培养1~5 d,加入10μl/孔的CCK-8试剂,培养4 h后,在450 nm波长处测定吸光度值,所得数据作为第1天的OD值。而后每天在同一时间再次测定吸光度值,根据5 d内各组所测OD值,绘制细胞增殖曲线。
1.3.6 流式细胞术 采用流式细胞术检测转染ZNF267-NC和ZNF267 siRNA的TCC细胞周期情况。取对数生长期的人TCC细胞,制备为单细胞悬液。10 ml PBS,1 000 r/min离心10 min,反复洗涤3次,弃上清;若检测细胞周期,则在各组细胞中加入100μl流式洗液和50μg/ml PI 5μl,或同型对照抗体,避光反应15 min。采用尼龙膜过滤细胞,除去细胞团块后,立即用BD FACS Calibur流式细胞仪检测。若检测细胞凋亡,则在清洗细胞后加入FITC标记的20μg/ml Annexin-V 10μl和 50μg/ml PI 5μl,或 Annexin-V 及PI的同型对照抗体,避光反应15 min。采用尼龙膜过滤细胞,除去细胞团块后,立即利用BD FACS Calibur流式细胞仪检测。
1.3.7 细胞转移及侵袭实验 ①细胞转移实验:采用Transwell实验检测转染ZNF267-NC和ZNF267 siRNA的TCC细胞转移能力。Transwell小室内加入100μl密度为1×105个/ml的无血清肿瘤细胞悬液,下室加入500μl含10%胎牛血清的1640培养基。24 h后甲醇固定,结晶紫染色,切下Transwell膜,封片。②细胞侵袭实验:采用Transwell实验检测转染ZNF267-NC和ZNF267 siRNA的TCC细胞侵袭能力。Transwell小室预先铺基质胶,其余步骤同细胞转移实验。
1.4 统计学方法
数据分析采用SPSS 22.0统计软件,计量资料以均数±标准差(±s)表示,用方差分析或t检验,P<0.05为差异有统计学意义。
2 结果
2.1 ZNF267在人TCC组织及细胞系中的表达
2.1.1 TCC组织 14例TCC组织中ZNF267 mRNA的相对表达量为(3.743±1.513),14例癌旁组织为(1.107±0.539),经t检验,差异有统计学意义(t=2.947,P=0.036),TCC组织中ZNF267 mRNA的表达水平高于癌旁组织。见图1。
2.1.2 细胞系 ZNF267 mRNA在人膀胱上皮永生化细胞SV-HUC-1中的相对表达水平为(1.000±0.050),在人TCC细胞系T24和BIU-87细胞中分别为(2.327±0.044)和(3.146±0.036),经方差分析,差异有统计学意义(F=3.895,P=0.027)。人TCC细胞系中ZNF267的表达水平高于人膀胱上皮永生化细胞。见图2。
2.2 ZNF267 siRNA在TCC细胞中的沉默效率
2.2.1 T24细胞 人膀胱癌细胞系T24中ZNF267-NC组的ZNF267 mRNA相对表达水平为(1.000±0.05),ZNF267 siRNA 组为(0.384±0.061),经t检验,差异有统计学意义(t=4.176,P=0.032),ZNF267-NC组高于ZNF267 siRNA组。见图3A。
2.2.2 BIU87细胞 人膀胱癌细胞系BIU87中ZNF267-NC组的ZNF267 mRNA相对表达水平为(1.000±0.05),ZNF267 siRNA 组为(0.417±0.031),经t检验,差异有统计学意义(t=3.175,P=0.038),ZNF267-NC组高于ZNF267 siRNA组。见图3B。
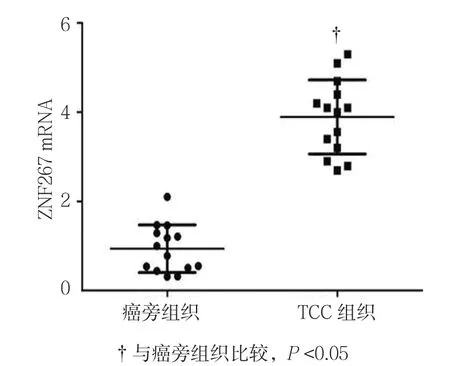
图1 ZNF267在人TCC组织中的表达
2.3 ZNF267对TCC细胞增殖的影响
2.3.1 T24细胞 转染ZNF267-NC和ZNF267 siRNA后第3天起,T24细胞中ZNF267 siRNA组的OD值为(0.517±0.061),ZNF267-NC组为(0.982±0.067),经t检验,差异有统计学意义(t=3.518,P=0.031),ZNF267 siRNA组低于ZNF267-NC组。见图4A。
2.3.2 BIU87细胞 转染ZNF267-NC和ZNF267 siRNA后3天起,BIU87细胞中ZNF267 siRNA组的OD值为(0.841±0.053),ZNF267-NC 组为(1.176±0.071),经t检验,差异有统计学意义(t=3.107,P=0.036),ZNF267 siRNA组低于ZNF267-NC组。见图4B。
2.4 ZNF267对TCC细胞凋亡的影响
2.4.1 T24细胞 ZNF267-NC组的T24细胞凋亡 率 为(1.713±0.232)%,ZNF267 siRNA组 为(8.153±2.348)%,经t检验,差异有统计学意义(t=4.416,P=0.021),ZNF267-NC组低于ZNF267 siRNA组。见图5A。
2.4.2 BIU87细胞 ZNF267-NC组的BIU87细胞凋亡率为(0.913±0.481)%,ZNF267 siRNA组为(11.329±3.591)%,经t检验,差异有统计学意义(t=6.461,P=0.016),ZNF267-NC组低于ZNF267 siRNA组。见图5B。
2.5 ZNF267对TCC细胞周期的影响
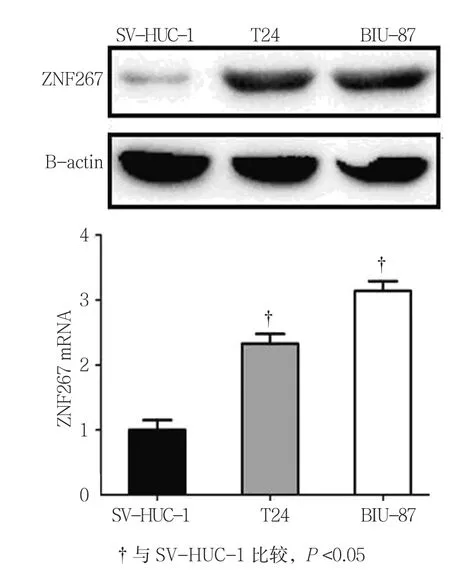
图2 ZNF267在人TCC细胞系中的表达

图3 ZNF267 siRNA在TCC细胞中的沉默效率

图4 ZNF267对TCC细胞增殖的影响
2.5.1 T24细胞 转染ZNF267-NC的T24细胞G1期细胞百分比为(41.164±3.247)%,转染ZNF267 siRNA为(56.838±3.546)%,经t检验,差异有统计学意义(t=5.147,P=0.027),ZNF267 siRNA组细胞周期与ZNF267-NC组比较,阻滞于G1期,细胞增殖受抑制。见图6A。
2.5.2 BIU87细胞 转染ZNF267-NC的BIU-87细胞G1期细胞百分比为(47.363±3.254)%,转染ZNF267 siRNA为(62.663±2.581)%,经t检验,差异有统计学意义(t=4.149,P=0.031),ZNF267 siRNA组细胞周期与ZNF267-NC组比较,阻滞于G1期,细胞增殖受抑制。见图6B。
2.6 ZNF267对TCC细胞转移能力的影响
2.6.1 T24细胞 ZNF267-NC组的T24细胞转移细胞增加(1.000±0.032) 倍,ZNF267 siRNA组为(0.353±0.083)倍,经t检验,差异有统计学意义(t=4.775,P=0.034),ZNF267-NC组高于ZNF267 siRNA组。见图7A。
2.6.2 BIU87细胞 ZNF267-NC组的BIU87细胞转移细胞增加(1.000±0.028)倍,ZNF267 siRNA组为(0.215±0.035)倍,经t检验,差异有统计学意义(t=6.648,P=0.018),ZNF267-NC组高于ZNF267 siRNA组。见图7B、C。
2.7 ZNF267对TCC细胞侵袭能力的影响
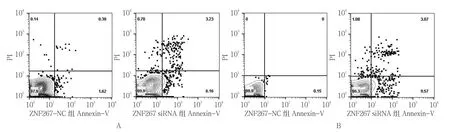
图5 ZNF267对TCC细胞凋亡的影响
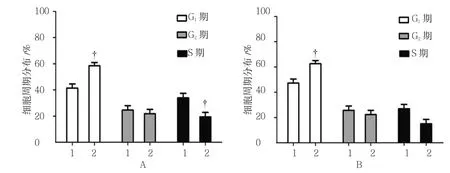
图6 ZNF267对TCC细胞周期的影响
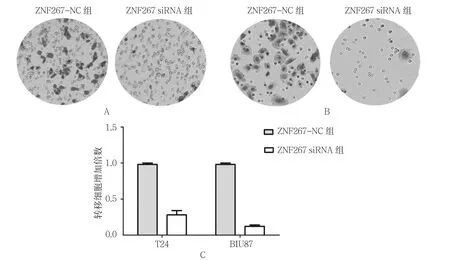
图7 ZNF267对TCC细胞转移的影响
2.7.1 T24细胞 ZNF267-NC组的T24细胞侵袭细胞增加(1.000±0.044) 倍,ZNF267 siRNA组为(0.321±0.931)倍,经t检验,差异有统计学意义(t=5.106,P=0.011),ZNF267-NC组高于ZNF267 siRNA组。见图8A。
2.7.2 BIU87细胞 ZNF267-NC组的BIU87细胞侵袭细胞增加(1.000±0.048)倍,ZNF267 siRNA组为(0.258±0.125)倍,经t检验,差异有统计学意义(t=5.451,P=0.008),ZNF267-NC组高于ZNF267 siRNA组。见图8B、C。
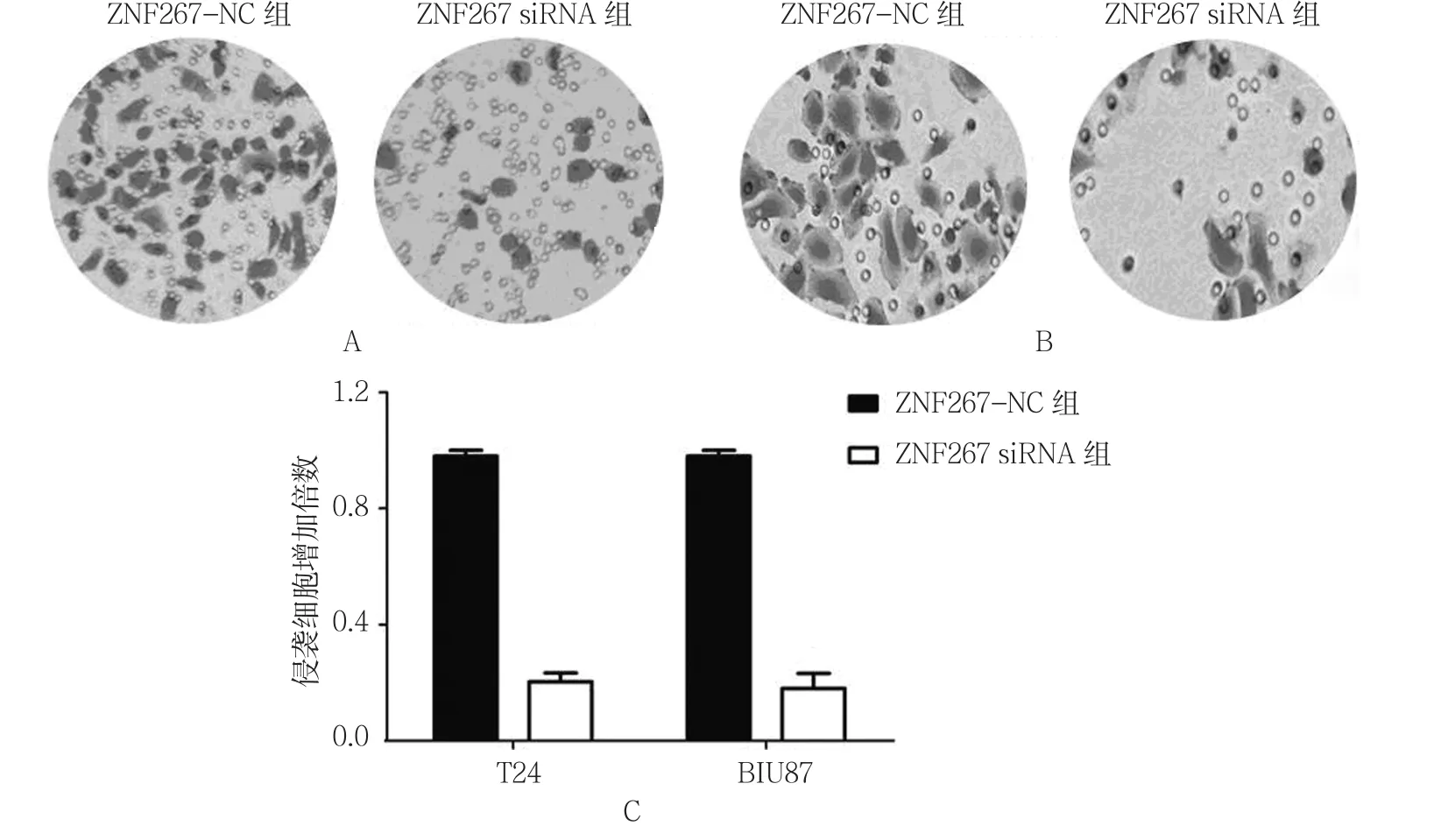
图8 ZNF267对TCC细胞侵袭的影响
3 讨论
ZNF267 Kruppel样锌指家族成员,其结构包括一个氨基酸末端的高度保守的Kruppel相关盒结构域,并通过连接区与锌指结构区分隔[7]。研究发现,一氧化氮NO治疗后,静脉内皮细胞中ZNF267 mRNA表达水平上调[8]。此外,在肝星状细胞活化过程及肝硬化组织中ZNF267的表达同样上调[5]。更为重要的是,研究证实ZNF267在肝细胞癌中表达上调,并可促进肿瘤细胞的增殖与转移[6]。然而,尚无研究阐明ZNF267在TCC中的表达及功能。本课题研究发现,ZNF267在TCC组织中的表达高于癌旁组织。细胞学实验结果显示,ZNF267在TCC细胞系中的表达亦高于永生化膀胱上皮细胞。利用RNA干涉技术沉默TCC细胞中ZNF267的表达后,TCC细胞增殖受抑制,而凋亡能力增强。研究还发现,沉默ZNF267在TCC中表达后,细胞周期被阻滞于G1期;细胞转移和侵袭能力也受到抑制。本研究首次阐明ZNF267在TCC组织及细胞中的表达及其对TCC细胞功能的影响。
既往研究显示,转录因子Ets-1为ZNF267的关键调控分子,可诱导ZNF267表达上调[6]。Ets-1可通过活化基质金属蛋白酶和尿激酶型溶酶原活化物等多种酶的转录,在多种肿瘤的发生、发展、侵袭及转移中发挥重要作用[9-11]。研究发现Ets-1在TCC组织中的表达高于癌旁组织,且特异性干涉Ets-1表达后,TCC的恶性表型受抑制。Ets-1在TCC的发生、发展中发挥促癌分子作用[12]。TCC中高表达的Ets-1转录因子可诱导ZNF267的表达上调,从而使ZNF267发挥促癌分子作用。ZNF267表达水平的另一调控机制为HIF-1α通过调控Ets-1而间接调控ZNF267的表达。研究显示,抑制Ets-1在肝细胞活性的重要调控分子缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)[13],则ZNF267在肝细胞癌中的表达亦降低。缺氧可提高肝细胞癌中HIF-1α的表达[14],并促进ZNF267的表达。在膀胱癌中,HIF-1α亚基与膀胱癌的分期、分级及转移潜能密切相关[15]。HIF-1α及葡萄糖转运蛋白1为膀胱癌预后的独立预测指标[16-17]。根据本研究结果,HIF-1α可能亦通过间接上调ZNF267的表达,而促进膀胱癌的发生、发展。ZNF267参与Ets-1和HIF-1α调控TCC发生、发展的分子机制仍需进一步研究。
本研究发现,ZNF267在膀胱癌组织及细胞中表达上调,沉默其表达后,细胞增殖、转移及侵袭受抑制,细胞凋亡增强,细胞周期被阻滞于G1期。本研究为阐明ZNF267在TCC发生、发展中的机制奠定了基础,为膀胱癌的治疗提供潜在可利用的分子靶点。
[1] SUN M, TRINH Q D. Diagnosis and staging of bladder cancer[J].Hematol Oncol Clin North Am, 2015, 29(2): 205-218.
[2] CZERNIAK B, DINNEY C, MCCONKEY D. Origins of Bladder Cancer[J]. Annu Rev Pathol, 2016, 11: 149-174.
[3] RESNICK M J, CHANG S S. Optimizing outcomes for octogenarians with invasive bladder cancer: one size does notfit all[J]. Urol Oncol, 2013, 31(1): 1-4.
[4] MCCONNELL B B, YANG V W. Mammalian kruppel-like factors in health and diseases[J]. Physiol Rev, 2010, 90(4): 1337-1381.
[5] SCHNABL B, HU K, MUHLBAUER M, et al. Zincfinger protein 267 is up-regulated during the activation process of human hepatic stellate cells and functions as a negative transcriptional regulator of MMP-10[J]. Biochem Biophys Res Commun, 2005, 335(1): 87-96.
[6] SCHNABL B, VALLETTA D, KIROVSKI G, et al. Zinc finger protein 267 is up-regulated in hepatocellular carcinoma and promotes tumor cell proliferation and migration[J]. Exp Mol Pathol, 2011, 91(3): 695-701.
[7] ABRINK M, AVESKOGH M, HELLMAN L. Isolation of cDNA clones for 42 different kruppel-related zinc finger proteins expressed in the human monoblast cell line U-937[J]. DNA Cell Biol, 1995, 14(2): 125-136.
[8] SCHAFER U, SCHNEIDER A, NEUGEBAUER E. Identification of a nitric oxide-regulated zinc finger containing transcription factor using motif-directed differential display[J]. Biochim Biophys Acta, 2000, 1494(3): 269-276.
[9] KEEHN C A, SMOLLER B R, MORGAN M B. Expression of the ets-1 proto-oncogene in melanocytic lesions[J]. Mod Pathol, 2003,16(8): 772-777.
[10] NAKAYAMA T, ITO M, OHTSURU A, et al. Expression of the ets-1 proto-oncogene in human colorectal carcinoma[J]. Mod Pathol, 2001, 14(5): 415-422.
[11] SAEKI H, KUWANO H, KAWAGUCHI H, et al. Expression of ets-1 transcription factor is correlated with penetrating tumor progression in patients with squamous cell carcinoma of the esophagus[J]. Cancer, 2000, 89(8): 1670-1676.
[12] LIU L, LIU Y, ZHANG X, et al. Inhibiting cell migration and cell invasion by silencing the transcription factor ETS-1 in human bladder cancer[J]. Oncotarget, 2016, 7(18): 25125-25134.
[13] MAEGDEFRAU U, AMANN T, WINKLMEIER A, et al. Bone morphogenetic protein 4 is induced in hepatocellular carcinoma by hypoxia and promotes tumour progression[J]. J Pathol, 2009,218(4): 520-529.
[14] AMANN T, MAEGDEFRAU U, HARTMANN A, et al. GLUT1 expression is increased in hepatocellular carcinoma and promotes tumorigenesis[J]. Am J Pathol, 2009, 174(4): 1544-1552.
[15] DENIZ H, KARAKOK M, YAGCI F, et al. Evaluation of relationship between HIF-1alpha immunoreactivity and stage,grade, angiogenic profile and proliferative index in bladder urothelial carcinomas[J]. Int Urol Nephrol, 2010, 42(1): 103-107.
[16] CHAI C Y, CHEN W T, HUNG W C, et al. Hypoxia-inducible factor-1alpha expression correlates with focal macrophage infiltration, angiogenesis and unfavourable prognosis in urothelial carcinoma[J]. J Clin Pathol, 2008, 61(5): 658-664.
[17] ORD J J, AGRAWAL S, THAMBOO T P, et al. An investigation into the prognostic significance of necrosis and hypoxia in high grade and invasive bladder cancer[J]. J Urol, 2007, 178(2): 677-682.
