微卫星状态与术后大肠癌患者的临床及病理特征相关性研究*
2018-03-16陈美丽李琳禹立霞刘宝瑞钱晓萍杨觅
陈美丽 李琳 禹立霞 刘宝瑞 钱晓萍 杨觅
目前,大肠癌在全球恶性肿瘤发病率中位居第3位[1],尽管其在中国人群中的发生率要低于西方国家,但近年来却在迅速增长[2]。在大肠癌中,存在微卫星不稳定性(microsatellite instability,MSI)。PCR方法为最早确立的检测MSI状态的分子手段[3],且被认为是临床上检测MSI的“金标准”,通过美国国家癌症研究所(NCI)推荐的BAT25、BAT26、D5S346、D2S123及D17S250等5个标准位点检测,比较肿瘤患者的样本组织和正常组织的位点突变状态判断微卫星状态,如果样本有2个及2个以上位点存在MSI状态则判断为高度微卫星不稳定(high-frequency MSI,MSI-H),如果有1个位点存在MSI状态则判断该患者为低度微卫星不稳定(low-frequency MSI,MSI-L),无位点存在MSI则判断为微卫星稳定状态(microsatellite stability,MSS)。
MSI状态被认为与结直肠癌患者的预后相关[4],且具有较为特殊的临床病理特征。有文献报道,中国发生在近端结肠和直肠的大肠癌患者中,MSI与MSS的大肠癌患者相比确诊分期更早,淋巴结转移率更低[5]。为进一步明确微卫星状态与大肠癌患者临床病理特征之间的关系,本研究采用PCR-毛细血管电泳法检测肠癌组织中微卫星状态,分析已确诊的大肠癌患者的微卫星状态与其临床资料、RAS突变情况及免疫组织化学检测指标MGMT、Lgr5、EGFR、Ki-67等的相关性。
1 材料与方法
1.1 病例资料
回顾性分析2014年6月至2017年6月在南京大学医学院附属鼓楼医院行肠癌切除手术的572例大肠癌患者,其中男性348例、女性224例。患者入组标准为:1)通过病理诊断确诊的结肠或直肠癌;2)术前未接受过抗肿瘤治疗;3)提供可用于分析的临床及病理资料,包括性别、年龄、家族史、病变部位、病理分期、分化程度、淋巴结、神经、脉管转移等。原位癌(高级上皮内瘤变)及大肠癌为第二原发性肿瘤的患者排除。入组患者以微卫星状态分为MSI-H组和MSS/MSI-L组。本研究由南京大学医学院附属鼓楼医院医学伦理委员会批准,所有参与者均提供书面知情同意书。
1.2 方法
1.2.1 PCR-毛细管电泳检测微卫星状态及RAS突变情况 选取肠癌组织蜡块进行切片脱蜡(以相应的正常组织为对照),显微镜下观察苏木素-伊红染色(H&E)切片,刮取肿瘤细胞丰富区,用DNA提取试剂盒(离心柱型)提取DNA,采用MSI检测试剂盒扩增肠癌组织中BAT25、BAT26、D5S346、D2S123及D17S250等5个标准位点的突变状态(图1),当癌组织存在2个及2个以上突变位点时判定为MSI-H,当仅存在1个位点突变时判定为MSI-L,无位点存在突变则判定为MSS。同时扩增KRAS基因第2、3、4外显子,NRAS第2、3外显子,产物直接纯化,进行DNA双向测序分析。以正常黏膜组织DNA为阴性对照,测试结果与NCBI标准序列对比,寻找突变位点。

图1 肠癌组织和相应的正常远癌切断组织的PCR-毛细血管电泳法检测NCI推荐的5个微卫星位点的检测结果
1.2.2 免疫组织化学检测Ki-67、EGFR、MGMT和Lgr5的表达情况 肠癌组织标本在10%中性福尔马林中固定24~48 h,常规脱水、固定、石蜡包埋、切片后用免疫组织化学法检测Ki-67、EGFR、MGMT及Lgr5。每张切片中含有的正常肠黏膜、炎症细胞等作为内对照,根据文献判读[6]免疫组织化学染色结果(图2)。计数5个高倍视野按染色强度打分:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色。再按阳性细胞所占的百分比打分:0分为阴性,1分为阳性细胞≤10%,2分为11%~50%,3分为51%~75%,4分为>75%。染色与阳性细胞百分比的评分乘积为最终分数,0判定为阴性,1~3判定为1+或弱阳性,4~7判定为2+或中度阳性,8~12判定为3+或强阳性。

图2 MGMT和EGFR在肠癌组织中的免疫组织化学表达情况(SP×100)
1.3 统计学分析
采用SPSS 18.0软件进行统计学分析。对各临床病理参数及微卫星表型之间的差异进行χ2检验或校正χ2检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 患者的临床特征
在572例大肠癌患者中(表1),男性348例、女性224例,MSS或MSI-L大肠癌中男性发病比例高于女性,MSI-H大肠癌中女性发病比例高于男性,差异无统计学意义。在发病年龄方面,本研究中确诊大肠癌的年龄为15~91岁,中位年龄64岁。在MSS/MSIL组中确诊大肠癌的年龄为15~91岁,中位年龄64岁;MSI-H组确诊大肠癌的年龄为33~88岁,中位年龄55岁。MSS/MSI-L大肠癌>55岁的病例明显高于MSI-H患者,差异无统计学意义。同时,本研究发现MSI-H大肠癌患者具有恶性肿瘤家族史的比例高于MSS/MSI-L患者(10.00%vs.5.64%),差异无统计学意义(P=0.436)。572例大肠癌病例中病变部位包括174例左半结肠、158例右半结肠、6例左半结肠和右半结肠同时存在病变、232例直肠及2例结肠和直肠同时存在病变的病例,MSI-H和MSS/MSI-L两组大肠癌在发病部位的构成比方面比较差异具有统计学意义(P<0.001),与MSI-H组相比,MSS/MSI-L组患者好发于直肠(229/532vs.3/40,43.0%vs.7.5%),而MSI-H组更好发于结肠(37/40vs.301/532,92.5%vs.56.6%),尤其是右半结肠(27/40vs.131/532,67.5%vs.24.6%)。

表1 大肠癌患者临床特征在不同微卫星状态中的比较
2.2 患者的病理资料分析
572例大肠癌患者中,包含286例Ⅰ/Ⅱ期及286例Ⅲ/Ⅳ期病例(表2),其中MSI-H大肠癌确诊时的TNM分期低于MSS/MSI-L大肠癌,差异具有统计学意义,但浸润肠壁的深度两组相似,未见显著性差异。在MSI-H大肠癌中淋巴结转移比例较MSS/MSIL低、形成癌结节的比例少,且差异均具有统计学意义。MSI-H的大肠癌脉管、神经受癌组织累及的比例较MSS/MSI-L低,而远处器官或组织受累的比例高,但均未见显著性差异。在分化程度和Ki-67方面比较两组未见显著性差异,在MSI-H和MSS/MSI-L两组大肠癌组织中,含黏液成分的分别占17.5%和8.5%,但两组间比较差异无统计学意义。

表2 大肠癌患者一般病理资料在不同微卫星状态中的比较
2.3 RAS突变及MGMT、Lgr5、EGFR免疫组织化学表达情况
本研究共检测了572例患者KRAS第2外显子的表达情况(表3),总突变率为44.1%,MSS/MSI-L组的KRAS第2密码子的突变率较MSI-H组高(45.7%vs. 22.5%,P=0.004)。随着近年来临床对全RAS基因检测的关注,本研究亦检测了其中261例患者的KRAS第3、4外显子的突变表达情况,总突变率分别为2.3%和4.6%,其中MSI-H病例的第3、4外显子突变率分别为5.0%、10.0%,MSI-L/MSS病例为2.1%、4.1%,差异无统计学意义。同时检测了572例患者NRAS第2、3外显子的突变情况,两个外显子的总突变率分别为1.0%和1.0%,NRAS第2外显子在MSS/MSI-L组突变率为1.1%,在MSI-H组中未见突变,与之相似,NRAS第3外显子在大肠癌中突变率也极低,在MSS/ MSI-L组突变率为1.1%,在MSI-H组中未见突变。
本研究检测了手术切除保留完整的557例大肠癌患者的EGFR、MGMT免疫组织化学表达情况和473例患者Lgr5的表达情况,结果显示EGFR、MGMT、Lgr5表达缺失情况在MSI-H和MSS/MSI-L两组中差异无统计学意义。
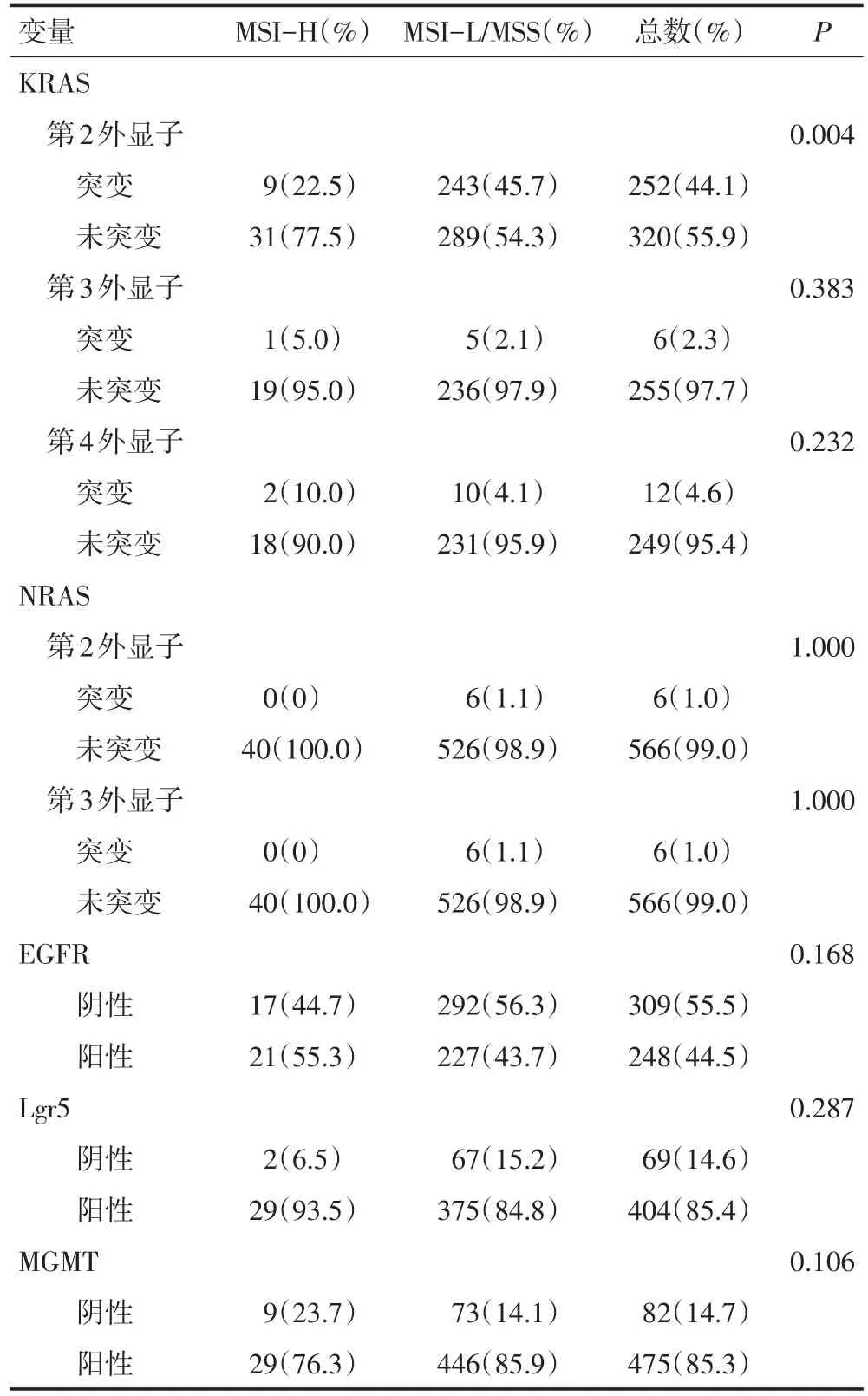
表3 RAS突变及MGMT、Lgr5、EGFR免疫组织化学表达情况
3 讨论
在中国,大肠癌的发病率和死亡率均在逐年上升,而在西方国家则是逐年降低的。MSI与大肠癌的发展、预后、疗效、遗传等均有相关性[7-14]。
目前,大肠癌男女发生病例约为1.3:1,本研究结果显示MSI-H组和MSS/MSI-L组在大肠癌男女分布比例上无显著性差异,而在年龄分布中存在显著性差异,MSS/MSI-L组的大肠癌患者发病年龄较大,且病灶常位于直肠,而MSI-H组的患者病灶多位于右半结肠,提示MSI可能参与了右半结肠癌的发生过程,提示左、右半结肠癌的发生机制在基因水平上可能是不同的,右半结肠癌的发生主要是通过复制错误引起肿瘤相关基因的突变,而左半结肠癌主要通过杂合性缺失引起癌基因和抑癌基因的突变[15]。
同时本研究也比较了微卫星状态和部分易造成大肠癌进展的危险因素之间的关系,以推测微卫星状态对大肠癌预后的影响。淋巴结转移和远处转移为大肠癌的主要转移途径,本研究结果提示MSI-H组较MSS/MSI-L组确诊分期早,受累淋巴结较少,且较少形成癌结节,上述结果差异具有统计学意义。推测MSI-H可能为大肠癌预后较好的因素之一。而对于另一些危险因素,如脉管、神经受累、分化程度、癌组织是否含有黏液成分、Ki-67及远处转移情况,两组间在发生上未见显著性差异,明确上述因素与肠癌预后的具体相关性,仍需进一步研究。
有研究显示,MSI状态对于抗PD-1免疫治疗具有指导意义,MSI-H组和MSS/MSI-L组显示出与免疫相关的RECIST客观反应率分别为40%、0,而两组20周时免疫相关无进展生存率分别为78%、11%,均具有显著性差异[16]。另一项正在进行的临床研究CheckMate142在探索接受尼鲁单抗联合伊匹单抗治疗的dMMR/MSI-H mCRC患者PD-L1表达及生物标志物与临床治疗效果的相关性分析中发现,存在MSI-H组的患者均能从免疫治疗当中获益。2017年美国默沙东公司研发的抗PD-1抗体KEYTRUDA的上市,也为带有MSI-H实体瘤患者的治疗带来了新的方向。而另一项临床试验[17]也提出,PD-L1抑制剂联合MEK抑制剂对于治疗MSS/dMMR的患者也存在显著疗效,客观缓解率和疾病控制率分别为17%和39%。可见临床上微卫星状态的检测能有效的评估免疫治疗在肿瘤治疗中的效益。而本研究结果发现,MSI-H多位于右半结肠,MSS多位于直肠和左半结肠,提示右半结肠癌患者更有可能从抗PD-1免疫治疗中获益,而直肠癌患者从PD-L1抑制剂联合MEK抑制剂的治疗中获益较大。
在分子层面上,本研究发现KRAS突变与MSI-H状态呈负相关,即KRAS第2外显子的突变率在MSIH大肠癌中明显低于MSS/MSI-L大肠癌,这与Lin等[18]的报道相同。同时,本课题组[19]的一项关于KRAS突变和MSI共存状态对中国大肠癌患者预后相关性研究中指出,同时具有KRAS突变和MSI状态的大肠癌患者较其他共存状态组有较好的预后,可见KRAS突变和MSI可作为预测大肠癌预后的指标联合使用。
MGMT为一种由207个氨基酸组成的含磷蛋白,用于修复烷化剂造成的DNA损伤,损伤修复后则MGMT表达缺失[20]。有研究表明,MGMT表达的缺失与MSI的发生和hMSH2的表达缺失呈正相关[21-23],且替莫唑胺等烷化剂对MGMT缺失的转移性大肠癌治疗效果较好[24-25],推测MSI-H组患者较MSS/MSI-L组更易从替莫唑胺治疗中获益。在本研究的免疫组织化学结果中,发现MSI-H组患者中MGMT表达缺失率高于MSS/MSI-L组(23.7%vs.14.1%),差异无统计学意义,这可能与本研究中MSI-H组发生率(7.0%)低于其他文献报道相关。Lgr5为一种结直肠肿瘤干细胞标志物,被证实与肠癌的发生发展密切相关[26]。而MSI也是肠癌发生的一条重要分子途径,本研究发现不同微卫星状态的Lgr5蛋白表达情况未见显著性差异,两条途径之间是否有交叉相互影响仍需进一步探讨。同时本研究还发现,EGFR在MSI-H组中的阳性表达率高于MSS/MSI-L组(55.3%vs. 43.7%),而KRAS和NRAS的突变率MSI-H组低于MSS/MSI-L组,推测在转移性大肠癌中,MSI-H组患者较MSS/MSI-L组更易在抗EGFR的治疗中获益,但这还需更多的临床数据进一步验证。
综上所述,在大肠癌中微卫星状态的检测对个体化免疫治疗具有重要意义,不同的微卫星状态具有其特异性的临床病理特征,微卫星状态联合其他分子检测和免疫组织化学指标对大肠癌的治疗和预后存在指导作用,同时减少治疗的盲目性,提高MSI肿瘤患者的生存期。
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J]. CA Cancer J Clin,2015,65(2):87-108.
[2] Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015 [J].CA Cancer J Clin,2016,66(2):115-132.
[3] Boland CR,Thibodeau SN,Hamilton SR,et al.A national cancer institute workshop on microsatellite instability for cancer detection and familial predisposition:development of international criteria for the determination of microsatellite instability in colorectal cancer[J].Cancer Res,1998,58(22):5248-5257.
[4] Guastadisegni C,Colafranceschi M,Ottini L,et al.Microsatellite instability as a marker of prognosis and response to therapy:a metaanalysis of colorectal cancer survival data[J].Eur J Cancer,2010,46 (15):2788-2798.
[5] Yan WY,Hu J,Xie L,et al.Prediction of biological behavior and prognosis of colorectal cancer patients by tumor MSI/MMR in the Chinese population[J].Oncol Targets ther,2016,9:7415-7424.
[6] 许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
[7] Collura A,Lagrange A,Svrcek M,et al.Patients with colorectal tumors with microsatellite instability and large deletions in HSP110 T17 have improved response to 5-fluorouracil-based chemotherapy [J].Gastroenterology,2014,146(2):401-411.
[8] Gandhi JS,Goswami M,Sharma A,et al.Clinical impact of mismatch repair protein testing on outcome of early staged colorectal carcinomas[J].J Gastrointest Cancer,2017.[Epub ahead of print]
[9] Goldstein J,Tran B,Ensor J,et al.Multicenter retrospective analysis of metastatic colorectal cancer(CRC)with high-level microsatellite instability(MSI-H)[J].Ann Oncol,2014,25(5):1032-1038.
[10]Mouradov D,Domingo E,Gibbs P,et al.Survival in stageⅡ/Ⅲcolorectal cancer is independently predicted by chromosomal and microsatellite instability,but not by specific driver mutations[J]. Am J Gastroenterol,2013,108(11):1785-1793.
[11]Pogue-Geile K,Yothers G,Taniyama Y,et al.Defective mismatch repair and benefit from bevacizumab for colon cancer:findings from NSABP C-08[J].J Natl Cancer Inst,2013,105(13):989-992.
[12]Shin US,Cho SS,Moon SM,et al.Is microsatellite instability really a good prognostic factor of colorectal cancer[J]?Ann Coloproctol, 2014,30(1):28-34.
[13]Yang L,Sun Y,Huang XE,et al.Carcinoma microsatellite instability status as a predictor of benefit from fluorouracil-based adjuvant chemotherapy for stageⅡrectal cancer[J].Asian Pac J Cancer prev, 2015,16(4):1545-1551.
[14]Zlobec I,Bihl MP,Schwarb H,et al.Clinicopathological and protein characterization of BRAF-and K-RAS-mutated colorectal cancer and implications for prognosis[J].Int J Cancer,2010,127(2):367-380.
[15]Kim H,Nam SW,Rhee H,et al.Different gene expression profiles between microsatellite instability-high and microsatellite stable colorectal carcinomas[J].Oncogene,2004,23(37):6218-6225.
[16]Le DT,Uram JN,Wang H,et al.PD-1 blockade in tumors with mismatch-repair deficiency[J].N Engl J Med,2015,372(26):2509.
[17]Desai J,Hong YS,Kim JE,et al.Efficacy and safety of cobimetinib(cobi) and atezolizumab(atezo)in an expanded phaseⅠb study of microsatellite-stable(MSS)metastatic colorectal cancer(mCRC)[J].Ann Oncol,2016,27(Suppl 6):149-206.
[18]Lin EI,Tseng LH,Gocke CD,et al.Mutational profiling of colorectal cancers with microsatellite instability[J].Oncotarget,2015,6(39): 42334-42344.
[19]Hu J,Yan WY,Xie L,et al.Coexistence of MSI with KRAS mutation is associated with worse prognosis in colorectal cancer[J].Medi,2016, 95(50):e5649.
[20]Gerson SL.MGMT:its role in cancer aetiology and cancer therapeutics[J].Nat Rev Cancer,2004,4(4):296-307.
[21]Svrcek M,Buhard O,Colas C,et al.Methylation tolerance due to an O6-methylguanine DNA methyltransferase(MGMT)field defect in the colonic mucosa:an initiating step in the development of mismatch repair-deficient colorectal cancers[J].Gut,2010,59(11):1516-1526.
[22]Zheng CG,Jin C,Ye LC,et al.Clinicopathological significance and potential drug target of O6-methylguanine-DNA methyltransferase in colorectal cancer:a meta-analysis[J].Tumour Biol,2015,36(8): 5839-5848.
[23]Lee KH,Lee JS,Nam JH,et al.Promoter methylation status of hMLH1,hMSH2,and MGMT genes in colorectal cancer associated with adenoma-carcinoma sequence[J].Langenbecks Arch Surg, 2011,396(7):1017-1026.
[24]Amatu A,Sartore-Bianchi A,Moutinho C,et al.Promoter CpG island hypermethylation of the DNA repair enzyme MGMT predicts clinical response to dacarbazine in a phaseⅡ study for metastatic colorectal cancer[J].Clin Cancer Res,2013,19(8):2265-2272.
[25]Shacham-Shmueli E,Beny A,Geva R,et al.Response to temozolomide in patients with metastatic colorectal cancer with loss of MGMT expression:a new approach in the era of personalized medicine [J]?J Clin Oncol,2011,29(10):e262-265.
[26]Cui G,Gang X,Li Z,et al.Temporal and spatial changes of cells positive for stem-like markers in different compartments and stages of human colorectal adenoma-carcinoma sequence[J].Oncotarget, 2017,8(28):45311-45322.
