胸部特殊孤立性纤维瘤的外科治疗*
2018-03-16卢礼卿张春芳程远大
卢礼卿 张春芳 程远大
胸部孤立性纤维瘤(solitary fibrous tumors,SFTs)临床上不常见,大多数的SFTs起源于胸膜,即胸膜SFT(solitary fibrous tumor of pleura,SFTPs),占胸膜源性肿瘤的5%,约80%来自脏层胸膜,20%来自壁层胸膜[1],也偶发生于肺、气管、生殖系统、腹腔、软组织和肌肉等处结缔组织,来自于肺实质的SFTs十分少见[2]。目前对于胸部一些特殊SFTs的外科治疗研究较少。因部分SFTs具有一定的特殊性,本研究旨在分享一些胸部特殊SFTs的临床诊治经验。
1 材料与方法
1.1 一般资料
回顾性分析中南大学湘雅医院从2009年1月至2017年5月收治的诊断为胸部SFTs的患者。共21例患者纳入研究,其中男性11例、女性10例,平均年龄48.3岁。肿瘤大小为3~30 cm,平均约14 cm,其中有7例肿瘤最大直径>20 cm,占33.3%。13例来源于胸膜(7例脏层胸膜、2例壁层胸膜、4例纵隔胸膜),8例来自胸部其他特殊部位,包括胸壁6例、肺1例、气管1例。相关临床资料具体见表1。

表1 21例胸腔孤立性纤维瘤的临床病理资料
1.2 手术方法
对于胸膜源性SFTs患者,术前需完善胸部增强CT和三维成像,了解肿瘤的血供及血运情况,术前充分备血。术中采用全麻、双腔气管插管,对于肿瘤直径>10 cm的患者,选择直接开放手术,肿瘤直径<10 cm的患者首选胸腔镜探查。手术以最大化完整切除肿瘤为原则,对于肺内SFTs术前需评估患者肺功能情况,选择胸腔镜下肺叶切除。
1例气管源性的特殊SFT,因肿瘤累及气管壁和周围脏器,无法完整切除,在全麻支气管镜的引导下插入小号的气管导管以保证通气,然后行气管镜下的行冷冻治疗,肿瘤行气管腔内的姑息性切除。
1.3 术后随访
所有患者术后均未接受其他辅助治疗,术后1个月常规随访,然后每半年随访1次,了解患者生存情况,并复查胸部CT了解肿瘤复发情况。
2 结果
2.1 手术情况
21例患者中,17例患者通过外科手术完整切除,2例行姑息性切除,1例因考虑肿瘤局部外侵和患者基础疾病而未行手术治疗,1例患者家属拒绝行手术治疗。接受手术的19例患者中,胸腔镜手术4例,开放手术11例,其中6例因肿瘤巨大而行分块切除(图1),胸腔镜中转开放手术3例(图2),支气管镜下介入治疗1例(图3)。2例未手术的患者,其中1例接受了CT引导下穿刺活检。所有患者术后均没有接受其他辅助治疗。

图1 术前胸部CT与术前后的胸片
2.2 病理结果
除病例8未获得病理诊断外,其余20例患者均病理学证实为SFT,其中7例(33.3%)为恶性,13例为良性,恶性SFTs中包括3例巨大SFTs和1例气管源性SFT。
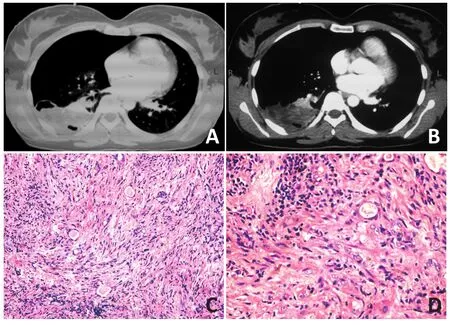
图2患者的胸部CT和术后的病检结果
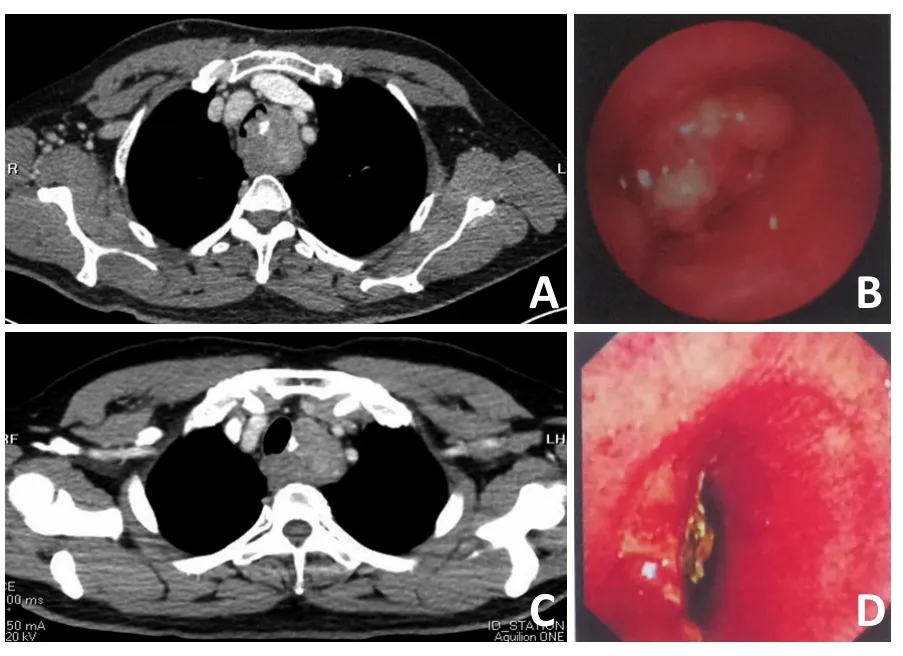
图3 患者治疗前的胸部CT与支气管镜检查、治疗后的胸部CT与支气管镜检查
2.3 随访
所有患者除了1例因联系方式变更失访外,其余20例随访1~96个月。随访结果中未手术患者死于心脏病,有3例恶性SFTs分别于术后第12、26、72个月复发,均接受了再次手术,其余病例均无复发和死亡。
3 讨论
SFTs特别是SFTPs是一种少见、生长缓慢的间叶组织肿瘤。SFTPs多见于50~70岁患者,无性别差异[3]。随着病理学水平的发展,SFTPs被证实是一种起源于CD34阳性的树突间叶细胞的肿瘤,并具有向纤维母细胞、肌纤维母细胞分化的特征,可发生在全身各部位。免疫组织化学法常提示CD34和Bcl-2呈阳性[4]。外科完整切除并切缘阴性是目前SFTPs的主要治疗方式,恶性SFTPs术后有一定的复发率,约30%[5]。本研究统计了21例SFTs患者,其中20例病理确诊为SFTs,包括13例SFTPs、6例胸壁来源和1例来源于气管。从统计结果看,SFTs恶性比例为35%(7/20),复发率为15%(3/20),其中复发的3例患者均为恶性SFTs,占恶性SFTs的42.9%,而良性SFTs中未出现复发情况。随访结果显示,术后无死亡病例,3例复发患者接受再次手术后均生存良好。国外研究显示胸部SFTs术后预后多良好,10年生存率可高达97.5%,无瘤生存率可达90.8%[6]。大多数SFTs呈良性特性,仅10%~15%的胸部SFTs可复发和或出现转移,因此,大多数学者认为SFTs是一种低度恶性,极少发生转移的肿瘤。
部分胸部SFTs具有一定的特殊性,临床较为少见,主要包括胸部巨大SFTs(>20 cm)、肺内SFTs及气管源性SFTs。虽然有报道采用胸腔镜下治疗SFTPs,显著缩短了SFTPs患者的住院时间和降低并发症的发生[7],但对于多大的肿瘤适合行胸腔镜手术,目前没有统一标准,一些学者提出肿瘤直径<8 cm适合胸腔镜手术[8]。对10 cm以下的肿瘤优先选择胸腔镜探查,但从统计结果可见,仅4例患者完成胸腔镜手术,3例中转开胸,主要原因是肿瘤血运丰富且瘤蒂较宽,腔镜下难以控制出血。
对于直径>20 cm的胸部SFTs,常因肿瘤巨大,术前无法明确评估其与周边脏器的关系,而使得手术难度增加。本研究收治的SFTs中有7例肿瘤最大径超过20 cm,均通过外科手术治疗。7例巨大SFTs中,4例良性、3例恶性。因肿瘤巨大,手术常难以一次性完整切除并取出。其经验是,选择后外侧切口,切除部分第5肋骨进胸,必要时可切除邻近的2根肋骨。从7例巨大SFTs手术经验来看,巨大SFTs往往瘤体血运一般,包膜完整但血运相对丰富,因此治疗策略是先打开包膜,肿瘤分块切除,然后再处理包膜与周边脏器的关系。对于部分有外侵的SFTs或肿瘤与周边脏器关系密切而无法完整切除的SFTs,行姑息性切除也是必要的。曾报道过2例巨大SFTs,肿瘤占据左侧整个胸腔,其中1例病变累及肺门,纵隔多发淋巴结肿大,左肺不张,左肺动脉瘤形成,因肿瘤血运丰富,无法分块切除,行肿块的姑息性切除和左全肺切除,术后病检为恶性SFTs,术后33个月随访患者情况良好,未见远处转移[9-10]。因胸部巨大SFTs的特殊性围术期应注意如下几点:1)术中肿瘤的血运及瘤蒂的情况;2)术中肿瘤对纵隔的压迫引起循环不稳定;3)肿瘤切除术后肺复张的问题,应评估肺复张的能力和避免术后复张性的肺水肿。
肺内SFTs多起自于大支气管或较大支气管的管壁或外周肺组织,临床常无症状,影像学检查是发现该病的重要手段[11]。1例因右侧自发性气胸就诊,胸部CT发现右侧气胸合并右下肺占位。肺内SFTs多表现为肺内孤立性单发结节或肿块,边界清楚,易误诊为肺部其他良性肿瘤如肺错构瘤、肺炎性假瘤等。外科完整切除是肺SFTs的最佳治疗手段,术后病理检查及免疫组织化学检测是确诊该疾病的重要手段。因肿瘤位于肺内,无明显包膜和瘤蒂,肿瘤以局部侵犯为主,罕有淋巴结或血行转移。随着胸腔镜技术的广泛应用,胸腔镜下肺叶切除是其标准的治疗术式。
SFTs可以起源于胸部的任何部位,但是通常起源于胸膜或者肺[4]。而气管源性的SFTs国内外鲜有报道,至今为止报道少于10例[12-14]。有学者报道了185例气管良性肿瘤中,仅有4例(2.2%)被证实为SFTs[15]。50%SFTs患者通常无症状,然而起源于呼吸道的SFTs可能会产生气道阻塞、阻塞性肺炎和呼吸困难等阻塞性症状[16]。该研究中肿瘤发生于气管,致使气道完全阻塞,患者主要表现为活动后气促,呼吸困难等临床症状。目前对于气管源性SFTs的治疗临床上研究较少,有学者报道支气管SFTs行内镜下肿块切除或者支气管袖式切除均获得很好的疗效[14]。本研究肿瘤病变累及气管的管腔内外,与周围组织界限不清,手术完整切除难度大,风险高,经过多学科讨论,最终为患者行内镜下肿瘤的姑息性切除,术后病检结果为低度恶性的SFTs。尽管有报道在未完整切除的SFTs患者术后行放疗,但是具体疗效还有待证实[12]。因SFTs对放化疗敏感性较差,该患者术后未推荐行辅助支持治疗,患者带瘤生存,术后随访42个月,状况良好,未出现其他部位转移,残余病灶未明显长大。因此,内镜下肿瘤切除是气管源性SFTs的一种治疗手段,但目前对于内镜下姑息性切除气管恶性SFTs的临床疗效及术后是否应该需要行辅助放化疗研究较少。鉴于SFTs的交界性生物学特性,对于内镜下无法完整切除的气管源性SFTs是否需要外科扩大切除有待更进一步的临床研究。
综上所述,胸腔SFTs少见,并且大部分是SFTPs,其最好的治疗方式是外科根治性切除。胸部特殊SFTs的外科处理有一定的特殊性,对于巨大肿瘤压迫导致一侧肺失去功能的患者,可考虑一并切除患肺;对于直径10 cm以下的肺内SFTs推荐行胸腔镜下肺叶切除;肿瘤巨大广泛侵袭或者气管源性SFTs无法根治性切除时,姑息性切除仍具有重要的治疗价值。
[1] Cardillo G,Facciolo F,Cavazzana AO,et al.Localized(solitary)fibrous tumors of the pleura:an analysis of 55 patients[J].Ann Thorac Surg,2000,70(6):1808-1812.
[2] Papathanassiou ZG,Alberghini M,Picci P,et al.Solitary fibrous tumors of the soft tissues:imaging features with histopathologic correlations[J].Clin Sarcoma Res,2013,3(1):1.
[3] Thorgeirsson T,Isaksson HJ,Hardardottir H,et al.Solitary fibrous tumors of the pleura:an estimation of population incidence[J]. Chest,2010,137(4):1005-1006.
[4] Gold JS,Antonescu CR,Hajdu C,et al.Clinicopathologic correlates of solitary fibrous tumors[J].Cancer,2002,94(4):1057-1068.
[5] Lococo F,Cesario A,Cardillo G,et al.Malignant solitary fibrous tumors of the pleura:retrospective review of a multicenter series[J]. J Thorac Oncol,2012,7(11):1698-1706.
[6] Cardillo G,Carbone L,Carleo F,et al.Solitary fibrous tumors of the pleura:an analysis of 110 patients treated in a single institution[J]. Ann Thorac Surg,2009,88(5):1632-1637.
[7] Takahama M,Kushibe K,Kawaquchi T,et al.Video-assisted thoracoscopic surgery is a promising treatment for solitary fibrous tumorof the pleura[J].Chest,2004,125(3):1144-1147.
[8] Liu J,Cai C,Wang D,et al.Video-assisted thoracoscopic surgery (VATS)for patients with solitary fibrous tumors of the pleura[J].J Thorac Oncol,2010,5(2):240-243.
[9] 程远大,高阳,张位星,等.胸膜巨大孤立性纤维瘤合并周围型肺动脉瘤1例[J].中国肺癌杂志,2015,18(8):523-525.
[10]程远大,张春芳,高阳,等.胸腔膈胸膜源性罕见巨大孤立性纤维瘤1例[J].中国肺癌杂志,2012,15(1):59-61.
[11]胡燕霞,柳毅,梅同华.肺孤立性纤维瘤合并胸腔积液1例[J].实用医学杂志,2014,30(18):2990.
[12]Oliveira CC,de Moraes MP,Colby T,et al.Endobronchial solitary fibrous tumor[J].Autops Case Rep,2016,6(4):35-40.
[13]Huang W,Xu X,Hu J,et al.Primary solitary fibrous tumor of the bronchus:a case report[J].Int J Clin Exp Pathol,2015,8(10):13596-13600.
[14]Liu Q,Wu XW,Li ZD,et al.Endobronchial Solitary Fibrous Tumor: Imaging and Bronchoscopic Findings[J].Chin Med J(Engl),2015, 128(19):2696.
[15]Shah H,Garbe L,Nussbaum E,et al.Benign tumors of the tracheobronchial tree.Endoscopic characteristics and role of laser resection[J].Chest,1995,107(6):1744-1751.
[16]Geramizadeh B,Banani A,Moradi A,et al.Intrapulmonary solitary fibrous tumor with bronchial involvement:A rare case report in a child[J].J Pediatr Surg,2010,45(1):249-251.
