血清IL-35水平变化与再生障碍性贫血免疫抑制治疗效果的关系
2018-03-15刘佳谢晓宝顾伟英李海乾凌云
刘佳,谢晓宝,顾伟英,李海乾,凌云
(常州市第一人民医院·苏州大学附属第三医院,江苏常州21300)
再生障碍性贫血(AA)是一种免疫介导的血液系统疾病,其特征在于骨髓造血衰竭和外周血细胞减少[1]。研究表明,免疫耐受缺失和骨髓干细胞过度凋亡可能在AA发病中起重要作用[2]。目前包含抗胸腺细胞球蛋白(ATG)和环孢菌素A(CsA)的免疫抑制治疗(IST)广泛应用于AA。AA患者IST的反应率为42%~74%,长期总生存率为90%[3]。患者对IST的反应差异明显,因此对IST反应的早期评估有重要意义。目前已经提出了几种预测因素和指标,如年龄、性别、诊断和治疗的时间间隔、白细胞计数、网织红细胞绝对值、中性粒细胞绝对值和淋巴细胞绝对值,但仍不能满足临床需要[4]。白细胞介素35(IL-35)是2007年首次发现的一种异二聚体细胞因子,在抗炎和免疫耐受过程中起关键作用[5]。目前,AA患者血清IL-35水平与对IST反应之间的关系尚未阐明。本研究对此进行了探讨。
1 资料与方法
1.1 临床资料 选择2013年6月~2016年10月本院收治的AA患者34例(AA组),男19例、女15例,年龄(25.0±3.6)岁,病因为特发性31例、肝炎相关性3例。纳入标准:符合国际研究组AA诊断标准;符合严重再生障碍性贫血(SAA)的诊断标准[6];缺乏合适的造血干细胞移植供者;既往未接受过IST。排除标准:发生阵发性夜间血红蛋白尿或Fanconi贫血;患有其他血液系统疾病或自身免疫性疾病;患有严重脓毒症或恶性肿瘤;最后1次采血前接受输血。同期选择体检健康者34例作为对照组,男18例、女16例,年龄(28.0±3.9)岁。两组性别、年龄有可比性。本研究经常州市第一人民医院伦理委员会批准,参与者均签署知情同意书。
1.2 IST AA组均给予输血、抗感染、保肝及对症支持治疗。给予抗胸腺细胞球蛋白(ATG)和环孢素A(CsA)进行IST。用药前行过敏试验,给予糖皮质激素和抗组胺类药物防止过敏。ATG(复宁)5 mg/(kg·d)经0.9%氯化钠注射液500 mL稀释后静脉滴注12~18 h,持续治疗5 d;口服CsA 6 mg/(kg·d),持续调整剂量,维持血清药物浓度为150~250 ng/mL。持续24周。
1.3 疗效评价标准 治疗24周评估患者对IST的反应[7],分为无反应(NR)、部分反应(PR)和完全反应(CR)。PR及CR为治疗有效,NR为治疗无效。
1.4 血清IL-35检测 AA组于入院时及治疗第28天[8]、对照组于体检时采集肘正中浅静脉血5 mL,离心(3 000 r/min、20 min),取血清于-80 ℃储存待检。用酶联免疫吸附法(ELISA试剂盒,Biolegend)测定血清IL-35;用ELISA试剂盒(博士德生物工程有限公司)测定血清干扰素γ(IFN-γ)和肿瘤坏死因子α(TNF-α)水平。
2 结果
2.1 AA组与对照组血清IL-35水平比较 对照组血清IL-35水平为(47.2±9.1)pg/mL;AA组治疗前、治疗第28天血清IL-35水平分别为(11.9±5.6)、(40.6±7.3)pg/mL。与对照组比较,治疗前AA组血清IL-35水平低(P<0.05);治疗后AA组血清IL-35水平较治疗前升高(P<0.05),与对照组比较差异无统计学意义(P>0.05)。
2.2 AA组血清IL-35水平与疗效的关系 治疗24周,有效20例(PR 15例、CR 5例),无效14例。根据治疗第28天血清IL-35水平[8]将患者分为IL-35水平升高(IL-35≥28.7 pg/mL)16例、未升高(<28.7 pg/mL)18例。IL-35水平升高者治疗有效7例(43.75%),未升高者治疗有效13例(81.25%),二者比较差异有统计学意义(P<0.05)。
2.3 AA组血清IL-35水平与IFN-γ、TNF-α水平的关系 治疗前IL-35水平升高与未升高患者的血清IFN-γ、TNF-α水平比较差异无统计学意义(P均>0.05);与治疗前比较,治疗第28天AA组血清IFN-γ、TNF-α水平均降低(P均<0.05)。治疗第28天IL-35水平升高者血清TNF-α较未升高者低,IFN-γ水平与未升高者比较差异无统计学意义(P>0.05)。见表1。
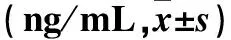
表1 AA组血清IL-35水平与IFN-γ、TNF-α水平的关系
3 讨论
AA是一种免疫介导的骨髓衰竭综合征,其确切发病机制尚不清楚,由异常免疫反应介导的造血破坏被认为是主要原因。近年来,已广泛研究了其免疫机制的异常,特别是T细胞免疫和异常细胞因子谱[9]。除了异常极化的T辅助细胞(Th1)和分泌过多抑制性造血因子的细胞毒性T细胞,循环调节性T细胞(Treg)数量减少、免疫抑制功能受损及Th17细胞数量增加也在AA的发病中起至关重要的作用[10,11]。
IL-35是IL-12家族的新成员,是由IL-12α亚基p35和IL-27β亚基EB病毒诱导的基因3组成的异二聚体细胞因子,是一种主要由Treg分泌、能阻止免疫应答过度反应的抑制性细胞因子。IL-35被认为是Tregs介导的免疫耐受的基本效应分子,不需要IL-10或转化生长因子β参与转化。更重要的是,IL-35在免疫反应中发挥不同的作用。IL-35可抑制常规T细胞的增殖和CD4+T细胞分化为Th1或Th17效应细胞,但促进Treg的增殖。此外,IL-35还可诱导CD4+T细胞生成具有抑制性的诱导型Treg(iTR35细胞)。
研究表明,AA患者血清IL-35水平降低导致免疫耐受缺失,同时也表明血清IL-35水平与疾病严重程度密切相关[12]。在炎症性肠病、原发性免疫性血小板减少症和系统性红斑狼疮中也发现了类似关系。然而,在系统性硬化症、类风湿关节炎和恶性肿瘤中,IL-35的血清水平意外升高,并在治疗后恢复正常[13]。因此,IL-35在这些疾病中的作用复杂。本研究中,AA组血清IL-35水平较健康对照组低,这与上述研究[12]结论一致。
Huang等[10]研究指出,在初始IST 28天,对IST有效反应的患者血清IL-35水平升高,而后升高的趋势变缓。因此,本研究治疗第28天检测血清IL-35水平。本研究显示,治疗第28天,患者血清IL-35水平恢复至正常水平,与治疗前相比明显升高;血清IL-35水平升高的AA患者其对IST的有效反应率升高。由此推断,血清IL-35水平变化与AA患者对IST的反应密切相关,可作为判断有效性的预测因子。原因可能为IST通过升高AA患者血清IL-35水平,抑制细胞毒性T细胞的过度增殖及CD4+T细胞分化为Th1或Th17效应细胞;促进Tregs增殖,通过其介导的免疫耐受途径发挥免疫抑制作用。另外,iTR35细胞作为IL-35诱导生成的具有抑制性的诱导型Treg,进一步发挥强大且稳定的抑制作用。
AA的病理生理过程中,分泌过多抑制性造血因子,如TNF-α和IFN-γ。IL-35可抑制Th1型细胞因子如IFN-γ、TNF-α、IL-2及Th17型细胞因子的产生。而且TNF-α也是一种参与调控凋亡过程的细胞因子,在AA的骨髓干细胞凋亡过程中发挥重要作用。因此,本研究以IFN-γ、TNF-α作为常见的造血负调控因子。IST后两种细胞因子水平均下降,说明IST对AA的机制之一为通过抑制造血负调控因子发挥作用,预示着造血功能的改善;而IL-35升高者TNF-α水平下降更明显,说明抑制凋亡可能也是治疗后血清IL-35水平与对IST反应的桥梁,具体机制可能与凋亡相关的膜表面分子Fas及其配体FasL相关,需进行更深入的研究。
总之,本研究显示IST后血清IL-35恢复至正常水平,可作为AA患者对IST有效反应的预测因子。
[1] Heimpel H. When should the clinician suspect a druginduced blood dyscrasia, and how should he proceed[J]. Eur J Haematol Suppl, 1996,60(Suppl):11-15.
[2] Yu W, Ge M, Lu S, et al. Anti-inflammatory effects of interleukin-35 in acquired aplastic anemia[J]. Cytokine, 2015,76(2):409-416.
[3] Jeong DC, Chung NG, Cho B, et al. Long-term outcome after immunosuppressive therapy with horse or rabbit antithymocyte globulin and cyclosporine for severe aplastic anemia in children[J]. Haematologica, 2014,99(4):664-671.
[4] Yoshida N, Yagasaki H, Hama A, et al. Predicting response to immunosuppressive therapy in childhood aplastic anemia[J]. Haematologica, 2011,96(5):771-774.
[5] Chaturvedi V, Collison LW, Guy CS, et al. Cutting edge: human regulatory T cells require IL-35 to mediate suppression and infectious tolerance[J]. J Immunol, 2011,186(12):6661-6666.
[6] Marsh JC, Ball SE, Cavenagh J, et al. Guidelines for the diagnosis and management of aplastic anaemia[J]. Br J Haematol, 2009,147(1):43-70.
[7] Camitta BM. What is the definition of cure for aplastic anemia[J]. Acta Haematol, 2000,103(1):16-18.
[8] Huang Z, Tong HF, Li Y, et al. Post-therapeutic recovery of serum interleukin-35 level might predict positive response to immunosuppressive therapy in pediatric aplastic anemia[J]. Hematology, 2017,22(7):430-436.
[9] 沈红石,陈海飞,任传路,等,T-bet、GATA-3、FoxP3及CD4+CD25+调节性T细胞在AA发病机制中的作用[J].山东医药,2013,53(4):8-11.
[10] Shi J, Ge M, Lu S, et al. Intrinsic impairment of CD4+CD25+regulatory T cells in acquired aplastic anemia[J]. Blood, 2012,120 (8):1624-1632.
[11] 王西阁,王丹凤,周玉洁,等.慢性再生障碍性贫血患儿血清IL-17、IL-23的变化及临床意义[J].山东医药,2012,52(45):58-60.
[12] Yu W, Ge M, Lu S, et al. Anti-inflammatory effects of interleukin-35 in acquired aplastic anemia[J]. Cytokine, 2015,76(2):409-416.
