Bmi-1基因沉默对鼻咽癌细胞CNE2生物学行为的影响
2018-03-15王巧罗清李亚军邹彦
王巧,罗清,李亚军,3,邹彦
(1贵州省人民医院,贵阳550002;2遵义医学院附属肿瘤医院;3遵义医学院第三附属医院)
鼻咽癌(NPC)是我国常见的恶性肿瘤,好发于鼻咽部咽隐窝和顶前壁,在我国南部及东南亚具有较高的发病率[1,2]。放疗和化疗是NPC主要的治疗手段,然而,仍有约20%的患者在治疗后出现局部复发和远处转移,导致Ⅲ~Ⅳ期NPC患者的5年生存率仅为10%~40%[3]。因此,寻求更高效、安全的治疗方法是临床关注的重点。Bmi-1是多梳基因家族(PcG)的重要成员,在乳腺癌、结直肠癌、非小细胞肺癌等多种实体瘤组织中高表达[4~6],参与肿瘤发生、发展的多个生物学行为,如细胞增殖、侵袭及凋亡、肿瘤发生及干细胞的自我更新和分化[7]。研究发现,Bmi-1在癌组织中的表达水平与肿瘤形成、疾病进展、侵袭与转移及疾病不良预后密切相关[8,9]。2014年10月~2016年3月,本研究用shRNA慢病毒特异性沉默NPC的CNE2细胞内Bmi-1基因表达,探讨其对细胞增殖、凋亡等生物学行为的影响,为NPC的分子靶向治疗提供依据。
1 材料与方法
1.1 细胞及试剂 人胚肾上皮细胞(293T)购买于昆明细胞库,人NPC细胞株(CNE2)由广州中山医科大学培养,慢病毒载体PLVx-shRNA2、PLP1、PLP2、PLP/VSVG购于长沙赢润生物技术公司,LipofectamineTM2000购于上海英潍捷基贸易有限公司,PrimeScriptTMRT reagent Kit、SYBR®Premix Ex TaqTMⅡ试剂盒购于TaKaRa,兔抗人Bmi-1多克隆抗体购于英国Abcam公司,二抗-山羊抗兔、内参β-actin购于北京中杉金桥生物技术有限公司。
1.2 PLVx-shRNA2-Bmi-1重组载体的构建 查找Bmi-1(NM=005180)在GeneBank中的mRNA核苷酸链,根据shRNA设计原则,设计3条不同的shRNA干扰片段,分别设计酶切位点:EcoRI、BamHI,引物合成由上海生工生物公司完成。shRNA1的F序列:ATCCGGAATGGTCCACTTCCATTGATCAAGAGT-
CAATGGAAGTGGACCATTCCTTTTTTG;shRNA2的F序列:GATCCGGGTCATCAGCAACTTCTTCTTCAAG-
AGAGAAGAAGTTGCTGATGGACCCTTT;shRNA3的F序列:GATCCGCCAATGGCTCTAATGAAGATTTCA-AGAGAATTTCATTAGAGCCATTGGCTTTTTTG。
1.3 慢病毒包装、浓缩及滴定 将PLVx-shRNA2、PLP1、PLP2、PLP/VSVG按照TIANGEN(DP106)进行质粒提取,轻柔加入LipofectamineTM2000与各质粒DNA混合液,共转染处于对数生长期293T细胞,常规培养过夜,上述培养条件孵育48 h收集细胞上清液,于4 ℃、3 000 g、离心20 min,加入Lenti-XTM concentrator获得病毒浓缩液。采用孔稀释法测定病毒滴度,将病毒原液按10倍梯度稀释。取10个无菌的EP管,每个管中加入无血清培养基90 μL,取待测的病毒原液10 μL 加入第1个管,混匀,取 10 μL加入第2个管,继续相同操作至最后一管。各管分别取10 μL 加入各孔293T细胞,荧光显微镜下观察细胞绿色荧光蛋白表达情况,计算病毒滴度,病毒滴度(TU/mL)=表达荧光细胞数/病毒原液量。
1.4 CNE2细胞感染及最佳沉默效率筛选 采用含10%胎牛血清的培养基培养CNE2细胞,常规换液传代。取出病毒液,浓度进行梯度稀释,使其感染复数(MOI)分别为100、10、1。加入Polybrene储液1 μL,37 ℃、5% CO2培养箱中孵育30 min。感染48 h后观察绿色荧光蛋白(GFP)表达情况,当GFP大于80%用于后续实验,此时MOI为最佳。选取MOI=100用于后续实验感染CNE2细胞。将CNE2细胞随机分为5组,对照组不进行感染,shRNA1、2、3组分别感染表达shRNA1、2、3的慢病毒,空载体组感染空载的慢病毒。感染48 h后用TRIzol法提取细胞总RNA,根据试剂盒说明书将RNA逆转录为cDNA,进行实时荧光定量PCR反应,读取Ct值,应用2-ΔΔCt法计算Bmi-1基因的相对表达量。提取细胞总蛋白,采用BCA法测定蛋白浓度,电泳分离蛋白,湿转法将蛋白转移至PVDF膜,5%脱脂奶粉常温封闭1 h,根据说明书用TBST液稀释一抗(Bmi-1 1∶1 000,β-actin 1∶3 000),4 ℃孵育过夜,次日TBST液洗膜3次,每次5 min;同样方法稀释二抗(1∶4 000),室温孵育2 h后进行ECL显色,凝胶图像分析系统成像,Image J软件测出目的条带的灰度值,计算Bmi-1蛋白相对表达量。根据RT-PCR及Western blotting法检测结果,筛选沉默Bmi-1的最佳干扰序列。
1.5 Bmi-1基因沉默后CNE2细胞增殖能力检测 采用平板克隆形成实验。感染48 h后收集各组细胞,接种于6孔板,400个/孔,37 ℃、5% CO2环境中培养,根据细胞生长情况换液,培养2周或肉眼可见克隆斑时,4%甲醛固定细胞15 min;PBS清洗3次,结晶紫染色20 min,PBS洗净后晾干,拍照,计数细胞。
1.6 Bmi-1基因沉默后CNE2细胞凋亡和周期检测 采用流式细胞术。感染48 h后收集各组细胞,常规培养,胰酶消化,用培养基重悬细胞。加入1×BindingBuffer 400 L轻柔重悬细胞沉淀。移取AV-FITC(暗室操作)5 μL,混匀后室温暗室孵育15 min。移取PI 10 μL,混匀后暗室中放在冰上5 min,30 min内上机检测细胞凋亡比例。细胞周期样品制备(同细胞凋亡),用冷却的70%乙醇1 000 μL混匀细胞,沉淀,置于4 ℃冰箱2 h以上,1 000 g离心5 min,换PBS重复上述步骤。加入PI 500 μL,轻柔吹打细胞,置37 ℃暗室,检测各期细胞比例。
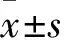
2 结果
2.1 PLVx-shRNA2-Bmi-1重组质粒测序鉴定结果 将构建的PLVx-shRNA2-Bmi-1进行序列分析,结果显示:插入的序列与设计的3条shRNA序列碱基排列一致,说明目的片段均已正确插入,PLVx-shRNA2-Bmi-1慢病毒表达载体构建成功。
2.2 Bmi-1-shRNA的沉默效率 对照组、空载体组及Bmi-1-shRNA1、2、3组中Bmi-1 mRNA相对表达量分别为1.00±0.00、0.98±0.01、0.45±0.03、0.17±0.01、0.14±0.01。与其他两组比较,Bmi-1-shRNA1、2、3组Bmi-1 mRNA相对表达量低(P均<0.05),Bmi-1-shRNA3组最低(P均<0.05),Bmi-1-shRNA3的抑制效率=(1-0.14)/1×100%=86.00%。对照组、空载体组及Bmi-1-shRNA1、2、3组中Bmi-1蛋白相对表达量分别为0.89±0.02、0.86±0.04、0.67±0.01、0.54±0.05、0.36±0.04,与其他两组比较,Bmi-1-shRNA1、2、3组Bmi-1蛋白相对表达量低(P均<0.05),Bmi-1-shRNA3组最低(P均<0.05)。
2.3 沉默Bmi-1基因对CNE2细胞增殖的影响 空载体组、Bmi-1-shRNA3组中细胞克隆形成数目,分别为(271.67±18.77)、(203.3±20.21)个/视野,与空载体组比较,Bmi-1-shRNA3组增殖能力弱(P均<0.05)。
2.4 沉默Bmi-1基因对CNE2细胞凋亡的影响 空载体组、Bmi-1-shRNA3组中细胞凋亡率分别为10.00%±0.40%、 12.97%±0.72%,与空载体组比较,Bmi-1-shRNA3组细胞凋亡率高(P均<0.05)。
2.5 沉默Bmi-1基因对CNE2细胞周期的影响 空载体组、Bmi-1-shRNA3组中G1期细胞比例分别为45.57%±10.34%、67.98%±7.85%,S期细胞比例分别为38.62%±6.12%、24.74%±5.58%,与空载体组比较,Bmi-1-shRNA3组G1期细胞比例高,S期细胞比例低(P均<0.05)。
3 讨论
放疗和化疗是NPC主要的治疗手段,然而,由于NPC解剖部位的特殊性及早期临床症状不明显,导致大部分患者在就诊时已是局部晚期或远处转移,致使NPC 5年生存率低,临床预后差[10]。Bmi-1基因最早在鼠淋巴瘤细胞中发现[11],是PcG家庭的重要成员。PcG家族是由多种与细胞周期和增殖相关的转录抑制因子组成,是一类重要的与发育相关的基因,在干细胞的维持、胚胎发育和肿瘤发生中有着不可忽视的作用。研究发现,Bmi-1基因在癌组织中的表达高低与肿瘤形成、疾病进展、侵袭与转移、疾病不良预后密切相关[8,9]。
目前,有关Bmi-1基因在NPC中的研究国内外报道甚少。为了研究沉默Bmi-1基因对NPC细胞生物学行为的影响,为NPC的分子靶向治疗提供实验依据,本研究采用RNAi感染技术,构建慢病毒表达载体特异性沉默Bmi-1基因。该技术可特异性剔除或关闭特定基因的表达,抑制靶点基因。与腺病毒系统、逆转录表达系统相比,慢病毒载体系统具有持久、稳定地表达外源基因的优点。因此,本研究选取了慢病毒“四质粒”系统进行病毒包装,即慢病毒表达载体(PLVx-shRNA2)、包装载体(PLP1、PLP2、PLP/VSVG)、脂质体2000共转染293T细胞。镜下观察到293T持续表达荧光,与Xu等[12]的研究结果一致,说明PLVx-shRNA2-Bmi-1重组载体已成功感染293T细胞。
Liu等[13]研究发现,RNAi干扰技术可抑制Bmi-1基因在乳腺癌MCF-7细胞的表达,其抑制率可达80%。本研究为获得沉默Bmi-1基因最佳的干扰片段,设计并合成了3条针对Bmi-1基因的shRNA1、2、3片段,检测结果显示,shRNA1、2、3对Bmi-1均有不同程度的抑制,其中shRNA3的抑制效果最佳,抑制效率约为86%。由于慢病毒载体感染对宿主细胞有一定程度的细胞毒性,在感染前需摸索慢病毒的最佳MOI值,本研究结果显示,当MOI=100时,CNE2细胞的感染效率为80%以上。
研究指出,作为INK4a/ARF基因的转录抑制位点,Bmi-1主要通过编码p16INK4a和p14ARF(动物为p19ARF)两个肿瘤抑制蛋白进行调控。P16INK4a能够抑制细胞周期蛋白依赖性激酶的活性,通过CyclinD-CDK4/6-pRb-E2F使细胞停滞于G0/G1期,无法进入S期。P14ARF则通过MDM2-P53通路来调控细胞周期,进而达到调控细胞周期、细胞凋亡以及维持肿瘤干细胞自我更新能力的目的[14,15]。降低Bmi-1基因在宫颈癌细胞中的表达会导致G1期细胞比例增加。本研究结果证实,沉默Bmi-1基因后,转染组细胞凋亡率升高,G1期细胞比例增加。Zhou等[16]研究指出,沉默Bmi-1基因能抑制ECA109细胞的增殖能力。本研究结果显示,沉默Bmi-1基因后,转染组克隆形成数减少,增殖能力受到抑制。
综上所述,本研究成功完成了慢病毒重组载体PLVx-shRNA2-Bmi-1的构建,筛选并获得了沉默Bmi-1效果最佳的干扰片段(Bmi-1-shRNA3),证实了Bmi-1基因表达降低可抑制CNE2细胞增殖,促进其凋亡,改变细胞周期。这可能为NPC的分子靶向治疗提供实验依据。
[1] Guo Z, Wang Y, Yang J, et al. KAI1 overexpression promotes apoptosis and inhibits proliferation, cell cycle, migration, and invasion in nasopharyngeal carcinoma cells[J]. Am J Otolaryngol, 2017,38(5):511-517.
[2] Tang LL, Chen WQ, Xue WQ, et al. Global trends in incidence and mortality of nasopharyngeal carcinoma[J]. Cancer Lett, 2016,374(1):22-30.
[3] Li Z, Cao R, Wang M, et al. Structure of a Bmi-1-Ring1B polycomb group ubiquitin ligase complex[J]. J Biol Chem, 2006,281(29):20643-20649.
[4] Yuan W, Yuan Y, Zhang T, et al. Role of Bmi-1 in regulation of ionizing irradiation-induced epithelial-mesenchymal transition and migration of breast cancer cells[J]. PLoS One, 2015,10(3):e0118799.
[5] Zhang X, Yang X, Zhang Y, et al. Direct serum assay for cell-free bmi-1 mRNA and its potential diagnostic and prognostic value forcolorectal cancer[J]. Clin Cancer Res, 2015,21(5):1225-1233.
[6] Xiong D, Ye Y, Fu Y, et al. Bmi-1 expression modulates non-small cell lung cancer progression[J]. Cancer Biol Ther, 2015,16(5):756-763.
[7] Ismail IH, Andrin C, McDonald D, et al. BMI1-mediated histone ubiquitylation promotes DNA double-strand break repair[J]. J Cell Biol, 2010,191(1):45-60.
[8] Zhang X, Yang X, Zhang Y, et al. Direct serum assay for cell-free bmi-1 mRNA and its potential diagnostic and prognostic value forcolorectal cancer[J]. Clin Cancer Res, 2015,21(5):1225-1233.
[9] Xiong D, Ye Y, Fu Y, et al. Bmi-1 expression modulates non-small cell lung cancer progression[J]. Cancer Biol Ther, 2015,16(5):756-763.
[10] Hu H, Wang G, Li C. miR-124 suppresses proliferation and invasion of nasopharyngeal carcinoma cells through the Wnt/β-catenin signaling pathway by targeting Capn4[J]. Onco Targets Ther, 2017, 10:2711.
[11] Xin T, Zhang FB, Sui GJ, et al. Bmi-1 siRNA inhibited ovarian cancer cell line growth and decreased telomerase activity[J]. Br J Biomed Sci, 2012,69(2):62-66.
[12] Xu ZZ, Wu SQ, Zhan R. Establishment of a U266 cell line with stable Bmi-1 silencing by lentivirus-mediated RNA interference[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2012,20(2):473-477.
[13] Liu L, Li H, Zhang M, et al. Effects of targeted nano-delivery systems combined with hTERT-siRNA and Bmi-1-siRNA on MCF-7 cells[J]. Int J Clin Exp Pathol, 2015,8(6):6674-6682.
[14] DiMauro T, Cantor DJ, Bainor AJ, et al. Transcriptional repression of Sin3B by Bmi-1 prevents cellular senescence and is relieved by oncogene activation[J]. Oncogene, 2015,34(30):4011-4017.
[15] Sedassari BT, Rodrigues MF, Mariano FV, et al. The stem cell marker bmi-1 is sensitive in identifying early lesions of carcinoma ex pleomorphic adenoma[J]. Medicine (Baltimore), 2015,94(27):e1035.
[16] Zhou M, Geng SM. Construction of shRNA-Bmi-1 plasmid and its effect on proliferation of ECA109 cells[J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao, 2015,37(1):17-22.
