sFlt-1,PlGF和多普勒超声在预测子痫前期的价值分析
2018-03-15赵继华魏艳会
赵继华 魏艳会 郭 莉*
1. 陕西省澄城县医院(715200);2. 陕西省核工业215医院
子痫前期(PE)主要由于胎盘发育异常,出现血管内层功能障碍和血管痉挛等特征[1]。世界卫生组织报告,每年有超过100 000人因此而死亡,且在发展中国家居多[2]。因此,准确预测和快速诊断子痫前期对于妊娠期妇女具有非常重要的意义[3]。目前,对子痫前期的发病机理仍未明确,主要认为胎盘发育过程出现不良状况,而胎盘的细胞因子是影响胎盘正常发育的重要因素[4-5]。有学者对中国女性进行临床研究,发现妊娠早期血清胎盘生长因子(P1GF)含量较低的妇女发展为子痫前期的比例较高,血清可溶性络氨酸激酶受体1(sFlt1-1)的含量无统计学意义[6]。多普勒超声是临床上预测子痫前期的重要手段,预测敏感性和特异性较高。目前为止,对中国子痫前期高危人群妊娠期,探索各类标志物诊断效能的研究仍存在较大的空缺。本研究选择可能罹患子痫前期高危孕妇,探讨sFlt1,PlGF和sFlt-1/PlGF值以及多普勒超声检测在子痫前期诊断中的临床价值。
1 对象和方法
1.1 研究对象
选取本院2012年1月-2015年12月就诊于妇产科的妊娠期妇女进行前瞻性研究。纳入标准:自妊娠20周至分娩均在本院进行检查和治疗的孕妇;孕龄>20周,合并妊娠期高血压或有子痫前期病史、子痫前期家族史、头痛、上腹痛、糖尿病等可能引起子痫前期的特征之一。排除标准:患有慢性高血压、前置胎盘、羊水过少、胎盘早剥、脑卒中、染色体异常以及肾功能不全等合并症。本研究经本院伦理道德委员会审核批准通过,所有研究对象或家属知情并同意参与本研究。
1.2 分组
符合纳入标准孕妇测定其血压和尿蛋白浓度,依照血压和尿蛋白浓度分组:第1组正常孕妇,指妊娠期血压和尿蛋白浓度正常的孕妇;第2组妊娠期高血压孕妇,指妊娠期仅血压异常的孕妇;第3组轻度子痫前期孕妇,指妊娠期收缩压140~160mmHg(1mmHg=0.133kPa)和(或)舒张压9~110mmHg,且尿蛋白浓度异常的孕妇;第4组重度子痫前期孕妇,指妊娠期收缩压≥160mmHg,和(或)舒张压≥110mmHg,且尿蛋白浓度异常的孕妇。
1.3 检测方法
在妊娠20~28周,抽取外周静脉血5ml,室温保存1h后离心,取上清,-80℃冷藏待测。按酶联反应吸附试验试剂盒(武汉博士德公司)操作说明书操作,检测样本中sFlt-1、PlGF的浓度,所有样品均在同一实验室同一次实验中完成。 多普勒超声测定孕妇子宫动脉搏动指数(PI),使用百盛公司AU-4000和GE公司的system five超声诊断仪,探头频率3.5~5.0MHz。
1.4 观察指标
①血压:妊娠期20周后每月测量1次,每次测量2次,间隔6h,取平均值;②收缩压≥140mmHg和(或)舒张压≥90mmHg为异常; ③尿蛋白含量:妊娠期20周后每月测量1次,≥0.3g/24h为异常;④血管生成因子:sFlt-1,PlGF,sFlt-1/PlGF;⑤PI:在妊娠20~24周,利用多普勒超声选取连续3个稳定且形态相近的子宫动脉血流频谱。
1.5 统计学处理
采用SPSS 18.0软件统计分析数据。分类数据采用频数和百分比表示,使用卡方检验比较组间差异;采用独立样本t检验比较正常孕妇与子痫前期患者的血管生成因子sFlt-1,PlGF,sFlt-1/PlGF值和PI值的差异;基于Spearman相关分析,探索子痫前期的严重程度和各因子的相关关系,利用受试者工作特征曲线(ROC曲线)和logistic回归分析,评估sFlt-1,PlGF和sFlt-1/PlGF值以及多普勒超声检测对子痫前期的诊断效能。以P<0.05(双侧)为差异有统计学意义。
2 结果
2.1 一般情况
纳入对象527例,孕周(32.1±1.8)周,年龄(27.3±4.9)岁。第1组276例,第2组72例,第3组52例,第4组127例。子痫前期共计179例。
2.2 子痫前期严重程度与各检测值相关性
sFlt-1、PlGF,sFlt-1/PlGF以及PI值与孕妇子痫前期的严重程度存在相关性(r=0.46,P<0.01;r=-0.36,P<0.01;r=0.49,P<0.01;r=0.11,P<0.05)。其中sFlt-1、sFlt-1/PlGF和PI值与子痫前期严重程度呈正相关关系,而PlGF含量与子痫前期严重程度呈负相关关系。见图1。
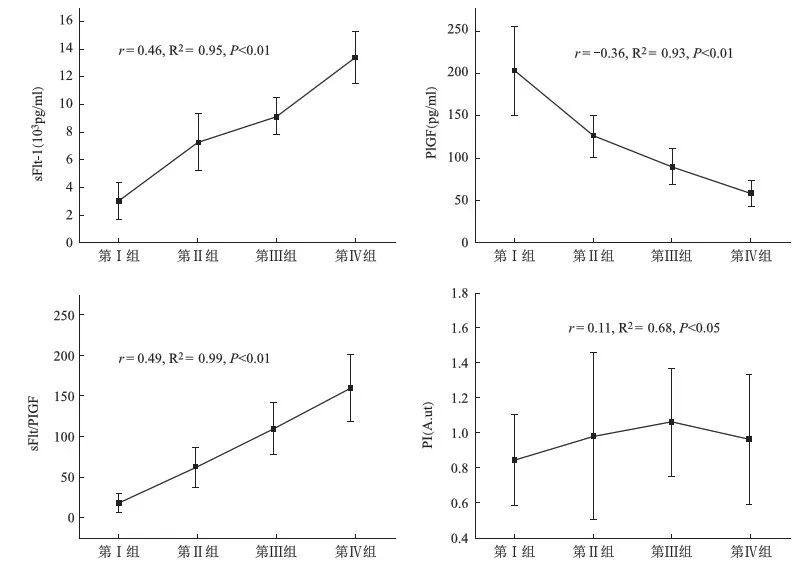
图1 子痫前期不同严重程度与各检测值相关性分析
2.3 各检测值与妊娠期子痫前期的关系
正常孕妇的sFlt-1、 sFlt-1/PlGF和PI值均低于子痫前期患者(t=4.39,P<0.01;t=9.17,P<0.01;t=2.05,P=0.042),而PlGF含量高于子痫前期患者(t=4.63,P<0.01)(表1)。

表1 两组各检测值比较±s)
两组比较*P<0.01**P<0.05
2.4 各检测值预测子痫前期的诊断效能
图2为sFlt-1,PlGF和sFlt-1/PlGF对子痫前期预测的ROC曲线。其中sFlt-1的AUG为0.68(95% CI 0.62~0.92),测定的敏感度和特异度分别为63%和71%;PlGF的AUG为0.65(95% CI为0.35~0.72),敏感度和特异度分别为69%和58%;sFlt-1/PlGF的ROC曲线AUG为0.74(95% CI 0.37~0.75),敏感度和特异度分别为78%和69%。
2.5 PI联合指标检测诊断子痫前期效能
选择正常组和子痫前期组,logistic回归分析影响子痫前期发生的相关因素。此回归模型的定性因变量为子痫前期,诊断为子痫前期时取值为1,正常组取值为0。结果显示sFlt-1、PI和sFlt-1/PlGF值综合诊断子痫前期的价值较高,诊断效能达84.3%(表2)。

图2 各检测值对子痫前期预测的ROC曲线
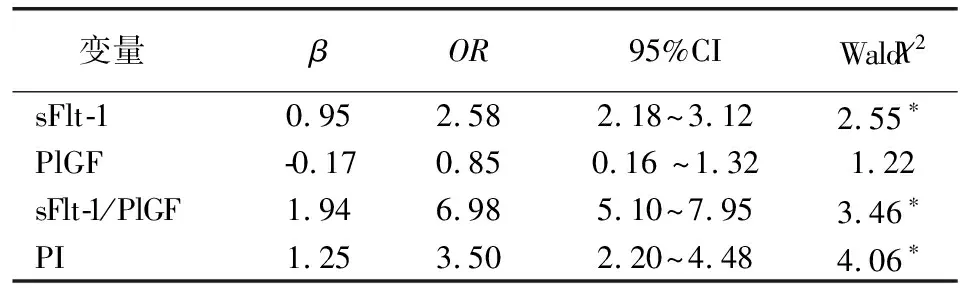
变量 βOR95%CIWaldχ2sFlt10.95 2.582.18~3.12 2.55∗PlGF0.170.850.16 ~1.321.22sFlt1/PlGF1.946.985.10~7.953.46∗PI1.25 3.50 2.20~4.484.06∗
*P<0.01
3 讨论
sFlt-1血管生成因子,与血管内皮生长因子(VEGF)具有很强的相关性,在正常孕妇妊娠期含量相对稳定,到妊娠中后期呈现线性增长,但子痫前期患者含量会迅速增加,而影响VEGF的正常功能[4,7]。本研究结果显示子痫前期孕妇血清sFlt-1含量高于正常孕妇,且随严重程度而增加呈正相关性。
对于子痫前期发生机理的探究,血管生成因子以及受体是重要的一部分[9]。两者间比值异常是子痫前期发病的重要因素且灵敏度较高。理论上 PlGF与sFlt-1结合,取代了VEGF,从而导致PlGF与VEGFR-2结合,刺激血管再生,引起子痫前期发生,即PlGF和VEGF竞争同一受体[10]。研究表明在妊娠期间,PlGF含量呈先增加后减少的趋势,但子痫前期孕妇在妊娠早期PlGF含量低于正常孕妇,且在sFlt-1含量增加后,子痫前期确诊前,其含量降低至最低[11]。本研究结果也显示,相较于正常孕妇,子痫前期患者的PlGF含量较低,且随着子痫前期严重程度的增加呈现负相关性。本研究中sFlt-1和PlGF含量与之前的研究存在一定偏差[8],可能是本研究纳入对象年龄和妊娠期偏大有关。
由于sFlt-1和PlGF随着子痫前期的严重程度呈现不同的相关性,因此,其比值在子痫前期的预测中具有较低的误诊率和更高的OR值。sFlt-1/PlGF在子痫前期的诊断中较为准确,尤其是对于早发型子痫前期,目前常用的截断值为85%,有研究显示其比值的AUG为0.95左右,具有较高的敏感性和特异性[12]。本研究子痫前期患者的sFlt-1/PlGF值高于正常孕妇,且随着子痫前期的严重程度增加呈正相关性,该相关性优于sFlt-1和PlGF,因此认为sFlt-1/PlGF值是预测子痫前期以及其严重程度的重要标志物。
关于子痫前期的研究较多,而对于子痫前期诊断标志物的综合研究仍存在很大不足。本研究回归分析显示,基于sFlt-1、sFlt-1/PlGF和PI值的预测均有较好的诊断效能,而sFlt-1/PIGF具有更好的诊断价值。有研究结果,血清sFlt-1和PlGF含量对严重脂肪肝患者、羊水过少患者的诊断效能较差[13],本研究排除了此类并发症患者,血清sFlt-1/PlGF预测子痫前期的截断值<85%,且其特异性和敏感性较低,分析认为:一方面可能与样本选择有关,另一方面也说明对子痫前期的诊断仅依靠血清sFlt-1/PlGF仍存在一定不足。因此,建议sFlt-1/PlGF和PI值联合模型仅适用于子痫前期的预测分析。
