高粱株型性状数量遗传分析
2018-03-15李延玲白晓倩于澎湃高建明裴忠有孙守钧
李延玲,白晓倩,于澎湃,高建明,裴忠有,罗 峰,孙守钧
(天津农学院 农学与资源环境学院,天津 300384)
高粱是仅次于小麦、玉米、水稻、大麦的第五大谷类作物,在我国栽培历史悠久[1]。目前,高粱生产中主要存在植株偏高,叶片披散、直立性较差,倒伏严重,导致机械化收获存在一定的困难;国内粒用高粱品种穗较长,延长了开花时间,使籽粒成熟度和大小存在差异,以及存在遗传基础狭隘、资源贫乏等问题[2-4]。因此,对高粱进行株型改良具有重要的意义[5-6]。理想株型的概念首次是由Donald[7]在1968年提出,即有利于植物生长发育、光合作用和籽粒产量的最理想化的株型,能够最大限度地提高光能利用率。育种专家们对高粱的理想株型进行了不断的探索,大概可以分为3个阶段。首先提出的是矮化育种[8],通过降低植株高度提高抗倒耐密的能力,达到增产的目的。高士杰等[9]根据实际生产情况进一步提出适合人工收获和机械收获的株高分别为160~180 cm和小于120 cm。其次是根据植株形态选择性状,马鸿图等[10]用不同类型的高粱品种进行研究,得出叶片宽长且平展的株型材料,限制了单位面积生物产量和籽粒产量的提高;王桂梅[11]通过对高粱叶片角度进行研究,进一步证明叶夹角决定着植株叶片的空间分布,直接关系到叶片的光能利用。最后是形态和机能相结合,在改良株型的同时,注重其他重要性状,张桂香等[12]通过对穗部性状与产量的分析,得到穗粒质量和穗粒数与产量具有较高的关联性。因此,在保持综合性状优良的基础上,应注重穗部性状的改良。
株型作为植株形态结构及其生理和生态功能方面的综合体现[13-14],对产量形成具有重要的影响。株型育种的目的是为了尽可能地提高群体光合效率,进一步提高群体的物质生产能力,其途径在于改良株型,来调节个体叶部性状及穗部性状在空间的生长排列方式,从而改善群体受光态势,最大限度地通过增加叶面积来提高单位面积光合效率,使群体在较高的光合效率和籽粒生产水平上达到动态平衡,最终获得较高的产量[15-16]。因此,从株型方面入手,以改善植株的形态特征,提高高粱产量为目的,结合分子辅助育种的手段,对相关性状的基因进行挖掘,加快育种进程,缩小育种年限,是培育出高产优质并且适应机械化生产的高粱品种的关键。
本研究以高粱主要株型性状为研究对象,旨在通过对高粱叶夹角、株高、穗长、平均茎节长度、叶长、叶宽进行主-多基因遗传分析研究群体株型性状的遗传规律,研究基因的作用方式,为田间选择稳定遗传的优良性状提供理论基础。
1 材料和方法
1.1 试验材料
试验于2015年7月在天津静海良种场进行,选用植株矮小,叶片上冲,叶夹角较小的恢复系材料引-20(从美国普渡大学引进)和植株高大,叶片披散,叶夹角较大的高粱恢复系材料忻梁52(本地材料)为亲本,配制杂交组合,同年在海南加代,共得到F2群体700株。
1.2 性状调查
对F2群体每一株单独进行田间性状测定。叶夹角:从形态学的上端第2叶开始测定,使用量角器测量茎秆与叶片之间的角度[17],由上往下一共测定5片叶的叶夹角,最后取平均值进行数据整理及分析;株高:灌浆后,测定地面至雄穗顶端的高度(cm);穗长:测定穗基部到穗顶的长度(cm);平均茎节长度:即株高减去穗长除以茎节数(cm);叶长:测定叶片基部至叶尖的距离(cm);叶宽:即叶片中间最宽部分的宽度(cm),使用卷尺进行测定。
1.3 数据分析
基本数据使用Excel 2007和SPSS 19.0做处理,然后根据盖钧镒[18]提出的单个分离世代群体的遗传模型方法——主-多基因遗传分析模型进一步分析,得到本试验F2群体的11个性状对应的遗传模型及每个模型对应的AIC值。然后,每个性状挑选出AIC值最小的4个模型,并分别对其进行适合性检验。通过检验筛选出最适合的模型,然后估计一阶、二阶遗传参数,计算主基因的遗传率。
2 结果与分析
2.1 性状间的相关性分析
高粱的产量受多种因素影响,其中,株型性状在其产量形成阶段表现出重要的作用。植物高矮和叶片形态直接影响着植株的生长状态,而这些株型性状在空间上的合理分布又直接影响光能的利用、养分的吸收、种植的密度,最终影响产量。因此,为了进一步了解株型性状之间的关系,对6个性状进行了相关分析。由表1可知,除了叶夹角之外,株高与穗长、平均茎节长度、叶长均呈现极显著正相关,其中,相关程度最高的性状为平均茎节长度,相关系数为0.796;其次为穗长和叶长,相关系数分别为0.420和0.362。株高与叶宽呈极显著负相关,相关系数为-0.096。在与叶片形态相关的性状中,叶夹角与叶宽的相关性最高,相关系数为0.335;其次为穗长,相关系数为0.267,而株高与叶夹角之间相关性并未呈现出极显著的相关关系,并且与株高相关程度最高的性状平均茎节长度与叶夹角呈负相关。因此,在株型改良的过程中,要综合考虑叶夹角与株高的关系,适当地降低株高有利于大田生产和机械化收获,而上冲型叶片叶夹角较小,有利于叶片接收到更多的太阳辐射进行光合作用。
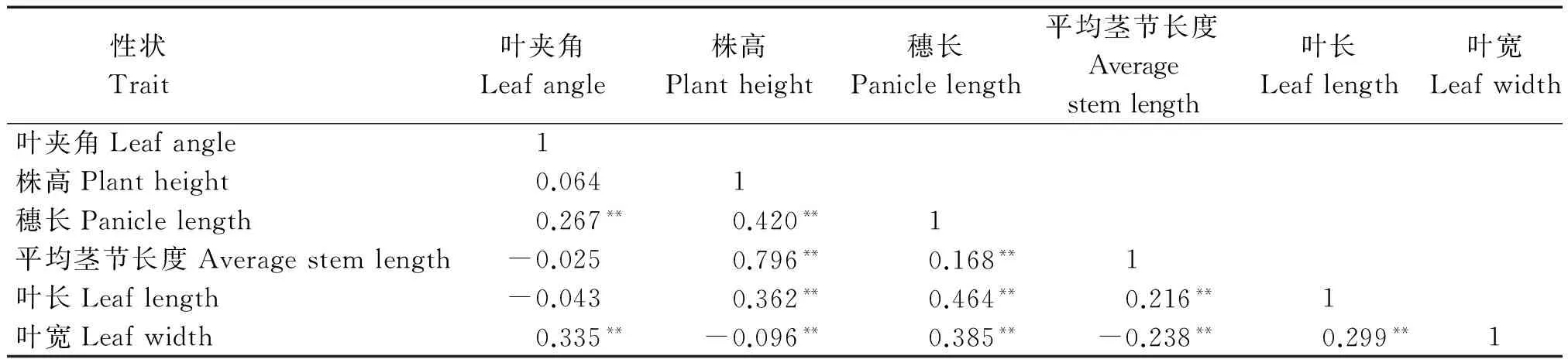
表1 F2群体株型性状相关性分析Tab.1 Correlation analysis of plant-type traits in F2 population
注:**表示在0.01水平(两侧)显著相关。
Note:**indicates significant correlation at 0.01 level(both sides).
2.2 株型相关性状表型分析
忻粱52×引-20组合F2群体植株各株型性状的测定值如表2所示,各株型性状频次分布图如图1所示。F2叶夹角、株高、穗长、平均茎节长度、叶长、叶宽均表现为明显的单峰分布,具有数量性状遗传分布特征。
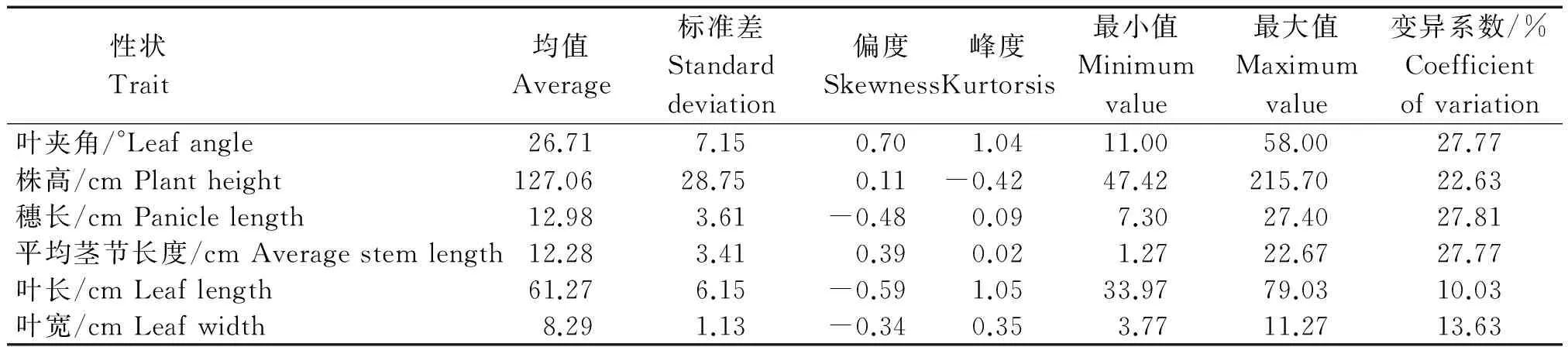
表2 引-20和忻梁52后代F2群体植株性状统计分析Tab.2 Traits characteristic values of F2 population in Yin-20×XL52 group
2.3 株型性状遗传模型的选择
利用主-多基因混合遗传模型的F2单世代分析方法[19-23],对6个株型性状进行遗传分析(表3,4)。根据AIC值最小的遗传模型选择准则,每个性状选择AIC值较小的4个遗传模型(表中用*标注)作为备选模型。
2.4 株型性状遗传模型检测
利用U12、U22、U32(均匀性检验)、nW2(Smirnov检验)和Dn(Kolmogorov检验)对这4个备选模型的F2世代进行适合性检验(表5),选择统计量达到显著水平个数最少的模型作为最优模型。
在叶夹角4种遗传备选模型ModelB_1均匀性检验、Smirnov检验均达到显著水平(P<0.05),且ModelB_1的AIC值最小。因此,选择ModelB_1作为该群体的最适遗传模型,说明叶夹角性状的遗传是受2对主基因控制的,为加性-显性-上位性的混合遗传模型。
株高4种遗传备选模型ModelB_2和ModelA_1在均匀性检验、Smirnov检验和Kolmogorov检验中均达到显著水平(P<0.05),但相比于ModelA_1来说,ModelB_2的AIC值更小。因此,选择ModelB_2作为该群体的最适遗传模型,说明群体株高的遗传是受2对主基因控制的,即加性-显性的混合遗传模型。
穗长4种遗传备选模型在检验时ModelA_6和ModelB_5中U12、U22、nW2、Dn均达到显著水平(P<0.05),但相比于ModelB_5来说,ModelB_6的AIC值更小。因此,选择ModelB_6作为该群体的最适遗传模型,说明群体穗长的遗传是受2对主基因控制的,即等显性遗传模型。
平均茎节长度4种遗传备选模型在检验时ModelA_1和ModelA_4中除U22未达到显著水平,其他统计量均达到显著水平,但相比于ModelA_4来说,ModelA_1的AIC值更小。因此,选择ModelA_1作为该群体的最适遗传模型,说明平均茎节长度的遗传是受1对主基因控制的,即加性-显性的混合遗传模型。
叶长4种遗传备选模型在ModelB_1检验中U12、U22、U32、nW2、Dn均达到显著水平(P<0.05),且ModelB_1的AIC值最小。因此,选择ModelB_1作为该群体的最适遗传模型,说明叶长的遗传是受2对主基因控制的,并且表现为主基因加性-显性-上位性效应。
叶宽4种遗传备选模型在检验时ModelB_6和ModelB_5中U12、U22、nW2、Dn均达到显著水平(P<0.05),但相比于ModelB_5来说,ModelB_6的AIC值更小。因此,选择ModelB_6可以作为该群体的最适遗传模型,说明叶宽的遗传是受2对主基因控制的,为等显性遗传模型。
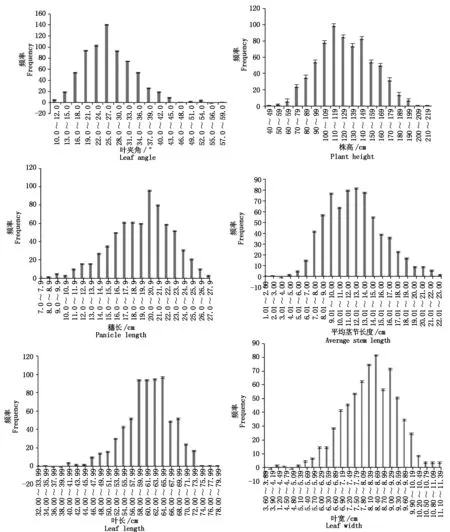
图1 F2群体株型性状频次分布Fig.1 Frequency distribution of F2 plant-type traits
2.5 株型性状遗传参数估计
根据已经确定的最优模型和IECM的估算方法,对F2群体株型性状进行遗传参数估计(表6)。高粱叶夹角遗传符合B_1模型,F2群体的分离符合加性-显性-上位性的混合遗传模型,其中,叶夹角平均值m为28.992 8,偏向于小夹角的亲本引-20,2对主基因加性效应值之和为8.272 6,2对主基因显性效应值之和为-4.716 3,即控制叶夹角性状的2对主基因以加性效应为主。主基因遗传率为70.15%,也就是说叶片夹角的狭义遗传力较高,叶夹角受环境影响造成的表型变异较小,这与周紫阳等[24]在高粱上的研究结果是一致的。
株高遗传符合B_2模型,受2对主基因控制,表现为加性-显性混合遗传模型,该结果与蒋锋等[25]在玉米中的研究结果一致。其中,2对主基因的加性效应值之和为31.733 8,显性效应值之和为-4.260 0,加性效应显著大于显性效应,说明控制高粱株高性状的2对主基因都以加性效应为主,并且株高的主基因遗传率为74.26%。
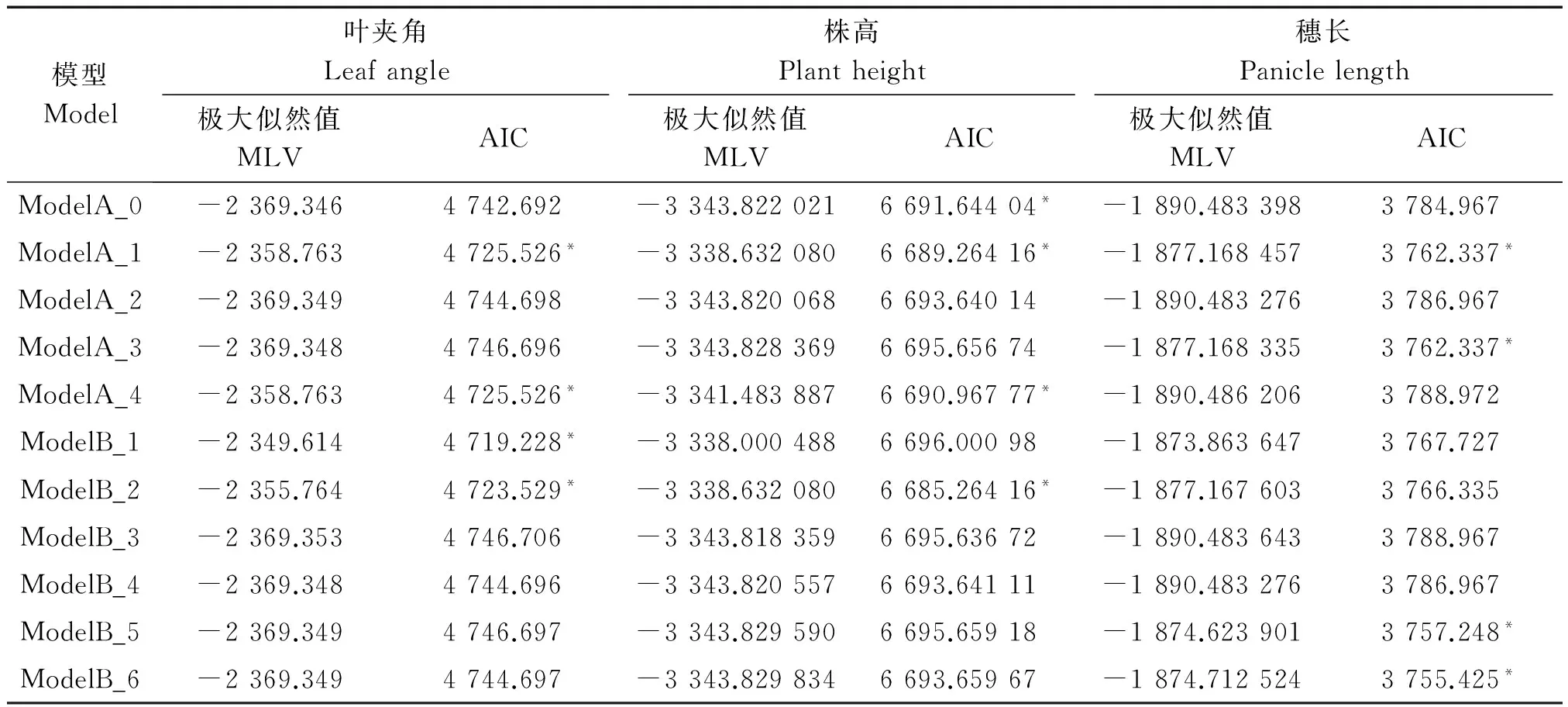
表3 叶夹角、株高、穗长遗传模型的极大似然值和AIC值Tab.3 Maximum likelihood and AIC values of leaf angle,plant height and panicle length genetic models
注:*表格选模型。表4同。
Note:*means candidate models.The same as Tab.4.
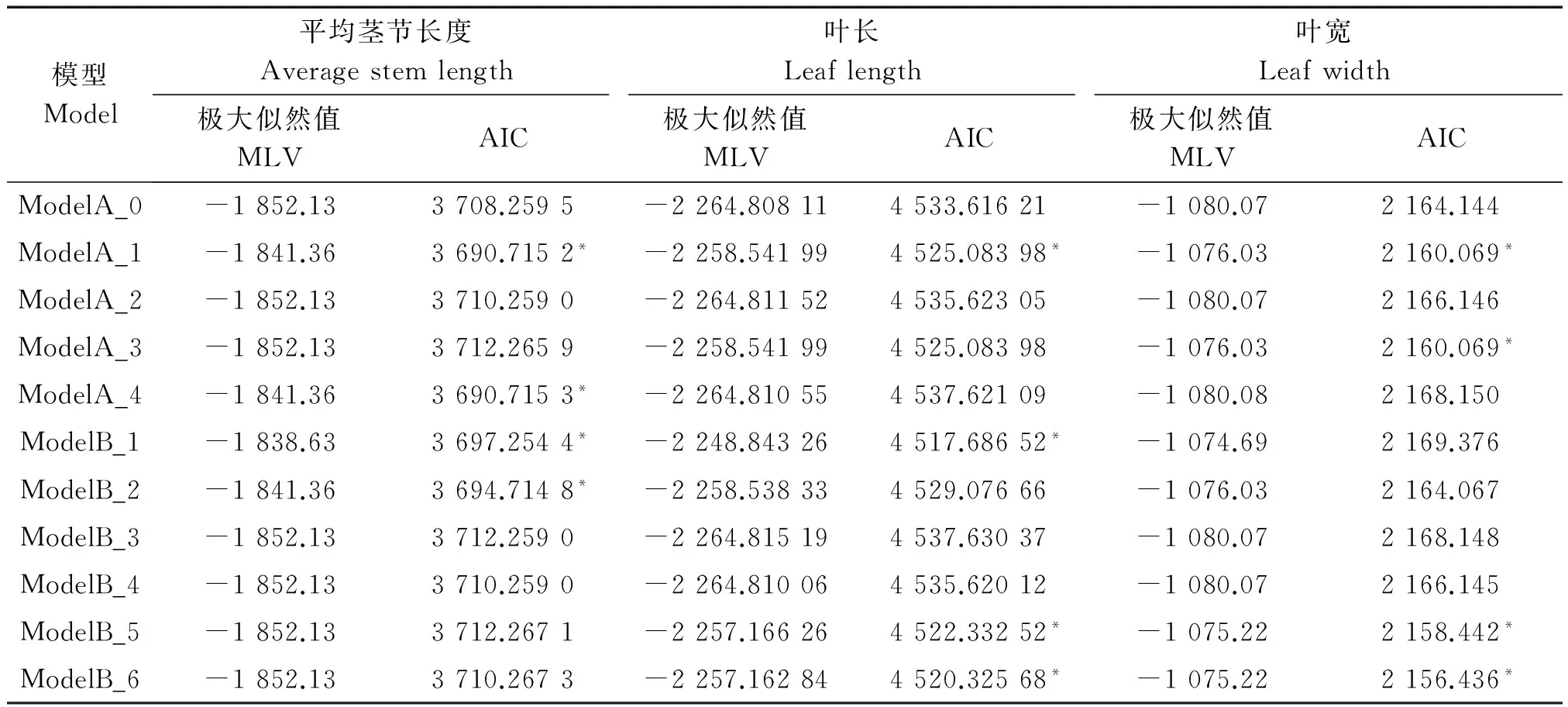
表4 平均茎节长度、叶长、叶宽遗传模型的极大似然值和AIC值Tab.4 Maximum likelihood and AIC values of stem length,leaf length and leaf width genetic models
穗长遗传符合B_6模型,即等显性遗传模型,主基因遗传率为58.67%;加性效应值之和为11.696 9,显性效应值之和为-12.981 2。在穗长性状遗传中,主基因主要表现为加性效应,容易在后代稳定遗传,因此,相关基因累加的育种手段都可能得到较好的改良效果[26-27]。
平均茎节长度遗传符合A_1模型,即加性-显性的混合遗传模型,主基因的加性效应值之和为13.561 4,显性效应值之和为-5.309 3,加性效应大于显性效应,说明控制高粱平均茎节长度的主基因以加性效应为主,主基因遗传率为68.69%。
叶长遗传符合B_1模型,即加性-显性-上位性的混合遗传模型,2对主基因的加性效应和显性效应值分别为6.652 7和6.597 7,均表现正向增效,加性×显性互作效应为3.870 5,主基因遗传率为47.92%。说明叶长性状主要受2对主基因控制,加性效应和显性效应均起重要作用,同时较低的遗传率说明该性状受环境影响较大。
叶宽遗传符合B_6模型,即等显性遗传模型,不存在上位性效应,2对主基因的加性效应值为8.449 2,为正向增效;显性效应值为-6.224 6,为负向增效,主基因的遗传效应主要以加性为主,主基因遗传率为61.60%。
注:U12、U22、U32、nW2、Dn.适合性检验参数,由主基因+多基因软件计算得出。括号内数字为适合性检验标准值。
Note:U12,U22,U32,nW2,Dn.Fitness test parameters,obtained by multiple genes of major gene and calculation software.The number in parentheses is the standard of fitness test.
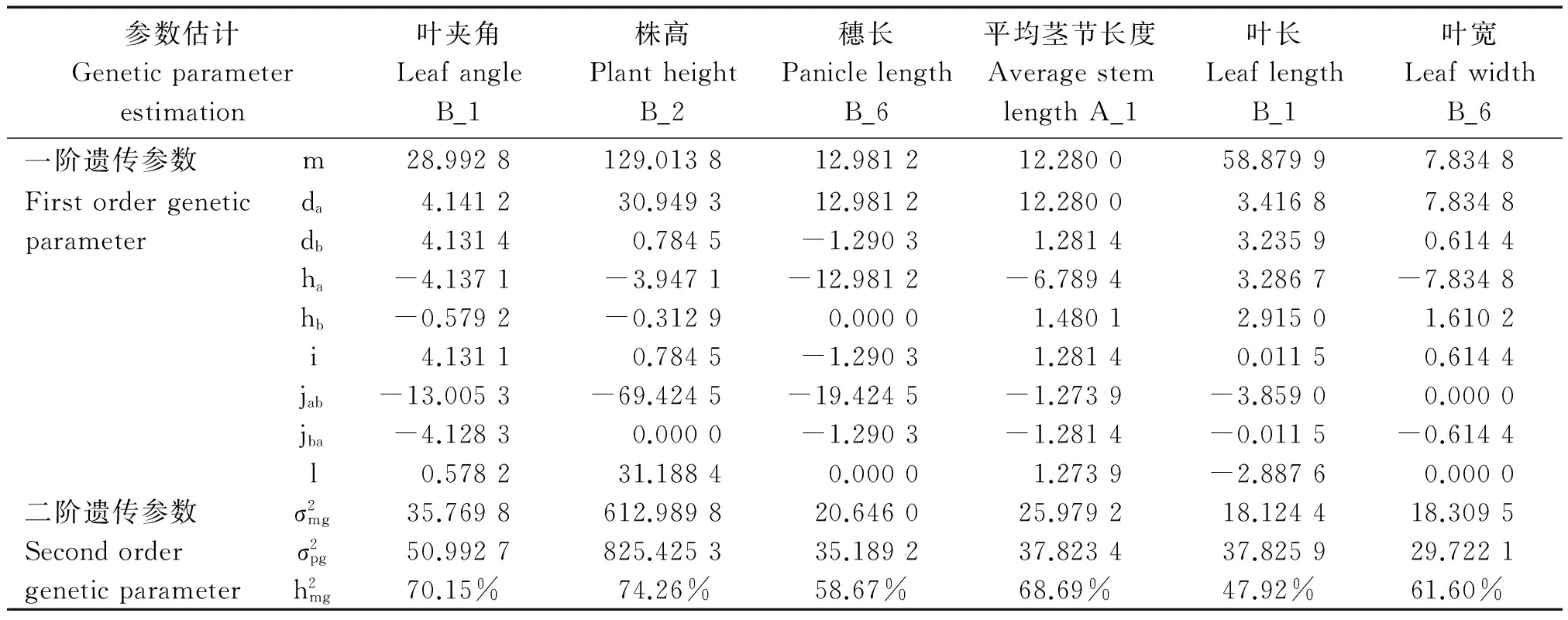
表6 株型性状遗传参数估计Tab.6 Plant types of genetic parameter estimation
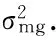
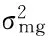
3 结论与讨论
株型性状的遗传分析对高粱育种的理论、方法和策略至关重要。本研究通过对高粱株型性状进行数量遗传分析,得出高粱主要株型性状的遗传模型及基因作用方式,以期为今后高粱株型改良提供参考。
本研究结果表明,叶夹角遗传受2对主基因控制,符合加性-显性-上位性的混合遗传模型,主基因遗传率为70.15%,说明叶夹角具有较高的遗传率受环境影响较小,与张旷野等[28]在玉米中的研究结果一致,与王桂梅[11]在高粱中对叶夹角的遗传分析结果(叶夹角属于微效多基因控制的数量性状存在差异,分析可能是由于后者试验群体数量较小(F2世代150株)),存在较大差异。
株高和穗长的遗传均受2对主基因控制,且以加性效应为主,主基因遗传率分别为74.26%,58.67%,该结果与管延安等[29]对株高及孙贵荒等[30]对穗长的研究结果一致;而在国外的研究中表示,高粱株高遗传受4对基因控制存在明显差异,究其原因,可能与亲本来源有关系[31],也就是说,本试验所选取的2个亲本材料自身所携带的控制株高的只有2对基因存在差异,另外2对基因无差异,故在F2世代中只有2对基因结合出现基因分离。
叶夹角和株高是构成高粱株型的主要性状,并具有较高的遗传力,受环境影响较小,若想获得紧凑株型,必须在早期世代进行育种材料的选择,容易获得目标材料,其他遗传力较低的性状则适合在高代进行选择,尽可能消除环境因素造成的影响。
[1] 张若辰,梁 艳,宫丽华,等.高粱的应用现状[J].山东轻工业学院学报,2013,27(4):39-41.
[2] 高士杰,李继洪,陈冰嬬.培育适宜机械化生产的粒用高粱杂交种应重视的几个问题[J].农业与技术,2015,35(2):12,28.
[3] 杜志宏,张福耀,平俊爱,等.高粱产业机械化发展探讨[J].现代农业科技,2014,12 (24):87-88.
[4] 杜志宏,平俊爱,吕 鑫,等.高粱机械化种植品种选择及优质高产栽培技术[J].农业工程技术,2017,37(23):52-54.
[5] Boyles R E,Pfeiffer B K,Cooper E A,et al.Genetic dissection of sorghum grain quality traits using diverse and segregating populations[J].Theor Appl Genet,2017,130(4):697-716.
[6] Shehzad T,Okuno K.QTL mapping for yield and yield-contributing traits in sorghum (Sorghumbicolor(L.) Moench)with genome-based SSR markers[J].Euphytica,2015,203:17-31.
[7] Donald C M.The breeding of crop ideotypes[J].Euphytica,1968,17(3):385-403.
[8] 杨守仁.水稻高产栽培及高产育种论丛[M].北京:中国农业出版社,1990:162-229.
[9] 高士杰,刘晓辉,李继洪.粒用高粱超高产育种的思考[J].中国农业科技导报,2006,8(1):23-25.
[10] 马鸿图,王秉昆,罗玉春,等.不同类型粒用高粱生产力及光合能力的比较研究[J].作物学报,1993 (5):412-419.
[11] 王桂梅.高粱叶片角度遗传研究[J].山西农业科学,1986 (12):12-14.
[12] 张桂香,翟世宏,李爱军.高粱穗部主要性状与产量的相关分析[J].杂粮作物,2005 (2):77-79.
[13] 齐振宇,李俊星,邹晓霞,等.甜瓜株型性状的遗传分析[J].农业生物技术学报,2015,23(3):302-310.
[14] 王立新,成慧娟,张 姼,等.粒用高粱主要农艺性状的相关和通径分析[J].吉林农业科学,2015,40(5):31-33.
[15] 高士杰,陈冰嬬,李继洪.对粒用高粱育种的思考[J].现代农业科技,2013(10):31-32,37.
[16] Fernandez M G S,Strand K, Hamblin M T,et al.Genetic analysis and phenotypic characterization of leaf photosynthetic capacity in a sorghum (Sorghumspp.)diversity panel[J].Genet Resour Crop Evol,2015,62:939-950.
[17] 段 宁.高粱株型性状的遗传分析[J].杂粮作物,2001(4):13-15.
[18] 盖钧镒.物数量性状遗传体系的分离分析方法研究[J].遗传,2005,27(1):130-136.
[19] 齐 望.甜玉米主要性状主基因+多基因混合遗传分析[D].长春:吉林农业大学,2015.
[20] 宋轶群.糯玉米穗部性状和籽粒品质性状的主基因+多基因遗传分析[D].长春:吉林农业大学,2015.
[21] 毕晓静,史秀秀,马守才,等.小麦农艺性状的主基因+多基因遗传分析[J].麦类作物学报,2013,33(4):630-634.
[22] 李 华,刘联正,杨兴圣,等.小麦抗源材料0911-3抗白粉病的主基因+多基因遗传分析[J].华北农学报,2013,28(1):37-43.
[23] 李欧静,佟德清,李金旺,等.甜高粱(SorghumbicolorL.Beauv)茎秆相关性状遗传分析[J].分子植物育种,2017,15(9):3560-3567.
[24] 周紫阳,赵雪梅,李光华,等.高粱叶角遗传研究[J].杂粮作物,2006 (6):392-394.
[25] 蒋 锋,刘鹏飞,曾慕衡,等.甜玉米株高的多世代遗传分析与QTL定位[J].西北农林科技大学学报:自然科学版,2011,39 (3):67-74.
[26] 高士杰,王 方.中国高粱穗长的遗传与改良[J].作物学报,1991,17(1):76-78.
[27] 曾慕衡,刘鹏飞,蒋 锋,等.超甜玉米果穗穗长和穗粗遗传特性分析[J].广东农业科学,2011 (1):34-36.
[28] 张旷野,孙铭泽,闫 伟,等.玉米穗上叶叶夹角的遗传分析[J].作物杂志,2015 (6):27-32.
[29] 管延安,张华文,樊庆琪,等.普通高粱与甜高粱杂交组合株高、糖度的主基因多基因模型遗传效应分析[J].核农学报,2012,26(1):36-42.
[30] 孙贵荒,陈 悦,杨晓光,等.高粱产量、株高和穗长的遗传研究[J].辽宁农业科学,1995 (3):16-20.
[31] 陈笑孔.高粱株高性状遗传规律的初步研究[J].黑龙江农业科学,1981 (4):1-6.
