生物炭不同施用量对烟草根际土壤微生物多样性的影响
2018-03-15陈泽斌王定斌郭丽红王定康徐胜光
陈泽斌,高 熹,王定斌,郭丽红,王定康,徐胜光
(1.昆明学院 农学院,云南 昆明 650214;2.云南农业大学 植物保护学院,云南 昆明 650201;3.宣威市阿都乡农业综合服务中心,云南 宣威 655425;4.云南省高校特色生物资源开发与利用重点实验室,云南 昆明 650214;5.云南省高校生物炭工程研究中心,云南 昆明 650214)
生物炭(Biochar)是农作物秸秆、木质物质、禽畜粪便或其他有机物料在低氧环境下,经过高温(300~700 ℃)热解的一种具有较高表面积、孔隙度、吸附性和稳定性高的富含碳材料[1]。生物炭作为一种新型的碳材料引起了广泛的关注,主要是由于其在改良土壤、降低温室气体排放、环境生态修复等方面都有潜在的应用,为解决全球气候变化、环境污染等对农田的影响,提供了新的思路[2]。根际微生物指生活在植物根系土壤中的细菌、放线菌、真菌、藻类和原生动物,它们的数量是根际外微生物数量的几倍或几十倍,它们与植物根系相互作用,相互促进[3]。微生物聚集在根系周围,将有机物转化为无机物质,为植物提供有效的营养,同时,微生物也能分泌维生素、生长促进剂等,促进植物生长。在植物生长中,死亡和掉落的根系,以及从根部分泌的无机和有机化合物是微生物的营养和能量的重要来源[4]。近年来,生物炭在不同作物上的应用研究已有很多报道,李航等[5]采用盆栽培养香蕉小苗,以生物炭与土壤的不同比例混合作为培养基质,采用稀释平板菌落计数法测定微生物数量,采用Biolog-ECO技术分析香蕉苗根际土壤微生物群落,发现生物炭的施加能够明显增加土壤中微生物数量。Biolog-ECO分析得出,生物炭的施加提高了微生物群落平均颜色变化率、多样性指数和炭源利用丰度。韩光明等[6]建立了3个生物炭浓度梯度,以此探讨生物炭对根际土壤微生物和土壤物理化学性质的影响,研究设施菠菜土壤添加生物炭处理后根际微生物的变化,研究发现生物炭可以作为改善设施土壤理化性质及板结程度的改良剂。孙大荃等[7]设置5个生物炭梯度,分别在大豆的不同生长期测定土壤微生物数量、pH值和田间持水量的动态变化,并观察微生物在炭粒与土粒中的分布情况。结果表明,生物炭能提高大豆根际土壤中细菌数量,发现生物炭可成为缓解大豆连作障碍的土壤改良剂。毛家伟等[8]为探讨豫东烟区生物炭的合理利用方法,通过大田小区试验,研究生物炭对烤烟生长发育及经济性状的影响。结果表明,施用生物炭能促进烟株生长,提高烟株各项农艺性状指标,降低病毒病和赤星病发病率及病情指数。叶协锋等[9]以云烟97为对象,通过大田试验,研究花生壳生物炭不同用量对植烟土壤碳库及烤后烟叶品质的影响。结果表明,适量添加生物炭可以改善烤后烟叶单料烟评吸质量。湛方栋等[10]选择贵州省3种典型的植烟土壤为对象,研究烤烟根际微生物群落结构及其动态变化。得出烤烟根际微生物的种群多样性及其变化在不同土壤中表现也不一样,相对于黄壤和黄色石灰土,在中性紫色土壤中,根际微生物中占主导的种群数量较多,根际细菌和放线菌的数量则更为多样化和稳定。赵秋芳等[11]采用室内培养试验,研究施用生物炭对香草兰生长和根际土壤微生物的影响。试验共设5个处理,发现施用生物炭促进了香草兰植株地上部和根系的生长。通过在香草兰的土壤中加入生物炭,增加了香草兰土壤中细菌和放线菌的数量,用生物炭处理的根瘤菌数量显著减少。而目前关于生物炭不同施用量对烟草根际土壤微生物多样性影响的研究尚未见报道。为此本研究应用新一代高通量测序技术直接测序土壤DNA中16S rDNA-V4区和ITS2区基因的PCR产物,每次分析获得的基因序列数以万计,相较于第一代Sanger测序,它可以直接对混合物进行测序,因此,不需要建立一个克隆群体;与传统的方法相比,它的通量很高,可以节约98%以上的时间[12]。能更准确的剖析施用生物炭后烟草根际土壤中细菌、真菌菌落结构的变化,以期找出生物炭对烟草根际微环境的影响方式以及作用规律,为深入研究生物炭在烟田的应用提供理论依据。
1 材料和方法
1.1 试验材料与试验地概况
2016年4月于云南省宣威市落水镇健康烟田进行大田试验,土壤类型为红壤,土壤养分情况为pH值6.1,速效氮106.6 mg/kg,速效磷12.8 mg/kg,速效钾90.0 mg/kg,烤烟品种为云烟87,试验所用生物炭由云南威鑫农业科技股份有限公司生产,由花生壳炭化而来。
1.2 试验设计
试验设4个处理,每处理50棵烤烟,每处理3次重复,t1.1处理(CK)为烟草专用复合肥(N∶P2O5∶K2O=10∶12∶24);t4.1处理为烟草专用复合肥+生物炭50 g/棵;t5.1处理为烟草专用复合肥+生物炭100 g/棵;t6.1处理烟草专用复合肥+生物炭150 g/棵,生物炭施用量根据辽宁生物炭工程技术研究中心韩光明等[6]的研究设计而来,随机区组设计,每小区30 m2。烤烟移栽前将生物炭与基肥在塘内混匀,一次性施用。常规施肥及其他田间管理参照当地栽培规范进行。每处理随机选取30株成熟期健康烤烟,挖出根系,用抖根法采集附着在根际表面的土壤,混匀后为该处理的根际土壤样品。
1.3 总DNA提取
参照Omega公司的D5625-01 Soil DNA Kit土壤基因组DNA提取试剂盒的步骤提取各根际土壤样品DNA,用0.8%的琼脂糖凝胶电泳检查后,用无菌水稀释至1 ng/μL。
1.4 ITS2区及16S rDNA-V4区的PCR扩增
使用带标签序列(Barcode)的ITS2区及16S rDNA-V4区特异引物3F(5′-GGAAGTAAAAGTCGTAAC
AAGG-3′)和4R(5′-GCTGCGTTCTTCATCGATGC-3′)
及515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′),使用KOD-Plus-Neo高保真PCR酶进行PCR,用2.0%的琼脂糖凝胶电泳检测后,送北京诺禾致源生物信息科技有限公司,进行MiSeq测序。
1.5 下机数据的质控及分析
剔除标签序列(Barcode)和引物序列,用FLASH软件[13]进行序列拼接,经Qiime软件[14]过滤后得到的序列与Golddatabase数据库中已知序列进行比对,在用UCHIME软件[15]去除嵌合体序列,得到有效序列。用Uparse软件[16]在97%的相似性水平上划分操作分类单元,代表序列用RDP classifier软件[17]和GreenGene数据库[18]进行物种注释,利用Mothur软件作稀释度曲线,计算文库覆盖率(Coverage),Chao1指数及Shannon指数计算方法见参考文献[13]。采用R语言分析绘制样品OTUs的韦恩图,通过Canoco软件作PCA主成分分析显示样品间的差异,利用Fastunifrac软件分析得到样品间距离矩阵,绘制基于Weighted Unifrac距离的UPGMA聚类树。
2 结果与分析
2.1 细菌和真菌的OTU丰度和α多样性
各处理根际土壤样品测得ITS2区及16S rDNA-V4区原始序列数、质控序列数、有效序列数、OTU数、香农多样性指数、ACE指数、Chao1指数、覆盖率见表1,2,覆盖率为98.8%~99.8%,说明制备的MiSeq文库覆盖了土壤样品中98.8%以上的细菌和真菌类群,库容足够大,能够反映样品中细菌和真菌的真实组成。OTUs丰度稀释度曲线显示(图1,2),随着测序数量的上升,稀释度曲线斜率逐渐下降,趋向平坦但未达到平台期,说明测序数量足够,能够反映出样品中的物种组成特征,但仍有小部分低丰度类群未被覆盖。
4个根际土壤样品中细菌的OTU丰度为2 398~2 757(表1),大小依次为:t1.1
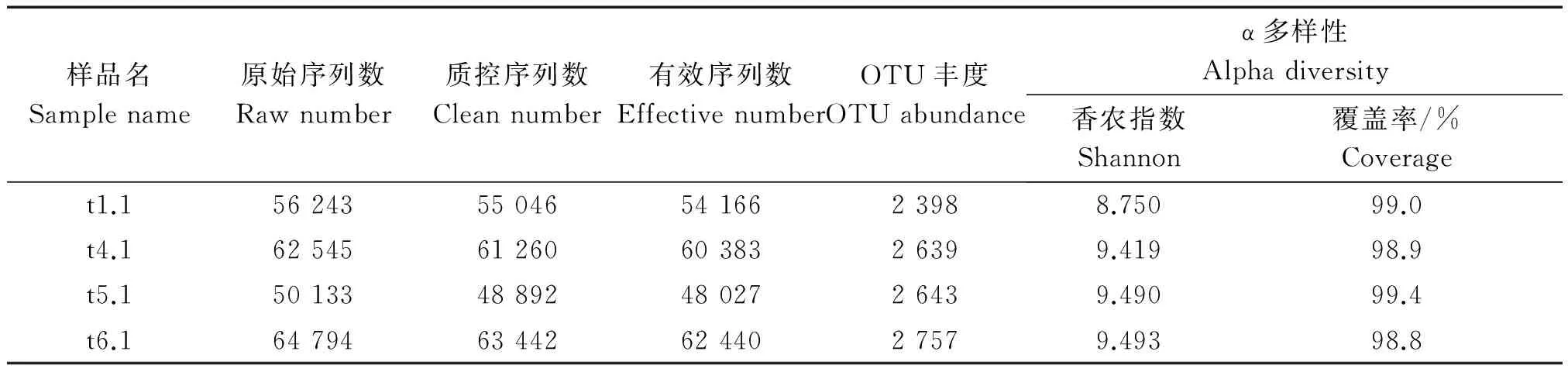
表1 细菌OTU丰度和α多样性Tab.1 Bacteria OTU abundance and alpha diversity index
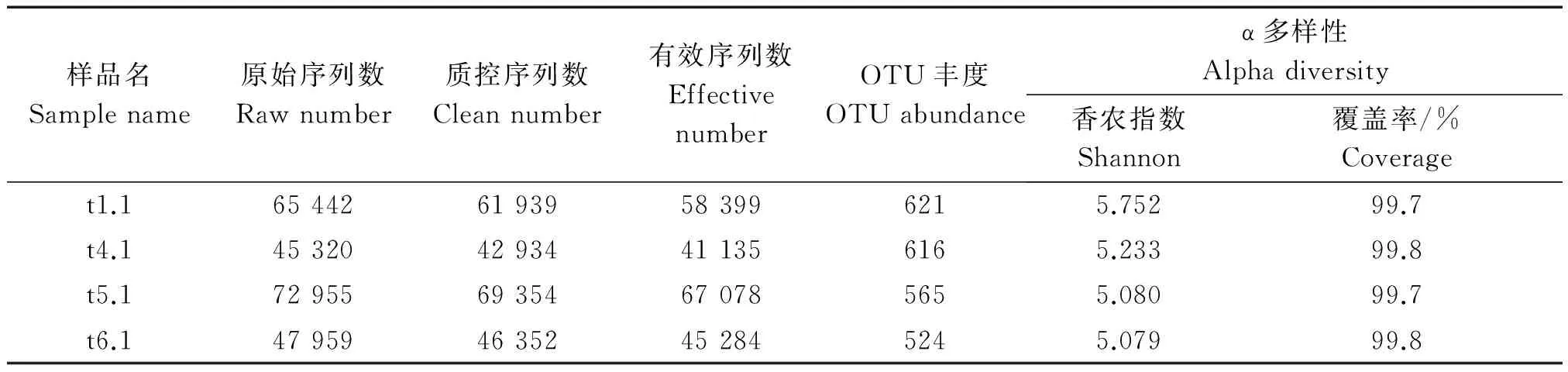
表2 真菌OTU丰度和α多样性Tab.2 Fungus OTU abundance and alpha diversity index

图1 细菌OTUs丰度稀释度曲线Fig.1 Dilution curve of bacteria OTUs abundance
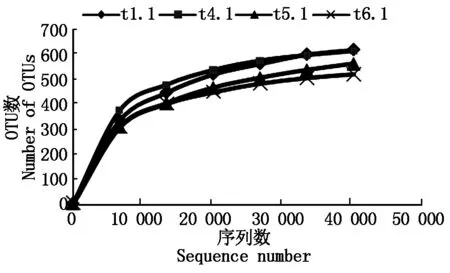
图2 真菌OTUs丰度稀释度曲线Fig.2 Dilution curve of fungus OTUs abundance
2.2 细菌和真菌OTUs分布
各处理根际土壤样品一共有10 437个细菌OTUs(图3),共有的OTUs为1 583个,只占OTUs总数的15.17%,说明施用生物炭处理对细菌OTU丰度的影响明显。t1.1和t4.1样品共有1 876个细菌OTUs,t1.1和t5.1样品共有1 988个细菌OTUs,t1.1和t6.1样品共有2 015个细菌OTUs,t4.1和t5.1处理共有2 020个细菌OTUs,t4.1和t6.1样品共有2 057个细菌OTUs,t5.1和t6.1处理共有2 175个细菌OTUs,说明不同生物炭施用量处理间的细菌种类组成相似性>不施用生物炭对照处理与施用生物炭处理间的细菌种类组成相似性,且在生物炭50~150 g/棵施用范围内,随着施用量的增加,不施用生物炭对照处理与施用生物炭处理间的细菌种类组成相似性逐渐增加,不同生物炭施用量处理间的细菌种类组成相似性也逐渐增加。
4个处理根际土壤样品一共有2 326个真菌OTUs(图4),共有的OTUs为267个,只占OTUs总数的11.48%,说明施用生物炭处理以及不同施用量处理对真菌OTU丰度的影响明显。t1.1和t4.1样品共有460个真菌OTUs,t1.1和t5.1样品共有372个真菌OTUs,t1.1和t6.1样品共有367个真菌OTUs,t4.1和t5.1处理共有384个真菌OTUs,t4.1和t6.1样品共有372个真菌OTUs,t5.1和t6.1处理共有359个真菌OTUs,说明不同生物炭施用量处理间的真菌种类组成相似性<不施用生物炭对照处理与施用生物炭处理间的真菌种类组成相似性,且在生物炭50~150 g/棵施用范围内,随着施用量的增加,不施用生物炭对照处理与施用生物炭处理间的真菌种类组成相似性逐渐降低,不同生物炭施用量处理间的真菌种类组成相似性也逐渐降低。
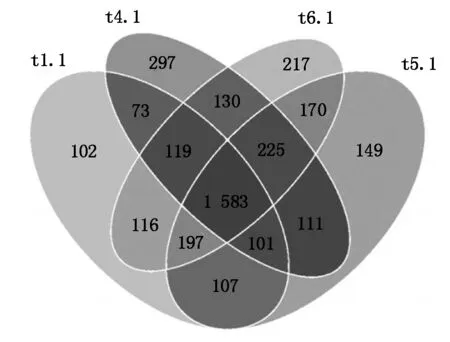
图3 细菌OTUs分布韦恩图Fig.3 Venn graph of bacteria OTUs distribution
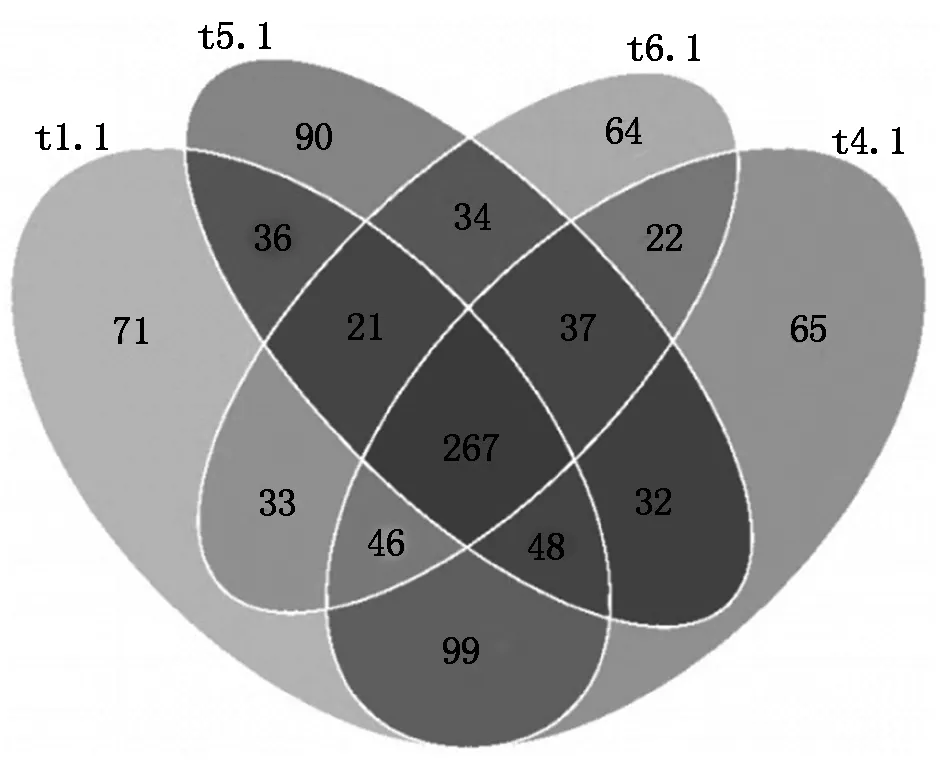
图4 真菌OTUs分布韦恩图Fig.4 Venn graph of fungus OTUs distribution
2.3 细菌群落种类组成及丰度
根据各OTU中代表序列的物种注释结果,选取各处理根际土壤样品中细菌和真菌在门(Phylum)和属(Genus)分类水平上最大丰度排名前10的物种,生成物种相对丰度堆积柱形图(图5-8)。由图5可知,4个处理根际土壤中细菌在门的分类水平上,最大丰度排名前10的种类为:变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、蓝藻菌门(Cyanobacteria)、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)、厚壁菌门(Firmicutes)和奇古菌门(Thaumarchaeota)。进一步分析处理间差异表明,施用生物炭的处理t4.1、t5.1、t6.1中的变形菌门细菌相比对照不施用生物炭的处理t1.1丰度稍有降低,分别降低了4.1%,2.7%,0.7%,在生物炭50~150 g/棵施用范围内,随着施用量的增加,变形菌门细菌的丰度有略微上升的趋势;施用生物炭的处理t4.1、t5.1、t6.1中的酸杆菌门细菌的丰度明显高于对照处理t1.1,相比对照t1.1分别增加了10.4%,8.1%,7.7%,在生物炭50~150 g/棵施用范围内,随着施用量的增加,酸杆菌门细菌的丰度有略微下降的趋势;施用生物炭的处理t1.1、t5.1、t6.1中的放线菌门细菌的丰度均低于对照处理t1.1,4个处理间丰度差异甚微;施用生物炭的处理t1.1、t5.1、t6.1中的蓝菌门细菌的丰度明显低于对照处理t1.1,相比对照处理t1.1分别降低了11.4%,11.4%,11.2%;4个处理间的芽单胞菌门细菌丰度差异甚微。
从属的分类水平来看(图6),变形菌门细菌序列主要分布于鞘氨醇单胞菌属(Sphingomonas,29.5%)、Pseudoduganella(4.38%)和Haliangium(6.56%),此外还有部分序列分布于植物线粒体(Unidentified_Mitochondria,4.26%);酸杆菌门细菌序列主要分布于Gaiella(9.67%)、Solirubrobacter(5.25%)和芽球菌属(Blastococcus,7.94%);蓝菌门细菌序列主要分布于植物叶绿体(Unidentified_Chloroplast,20.34%);芽单胞菌门细菌序列主要分布于芽单胞菌属细菌(Gemmatimonas,6.79%)。

图5 门水平上的细菌相对丰度柱形图Fig.5 The relative abundance of bacteria in phylum level

图6 属水平上的细菌相对丰度柱形图Fig.6 The relative abundance of bacteria in genus level
2.4 真菌群落种类组成及丰度
由图7可知,4个处理根际土壤中真菌在门的分类水平上,最大丰度排名前5的为:接合菌门(Zygomycota)、子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)和球囊菌门(Glomeromycota)。进一步分析处理间差异表明,施用生物炭50 g/棵处理后(t4.1),接合菌门真菌丰度比对照处理t1.1(50.92%)下降了12.38%,之后随着t5.1、t6.1处理中生物炭施用量的提高,接合菌门真菌丰度逐渐上升至53.68%;与之相反,施用生物炭50 g/棵处理后(t4.1),子囊菌门真菌丰度比对照处理t1.1(30.63%)升高了10.15%,之后随着t5.1、t6.1处理中生物炭施用量的提高,子囊菌门真菌丰度逐渐下降至29.11%;施用生物炭50 g/棵处理后(t4.1),担子菌门和壶菌门真菌丰度基本不变,之后随着t5.1、t6.1处理中生物炭施用量的提高,担子菌门真菌丰度呈现出先上升后降低的趋势;各处理对球囊菌门真菌丰度影响不大。从属的分类水平来看(图8),接合菌门真菌主要分布于被孢霉属(Mortierella,53.68%);子囊菌门真菌主要分布于青霉菌属(Penicillium,3.03%)、嗜热霉属(Thermomyces,2.89%)、金孢子菌属(Chrysosporium,2.48%)、棘壳孢属(Pyrenochaeta,2.02%)等10个丰度为0.17%~3.03%的属;担子菌门真菌主要分布于隐球菌属(Cryptococcus,27.27%)。
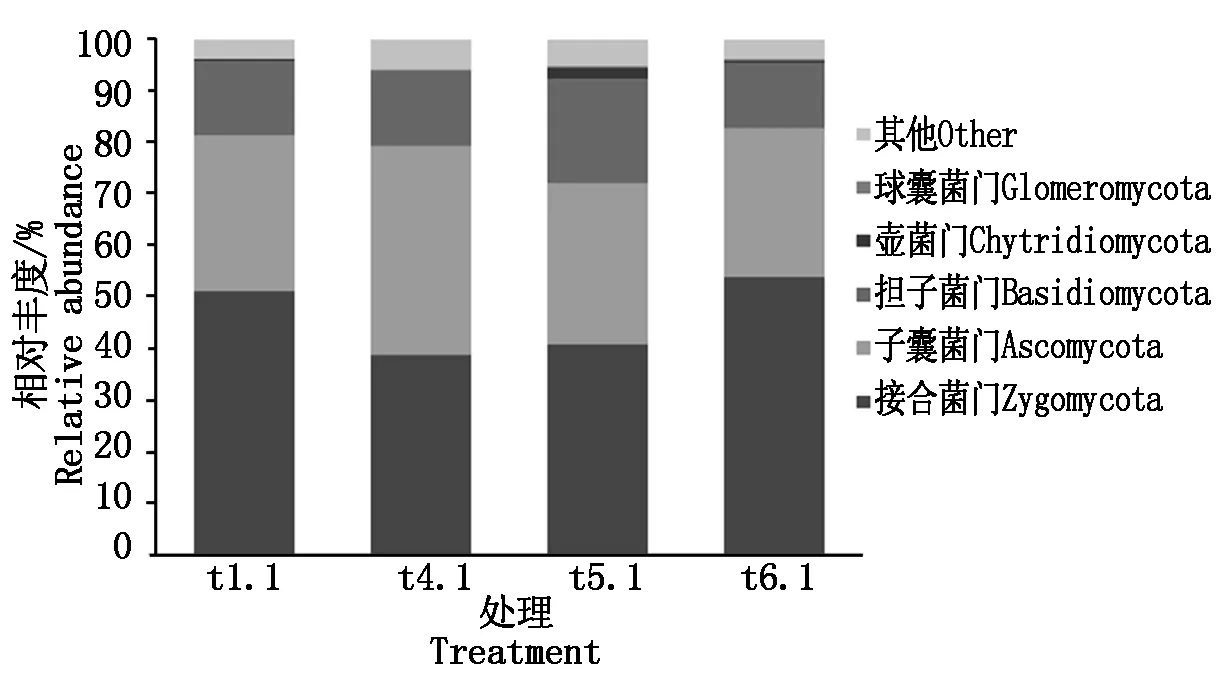
图7 门水平上的真菌相对丰度柱形图Fig.7 The relative abundance of fungus in phylum level
2.5 细菌群落组成的PCA聚类分析及丰度UPGMA聚类分析
PCA主成分分析表明(图9),主成分1(PC1)和主成分2(PC2)对样品差异性的解释度分别为36.86%和33.09%,合计为69.95%。总体看来,t1.1在PC2的正半轴,t4.1、t5.1、t6.1在PC2的负半轴,说明不施用生物炭的对照处理(t1.1)与施用生物炭的处理(t4.1、t5.1、t6.1)的细菌物种组成有明显差异;t4.1和t6.1样品均在PC1的正半轴和PC2的负半轴,且距离很近,而t5.1样品位于PC1的负值区,说明在施用生物炭处理的3个样品中,t4.1和t6.1样品的细菌物种组成更为相似。UPGMA聚类分析表明(图10),施用生物炭处理(t4.1、t5.1、t6.1)的各菌群丰度与不施用生物炭对照处理(t1.1)的各菌群丰度被聚类为2个分支,说明施用生物炭后各菌群丰度发生了明显变化;t4.1和t6.1处理被聚为1个分支,说明施用生物炭50 g/棵处理与150 g/棵处理的菌群丰度相似性较100 g/棵处理更高。

图8 属水平上的真菌相对丰度柱形图Fig.8 The relative abundance of fungus in genus level
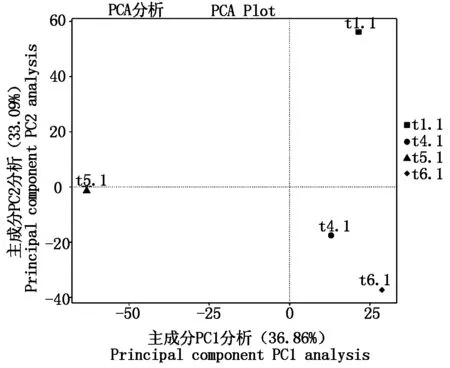
图9 细菌群落的PCA聚类分析Fig.9 PCA cluster analysis of bacterial community
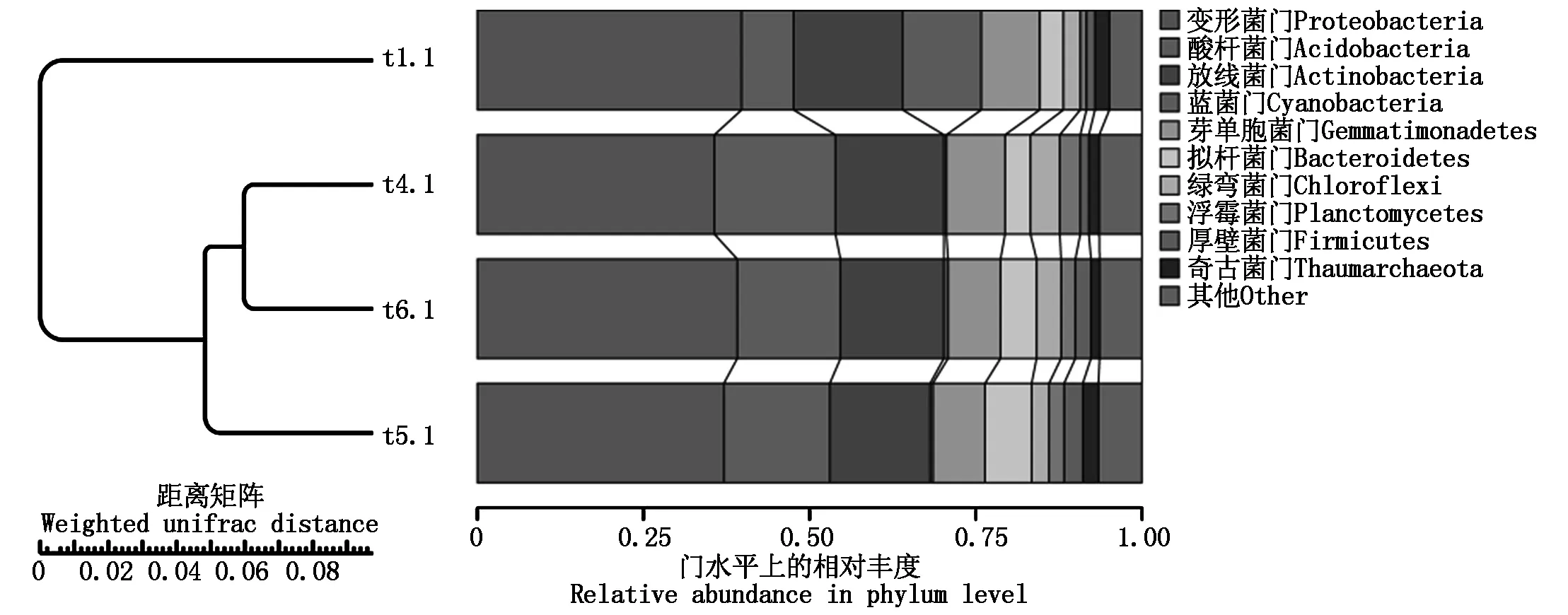
图10 门水平上的细菌相对丰度聚类树Fig.10 Cluster analysis of bacteria relative abundance in phylum level
2.6 真菌群落组成的PCA聚类分析及丰度UPGMA聚类分析
PCA主成分分析表明(图11),主成分1(PC1)和主成分2(PC2)对样品差异性的解释度分别为39.48%和31.85%,合计为71.33%。总体看来,t1.1和t6.1都在PC2的正半轴,t1.1和t4.1都在PC1的正半轴,而t1.1和t5.1分别在PC1和PC2的正负半轴,说明不施用生物炭的对照处理(t1.1)的真菌物种组成相比100 g/棵处理与施用生物炭150,50 g/棵处理更为相似;t4.1、t5.1和t6.1间距离较远,说明不同生物炭施用量处理间真菌物种组成差异大。UPGMA聚类分析表明(图12),施用生物炭的处理t6.1与不施用生物炭的对照处理t1.1聚为1个分支,说明施用生物炭150 g/棵处理的各菌群丰度与不施用生物炭的处理t1.1相似;t4.1和t5.1各自被聚为1个分支,且t4.1距离t1.1和t6.1的分支更近,说明施用生物炭50 g/棵处理相比100 g/棵处理来说,与150 g/棵处理及对照处理中各菌群丰度更为相似。

图11 真菌群落组成的PCA聚类分析Fig.11 PCA cluster analysis of fungal community
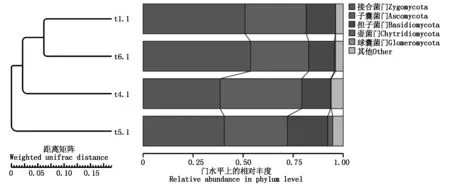
图12 门水平上的真菌相对丰度聚类树Fig.12 Cluster analysis of fungus relative abundance in phylum level
3 讨论
已有研究表明[19],当草食动物胃肠道微生物的高通量测序量达到1 700~20 000条,就足够覆盖样本中所有的微生物菌群,本研究中,土壤样品中细菌和真菌的OTUs丰度稀释度曲线仍未达到平台期,说明仍有小部分低丰度类群未被覆盖。由此表明,土壤菌群多样性比草食动物胃肠道菌群多样性高。本研究发现,在一定范围内,增加生物炭的施用量提高了根际土壤细菌种类的多样性和分布的均匀程度,这和Graber等[20]的研究结果一致,这可能是由于生物炭的多孔性,为细菌在土壤中生长及繁殖提供了更多的空间,从而增加了细菌的数量,同时还调节了土壤环境的物理和化学性质,影响和调节土壤微生物生长、发育和代谢,提高土壤肥力。研究还发现,随着生物炭施用量的增加,根际土壤中真菌OTU丰度、物种丰度及均匀度随之减少;说明在一定范围内,增加生物炭的施用量会降低根际土壤真菌种类的多样性和分布的均匀程度。这与Van Zwieten等[21]的研究结果相一致,生物炭对细菌的增殖有促进作用,使得细菌与真菌的比值增加,向“细菌型”土壤转变,细菌型土壤普遍被认为是土壤肥力提高的标志[22]。土壤真菌种类多样性的降低可能是由于细菌和真菌对pH值有不同的要求,细菌倾向于中性土壤,而真菌则偏爱酸性土壤,已有研究表明,生物炭能提高土壤pH值[23]。有研究表明,生物炭不仅可以提高土壤肥力和pH值,还可以通过影响土壤pH值来提高作物抗病性[24],因为真菌被认为是引起植物土传病害的主要病原物[25],从增加土壤pH值、降低真菌数量和提高细菌真菌数量的特性来看,生物炭也许能成为防治烤烟土传病害的土壤添加剂[26]。PCA主成分分析表明,不施用生物炭的对照处理(t1.1)与施用生物炭的处理(t4.1、t5.1、t6.1)的细菌物种组成有明显差异,这与Grossman等[27]的研究结果相一致,说明生物炭对微生物的群落分布具有一定的控制作用。
研究中发现样品中变形菌门细菌中的一部分序列归属于与线粒体序列具有高度同源性的、未能确定细菌类群(Unidentified_Mitochondria,4.26%),蓝菌门细菌主要分布于与叶绿体序列具有高度同源性的、未能确定细菌类群(Unidentified_Chloroplast,20.34%),这可能是由于采集根际土壤时,混入了部分根系凋落物,或是其他植物残体所致。这与陈泽斌等[28]的研究相一致,出现了“宿主污染”现象,因为植物的叶绿体和线粒体与细菌在系统发育上具有高度的同源性。这也说明选取16S rDNA-V4区作为高通量测序区域的局限性,今后应尝试其他测序区域以避开叶绿体和线粒体的干扰。赵帅等[29]选取16S rDNA的V5~V7区作为高通量测序区,成功解析了盐角草根部内生菌多样性,并没有出现“宿主污染”现象。
研究中发现在属的分类水平,其他(Other)类群相对丰度最高,说明根际土壤样品中微生物种类十分丰富,但绝大多数微生物丰度低;其次还说明采用高通量测序手段对根际土壤微生物的检测灵敏度很高,发现了很多低丰度的类群;也不排除是因为MiSeq测序读长较短(500 bp左右),从而无法将其注释到属的可能性,相信随着测序技术的不断发展,能够测定更长序列,从而在属的水平上鉴定更多种类。
鞘氨醇单胞菌属细菌对芳香化合物具有高代谢能力,是近年来发现的一类新型微生物资源[30]。研究表明,施用生物炭处理后,鞘氨醇单胞菌属细菌的丰度稍有降低,可能是由于土壤中芳香化合物被生物炭吸附导致鞘氨醇单胞菌属细菌缺乏自身代谢所需降解物引起的,这也进一步证实了生物炭具有土壤修复作用。青霉菌属真菌普遍被报道具有杀菌作用,研究发现施用生物炭处理后,青霉菌属真菌丰度比对照处理t1.1明显升高,该属真菌丰度的提高,有助于杀灭根际土壤中的有害病原物,从而提高植物抗土传病害的能力。研究中发现的其他属:Pseudoduganella、Haliangium、金孢子菌属、棘壳孢属等微生物种类,目前有关其功能的研究尚未见报道,仍需要借助传统分离培养方法,获取菌株实体,进一步试验验证。
不施用生物炭的对照处理与施用生物炭的处理的细菌物种组成有明显差异,在一定范围内,增加生物炭的施用量可提高根际土壤细菌种类的多样性和分布的均匀程度,但会降低根际土壤真菌种类的多样性和分布的均匀程度。施用生物炭处理后,变形菌门细菌丰度降低,酸杆菌门细菌的丰度上升,放线菌门细菌、蓝菌门丰度下降,芽单胞菌门细菌丰度基本不变;接合菌门真菌呈现出先降低后升高的趋势,子囊菌门真菌丰度则呈现出先升高后降低的趋势,担子菌门和壶菌门真菌丰度基本不变,但随着生物炭施用量的提高,担子菌门真菌丰度呈现出先上升后降低的趋势,各处理对球囊菌门真菌丰度影响不大。
[1] 齐虹凌,贺国强,李恒全,等.轮作与连作对烤烟不同生育期根际土壤细菌群落结构的影响[J].中国烟草学报, 2015, 21(5): 42-48.
[2] 赵殿峰,徐 静,罗 璇,等.生物炭对土壤养分、烤烟生长以及烟叶化学成分的影响[J].西北农业学报, 2014, 23(3): 85-92.
[3] 陈 尧,郑 华,石俊雄,等.施用化肥和菜籽粕对烤烟根际微生物的影响[J].土壤学报, 2012, 49(1): 198-203.
[4] 宋久洋,刘 领,陈明灿,等.生物质炭施用对烤烟生长及光合特性的影响[J].河南科技大学学报:自然科学版, 2014, 35(4): 68-72.
[5] 李 航,董 涛,王明元.生物炭对香蕉苗根际土壤微生物群落与代谢活性的影响[J].微生物学杂志, 2016, 36(1): 42-48.
[6] 韩光明,孟 军,曹 婷,等.生物炭对菠菜根际微生物及土壤理化性质的影响[J].沈阳农业大学学报, 2012, 43(5): 515-520.
[7] 孙大荃,孟 军,张伟明,等.生物炭对棕壤大豆根际微生物的影响[J].沈阳农业大学学报, 2011, 42(5): 521-526.
[8] 毛家伟,张锦中,张 翔,等.豫东烟区生物炭对烤烟生长发育及经济性状的影响[J].安徽农业科学, 2013, 41(35): 13516-13517.
[9] 叶协锋,李志鹏,于晓娜,等.生物炭用量对植烟土壤碳库及烤后烟叶质量的影响[J].中国烟草学报, 2015, 21(5): 33-41.
[10] 湛方栋,陆引罡,关国经,等.烤烟根际微生物群落结构及其动态变化的研究[J].土壤学报, 2005, 42(3): 488-494.
[11] 赵秋芳,马海洋,王 辉,等.生物炭对香草兰生长及根际土壤微生物的影响[J].湖北农业科学, 2015, 54(22): 5647-5651.
[12] 刘 领,王艳芳,宋久洋,等.生物炭与氮肥减量配施对烤烟生长及土壤酶活性的影响[J].河南农业科学, 2016, 45(2): 62-66.
[13] Caporaso J G, Lauber C L, Walters W A, et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(S): 4516-4522.
[14] Hess M, Sczyrba A, Egan R, et al. Metagenomic discovery of biomass-degrading genes and genomes from cow rumen[J]. Science, 2011, 331(616): 463-467.
[15] Edgar R C, Haas B J, Clemente J C, et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194-2200.
[16] Edgar R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998.
[17] Wang Q, Garrity G M, Tiedje J M, et al. Naive bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267.
[18] Desantis T Z, Hugenholtz P, Larsen N, et al. Greengenes, a chimera-checked 16S rRNA gene database and workbench compatible with ARB[J]. Applied and Environmental Microbiology, 2006, 72(7): 5069-5072.
[19] Gulino L M, Ouwerkerk D, Kang A Y, et al. Shedding light on the microbial community of the macropod foregut using 454-amplicon pyrosequencing[J]. PLoS One, 2013, 8(4): e61463.
[20] Graber E R, MellerHarel Y, Kolton M, et al. Biochar impact on development and productivity of pepper and tomato grown in fertigated soilless media[J]. Plant and Soil, 2010, 337(1/2): 481-496.
[21] Van Zwieten L, Kimber S, Morris S, et al. effects of biochar from slow pyrolysis of papermill waste on agronomic performance and soil fertility[J]. Plant and Soil, 2010, 327(1/2): 235-246.
[22] Steinbeiss S, Gleixner G, Antonietti M. Effect of biochar amendment on soil carbon balance and soil microbial activity[J]. Soil Biology and Biochemistry, 2009, 41(6): 1301-1310.
[23] Matthias C R, Marcel W, Mohamed S, et al. Material derived from hydrothermal carbonization:effects on plant growth andArbuscularmycorrhiza[J]. Applied Soil Ecology, 2010, 45(3): 238-242.
[24] Rondon M A, Lehmann J, Ramírez J, et al. Biological nitrogen fixation by common beans (PhaseolusvulgarisL.) increases with bio-char additions[J]. Biology and Fertility of Soils, 2007, 43(6): 699-708.
[25] Yamato M, Okimori Y, Wibowo I F, et al. Effects of the application of charred bark ofAcaciamangiumon the yield of maize,cowpea and peanut,and soil chemical properties in South Sumatra,Indonesia[J]. Soil Science&Plant Nutrition, 2006, 52(4): 489-495.
[26] Li X, Zhang H, Wu M, et al. Effect of methamidophos on soil fungi community in microcosms by plate count, DGGE and clone library analysis[J]. Journal of Environmental Sciences-China, 2008, 20(5): 619-625.
[27] Grossman J M, O'neill B E, Tsai S M, et al. Amazonian anthrosols support similar microbial communities that differ distinctly from those extant in adjacent, unmodified soils of the same mineralogy[J]. Microbial Ecology, 2010, 60(1): 192-205.
[28] 陈泽斌,李 冰,王定康,等.薄荷内生细菌的多样性及组成分析[J].浙江农业学报, 2016, 28(1): 56-63.
[29] 赵 帅,周 娜,赵振勇,等.基于高通量测序分析盐角草根部内生细菌多样性及动态规律[J].微生物学报, 2016, 56(6): 1000-1008.
[30] 徐慧敏,闫 海,马 松,等.鞘氨醇单胞菌USTB-05对微囊藻毒素的生物降解[J].中国环境科学, 2014, 34(5): 1316-1321.
