慢病毒介导稳定表达FABP4的小尾寒羊成纤维细胞系的构建
2018-03-15滑留帅朱肖亭陈付英楚秋霞辛晓玲徐照学赵洪昌王二耀
滑留帅,王 璟,白 杰,朱肖亭,陈付英,于 翔,楚秋霞,辛晓玲,徐照学,赵洪昌,王二耀
(河南省农业科学院 畜牧兽医研究所,河南省畜禽繁育与营养调控重点实验室,河南 郑州 450002)
随着动物转基因技术的不断进步和发展,转基因动物在家畜改良、医药卫生、生物制药等方面均具有广阔的应用前景[1-2]。慢病毒载体作为一类来源于逆转录病毒的载体,能够将目的基因整合到宿主细胞染色体中,长期稳定表达外源基因,同时其具备转染效率高、可感染分裂期和非分裂期细胞、容纳外源性基因片段大等优点,是制备转基因动物的一种高效工具[3-4]。
脂肪酸结合蛋白4(Fatty acid binding protein 4,FABP4)是脂肪酸结合蛋白超家族的一员,能够促进脂肪酸的代谢和转运,调控脂类生成及降解,从而对于畜禽肉品的嫩度和肌内脂肪含量具有重要的调控作用[5-6]。FABP4基因中的多个单核苷酸多态性(SNPs)被证明与家畜的肌内脂肪含量和肉质显著相关[7-8]。在肌肉来源的干细胞中(MDSCs)异位表达FABP4,能够诱导MDSCs向类脂肪细胞转化[9]。利用体细胞核移植获得FABP4转基因牛,目前健康状况良好,外源性FABP4基因在体内能够正常表达,且转基因牛FABP4表达量较野生型大幅升高,说明动物活体内过表达FABP4未发现明显的有害作用[5]。这些相关的研究证据均证明,FABP4基因可以作为转基因动物研究的重要候选基因,用于高效改良畜禽的肉品品质。
小尾寒羊是在黄淮平原农区特定的生态条件下,经过自然选择和培育形成的肉、裘兼用品种,具有生长发育快、早熟、繁殖能力强、遗传性能稳定、适应性强,被定为名畜良种,并被列入了《国家畜禽遗传资源保护目录》[10]。利用转基因技术制备FABP4转基因小尾寒羊对于小尾寒羊未来的品种保护、开发与利用具有重要的意义。
本研究拟通过制备小尾寒羊原代成纤维细胞、构建FABP4基因慢病毒表达载体,进而制备稳定表达FABP4基因的小尾寒羊成纤维细胞系,旨在为转基因羊育种以及细胞水平分析FABP4基因的功能提供材料。
1 材料和方法
1.1 小尾寒羊耳缘组织原代成纤维细胞的制备
1.1.1 小尾寒羊耳缘组织样品的采集 试验动物在河南现代农业研究开发基地养殖,耳缘组织样品采集方法为:①用肥皂水和生理盐水彻底清洗采样部位;②用手术刀片将采样部位的毛刮掉,使耳缘组织裸露;③分别使用碘酊棉球和酒精棉球对采样部位消毒;④使用耳缺钳或剪刀将采样部位取下,迅速放入PBS溶液中清洗血污;⑤将组织块转入75%的乙醇中浸泡20 s;⑥转入含青链霉素的PBS溶液中清洗3遍;⑦将组织块转入含青链霉素的1×DMEM培养基中,室温下6 h内带入实验室。
1.1.2 应用组织块法培养小尾寒羊原代成纤维细胞 将组织样品带入实验室后,原代成纤维细胞的培养方法为:①首先使用手术刀片对组织样品进行修剪,去除残留的毛和血污;②将组织块在75%的乙醇中浸泡20 s;③用含青链霉素的PBS溶液清洗3次;④将组织块转入2 mL EP管中,用眼科剪将组织块剪成小于1 mm3的小组织块,剪时加入1/2组织块体积的高血清培养基(1×DMEM,20%的血清,1×青链霉素);⑤将剪碎的组织块均匀贴在60 mm或100 mm的培养皿中;⑥37 ℃、5% CO2培养4 h;⑦加入适量的高血清培养基;⑧每48 h换液一次,直至细胞在组织块周围汇合形成单层。
1.1.3 传代与冻存 待培养皿内的原代细胞形成单层时,用胰蛋白酶溶液(0.05% Trypsin-EDTA,Gibco:25300-054)将成纤维细胞从培养皿上消化下来,进行传代培养。避免消化时间过长,否则可能会将贴壁更牢的上皮细胞同时消化下来,造成污染。传代后的培养条件为:完全培养基(1×DMEM,10%的血清,1×青链霉素)、37 ℃、5% CO2。等传代后的细胞生长至80%汇合度,及时进行冻存,冻存液的配方为:40% DMEM培养基、10% DMSO和50%的血清。
1.2 过表达FABP4基因慢病毒载体的构建
1.2.1 羊FABP4基因的克隆 使用全基因合成的方法获得绵羊FABP4基因的CDS全长,参考序列为NCBI:NM_001114667。序列合成时在翻译起始位点(ATG)上游添加了Kozak序列和限制性内切酶切位点EcoRⅠ,添加的序列为:5′-CCGGAATTCC
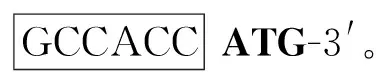
1.2.2 慢病毒载体的构建 使用的慢病毒载体为PEB-GP(辉骏生物,广州),载体的主要结构为:CMV-MCS-EF1-copGFP-T2A-Puro。首先分别使用限制性内切酶EcoRⅠ和BamHⅠ双酶切目的基因质粒puc57-FABP4和慢病毒载体PEB-GP,胶回收纯化后使用T4连接酶将FABP4基因片段和PEB-GP片段连接为PEB-GP-FABP4,将连接产物转入感受态细胞中,筛选阳性克隆后测序,测序引物为,CMV-F:5′-CGCAAATGGGCGGTAGGCGTG-3′。
1.2.3 慢病毒的包装 首先在完全培养基(1×DMEM,10% FBS,1×青链霉素)中将293T细胞培养至80%汇合度。然后用转染试剂脂质体2000(Invitrogen,11668-027)将包装质粒(pLP1、pLP2、pLP/VSVG)与表达质粒(PEB-GP-FABP4)共转染293T细胞。转染前2 h换液为无抗性培养基(1×DMEM,10% FBS);转染时质粒pLP1、pLP2、pLP/VSVG和PEB-GP-FABP4的使用量为每100 mm培养皿分别添加6.5,3.5,3.5,12.0 μg;转染4~6 h后换液为低血清培养基(1×DMEM,2% FBS,1×青链霉素);转染48,72 h后分别收集上清,3 000 r/min 4 ℃离心10 min,取上清用0.45 μm微孔滤器过滤后-80 ℃保存。
1.2.4 慢病毒滴度测定 采用逐孔稀释法测定慢病毒的滴度,步骤为:①滴度测定前1 d,将293T细胞接种至96孔板中,每孔的细胞数目约为1.0×104个,培养基体积为100 μL。②取10个无菌的EP管,每管加入90 μL新鲜的完全培养基,之后取10 μL病毒原液加入第一个EP管中,混匀后从中吸取10 μL加入第二个EP管中;以此类推,将病毒原液依次地进行10倍稀释。③每个细胞培养孔小心吸去10 μL培养基(共10个孔),之后分别加入稀释好的病毒液10 μL,其中第一孔相当于添加了病毒原液1 μL。④将接种好病毒的细胞培养板放回37 ℃、5% CO2培养箱中,48 h后,每孔分别加入新鲜培养基100 μL。⑤96 h后观察荧光表达情况,数出最后2个含有荧光细胞的孔中的荧光细胞个数;病毒原液的滴度值=荧光细胞个数/稀释后的病毒量。若第6个孔的发光个数为3个,则病毒液的滴度为3×103/10-5=3×108(TU/mL)。
1.3 慢病毒介导稳定表达FABP4基因的小尾寒羊成纤维细胞系的构建
1.3.1 慢病毒感染细胞 在6孔板内接种小尾寒羊原代成纤维细胞,待细胞生长至50%汇合度时,进行慢病毒感染。操作步骤:①冰浴解冻慢病毒;②用无血清培养基1∶1稀释病毒液;③去除6孔板内的培养基,加入稀释过的病毒液,同时在培养基中加入8 μg/mL的Ploybrene;④在培养箱内培养4 h后,更换为完全培养基;⑤在培养箱中培养48 h后,在倒置荧光显微镜下观察荧光并检测感染效率。
1.3.2 嘌呤霉素筛选稳定转染细胞 操作步骤:①慢病毒感染细胞48 h后,更换为新的培养基,同时在培养基中添加5 μg/mL的嘌呤霉素;②每48 h更换新的添加抗生素的培养基,直至细胞不再大量死亡,且在荧光显微镜下所有细胞均能观察到绿色荧光;③然后更换为含1 μg/mL嘌呤霉素的完全培养基继续扩大培养,扩大培养后的细胞系在液氮中冻存备用。
1.3.3 利用Western Blot鉴定FABP4基因的表达水平 操作步骤:①制备样品。复苏细胞,等细胞生长至80%汇合度时,收获细胞,使用RIPA裂解液和PMSF裂解细胞,然后使用BCA蛋白浓度测定试剂盒测定样品中的蛋白浓度,并调整试验样品和对照组为同一浓度。②电泳。制备10%的SDS-PAGE分离样品。③转膜。电泳结束后,将凝胶从玻璃板中取出,然后按照转膜仪操作要求,将凝胶中的蛋白转移至PVDF膜上。④封闭。取出蛋白膜置于封闭液中,在37 ℃ 260 r/min,封闭1 h。⑤一抗孵育。将封闭过的蛋白膜置于稀释过的一抗中(兔源FABP4一抗:生工D220618;鼠源GAPDH一抗:生工D190090),在37 ℃ 260 r/min,孵育1 h。⑥二抗孵育。将一抗孵育过的蛋白膜置于稀释过的二抗中(HRP标记的羊抗兔IgG:生工D110058;HRP标记的羊抗鼠IgG:生工D110087),在37 ℃ 260 r/min,孵育1 h。⑦显影。使用ECL化学发光试剂盒(碧云天P0018)进行显影,然后使用成像系统进行拍照。
2 结果与分析
2.1 小尾寒羊原代成纤维细胞系的制备
组织块在培养箱中培养3 d后,能够观察到零星的细胞从组织块周围游出,第4天后在大部分组织块周围均能够观察到细胞簇存在,细胞呈长梭形,立体感强(图1-A)。继续培养4 d后,成纤维细胞可围绕组织块形成单层。用胰蛋白酶在37 ℃消化5 min后,能够观察到成纤维细胞缩成圆形并成片脱落,但上皮细胞仍然继续贴壁(图1-B),因此,根据成纤维细胞与上皮细胞对胰蛋白酶敏感性的差异,消化时及时收获细胞能够将成纤维细胞进行分离纯化。收获的细胞继续传代2~3次后,得到了较纯的小尾寒羊原代成纤维细胞(图1-C)。
2.2 绵羊FABP4基因的克隆及慢病毒载体的构建
利用全基因合成方法获得了绵羊FABP4基因的CDS区全长片段,合成后的片段被克隆至puc57质粒,对puc57-FABP4质粒进行测序表明,合成的序列与模板序列完全一致,没有突变,FABP4基因CDS区全长为399 bp,编码132个氨基酸。
用限制性内切酶EcoRⅠ和BamHⅠ分别双酶切质粒puc57-FABP4和慢病毒质粒PEB-GP后,通过胶回收和T4连接酶连接,将FABP4基因片段亚克隆至PEB-GP中,成功构建了慢病毒载体PEB-GP-FABP4,对载体的双酶切鉴定图谱见图2。同时对质粒PEB-GP-FABP4进行测序表明,亚克隆过程没有发生序列变异。

A.组织块培养4 d;B.胰蛋白酶消化原代细胞;C.传代后的原代细胞。A.Tissue culture for 4 days; B.Digestion of the primary fibroblasts by trypsin; C.Primary fibroblasts after passage.
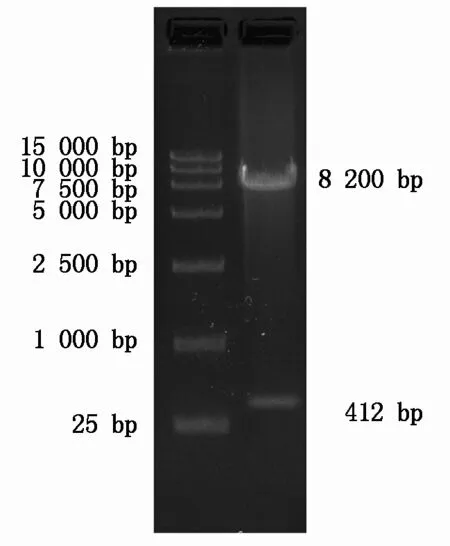
使用EcoR Ⅰ和BamH Ⅰ双酶切后质粒呈现2条带,其中8 200 bp的条带为慢病毒质粒骨架,412 bp的条带为FABP4基因片段。
The vector displays two bands after digestion byEcoRⅠ andBamHⅠ,in which the band of 8 200 bp is the backbone of the lentiviral vector,while the band of 412 bp is theFABP4 fragment.
图2慢病毒载体PEB-GP-FABP4的双酶切鉴定
Fig.2VerificationofthelentiviralvectorPEB-GP-FABP4bydoubleenzymedigestion
2.3 获得了高滴度的FABP4过表达慢病毒
将慢病毒载体PEB-GP-FABP4和包装质粒(pLP1、pLP2、pLP/VSVG)用转染试剂共转染293T细胞后,分别在48,72 h收集了上清液,离心和过滤后进行了慢病毒滴度测定。测定结果表明,当在96孔板中添加病毒原液量为10-4μL时,观测不到荧光。当添加量为10-3μL,能够观测到荧光,说明获得慢病毒的滴度为1×106TU/mL以上(图3)。
2.4 稳定表达FABP4的小尾寒羊成纤维细胞系的制备
用制备的慢病毒感染小尾寒羊原代成纤维细胞48 h后,观察荧光表明,大约70%以上的细胞能够观察到绿色荧光,说明制备的慢病毒对小尾寒羊原代成纤维细胞具有较高的感染效率(图4-A1、A2)。在培养基中添加5 μg/mL的嘌呤霉素后,24 h能够观察到部分细胞死亡,继续加药筛选48 h后,细胞状态趋于稳定,不再观察到大量的细胞死亡现象。用含1 μg/mL嘌呤霉素的完全培养基继续培养并传代2次后,在荧光显微镜下所有的细胞均能观察到绿色荧光(图4-B1、B2)。利用Western Blot检测了细胞中FABP4蛋白的表达水平,结果表明,在对照组几乎检测不到FABP4的表达,而在病毒感染组则能够清晰的观察到FABP4蛋白的表达,说明成功获得了稳定表达FABP4的小尾寒羊成纤维细胞系(图4-C1、C2)。
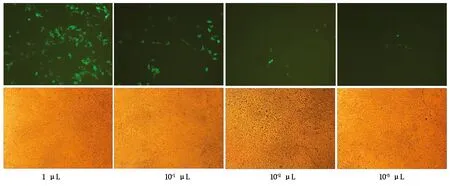
第1行和第2行分别是添加不同量的病毒液后,96 h时观察的荧光照片和白场照片。The first row and the second row displays the fluorescent and white field photograph 96 hours after infected by different amounts of viral fluid,respectively.

A1、A2.慢病毒感染小尾寒羊成纤维细胞系48 h后的荧光表达和白场照片(×40);B1、B2.用嘌呤霉素筛选后的荧光表达和白场照片(×40);C1.应用Western Blot鉴定对照组和病毒感染组中FABP4蛋白的表达情况;C2.内参基因GAPDH在对照组和病毒感染组中的表达情况。
A1,A2.The fluorescent and white field photograph of the fibroblasts 48 hours after infected by lentivirus (×40); B1,B2.The fluorescent and white field photograph of the fibroblasts purified by puromycin(×40); C1.Expression identification of the FABP4 in the virus infection group and the control group by Western Blot.C2.The expression of theGAPDHin the virus infection group and the control group.
图4慢病毒介导稳定表达FABP4基因的小尾寒羊成纤维细胞系的构建与鉴定
Fig.4ConstructionandidentificationofthestablyexpressingFABP4fibroblastsfromtheSmall-tailedHansheep
3 讨论与结论
随着我国畜牧业的发展,生产水平不断提高,肉类生产数量的也在不断提高,肉类的研究更加注重肉质的改善。家畜肉品质评价指标主要有:大理石花纹、色泽、嫩度、多汁性、风味、系水力、pH值等。其中,大部分评价指标均与脂肪组织的生长发育相关。提高肉品质中肌内脂肪含量,对于提高肉品质具有重要的作用[11-12]。FABP4是一类分子质量较小、对脂肪酸有高亲和力的可溶性蛋白质,是细胞内重要的脂肪酸载体蛋白,广泛参与脂肪酸的吸收、转运和代谢。FABP4主要在动物脂肪组织中高表达,被认为与家畜大理石花纹、脂肪沉积、胴体重量以及牛肉风味、脂肪酸组成等性状密切相关[13-15]。本研究选择FABP4作为候选基因,预期能够提高未来转基因绵羊的肌内脂肪含量,从而提高肉品品质。同时本研究选择了全基因合成的方法来克隆绵羊的FABP4基因,通过基因合成后测序、慢病毒载体构建后测序以及Western Blot分析,均证明克隆的序列是正确的,且在细胞内能够正确表达。提示除了传统的RT-PCR或Overlap-PCR[16],全基因合成为便捷的获得一些序列确定的基因提供了新的选择。
小尾寒羊是我国优良的地方绵羊品种,生产性能优越、适应性强,因此在国内被广泛引种和推广[10]。本研究利用组织块培养法制备了小尾寒羊的原代成纤维细胞,为小尾寒羊未来的种质资源保护和种质创新提供了素材。通常原代细胞培养法主要有2种:消化培养法和组织块培养法。其中,消化培养法能够把组织块直接分散为细胞团或单个细胞,从而大大缩短细胞的潜伏生长期,获得原代细胞的周期较短,但是其操作步骤繁琐,容易造成污染;组织块培养法细胞生长速度虽然较慢,但是操作便捷,且成功率高,适用于大规模的细胞培养[17]。通过采用本研究中的组织块培养方法,河南省农业科学院畜牧兽医研究所动物繁殖生物工程研究团队已经成功制备50多个包括牛、羊、猪、驴等物种的细胞系,从而对其他物种细胞系构建工作具有参考价值。
随着基因编辑技术的不断进步,转基因动物的制备方法也越来越多样。尤其是近年来CRISPR Cas9技术在转基因研究中的广泛应用,有取代其余技术的趋势[18]。但是慢病毒作为一种传统的转基因技术,仍然有一些独特的优势。首先,慢病毒具有主动整合目的基因进入宿主基因组的特性,因此能够高效感染多种细胞类型,尤其是在原代细胞操作和基因治疗时有明显的优势。其次,制备好的慢病毒载体具有通用性,其不仅能够感染细胞、胚胎等不同的细胞类型,还能够感染不同的物种,对于跨物种研究具有优势。同时,慢病毒操作成熟、简单,目前的慢病毒制备技术已经非常稳定,对于快速开展细胞水平以及转基因动物水平上功能验证仍然是一个高效的工具[3-19]。本研究成功包装了过表达FABP4的慢病毒,直接包装获得的慢病毒滴度为1×106TU/mL,与其他研究的滴度水平相一致[20-21]。高滴度的病毒颗粒对于下游应用时提高感染效率具有重要的意义,因此,在慢病毒包装时,需要对细胞状态、质粒比例、病毒收获时间进行优化,以尽量提高病毒的滴度。如果需要更高的病毒滴度,如对受精卵注射等操作时也可以采用对慢病毒进行浓缩处理。但由于慢病毒在包装及感染过程中具有潜在的生物安全问题,操作必须严格规范,所用物品及废液都要经过灭活处理。使用重组FABP4基因慢病毒感染小尾寒羊成纤维细胞后,应用Western Blot分析发现,在对照组几乎检测不到FABP4蛋白的表达,而在病毒感染组则能够清晰的观察到FABP4蛋白的表达,说明成功制备了稳定表达FABP4的小尾寒羊成纤维细胞系,从而为小尾寒羊未来的种质创新提供了素材。
[1] 郑 钰,赵 杰,李 宁.转基因动物技术及其应用进展[J].生物产业技术,2014,1(1):7-16.
[2] 李若楠,张彦才.转基因动物技术及其应用[J].华北农学报,2007,22(S):181-184.
[3] 张 曼,孙秀萍,宋铭晶.慢病毒载体用于转基因技术的研究进展[J].中华临床医师杂志:电子版,2014,8(10):1949-1953.
[4] 王淑艳,张 愚.慢病毒载体的设计及应用进展[J].中国生物工程杂志,2006,26(11):70-75.
[5] 赵敬贤,李 娟,严兴荣,等.FABP4转基因牛的分子生物学鉴定[J].中国农业科学,2014,47(24):4895-4903.
[6] 魏胜娟,昝林森,王洪宝,等.秦川牛FABP4基因重组腺病毒载体的构建与鉴定[J].中国农业科学,2013,46(7):1434-1440.
[7] Matsumoto H,Nogi T,Tabuchi I,et al.The SNPs in the promoter regions of the bovineFADS2 andFABP4 genes are associated with beef quality traits[J].Livestock Science,2014,163(2014):34-40.
[8] Yonekura S,Hirota S,Miyazaki H,et al.Subcellular localization and polymorphism of bovineFABP4 in bovine intramuscular adipocytes[J].Animal Biotechnology,2016,27(2):96-103.
[9] Zhang L,Zhao Y F,Ning Y E,et al.Ectopical expression ofFABP4 gene can induce bovine muscle-derived stem cells adipogenesis[J].Biochemical and Biophysical Research Communications,2017,482(2):352-358.
[10] 岳文斌,常 红,贾兆玺,等.小尾寒羊的品种特性及利用途径[J].山西农业大学学报,2001,21(3):209-211.
[11] 滑留帅.牛SHH基因通过PPARg通路调控脂肪生成[D].杨凌:西北农林科技大学,2012.
[12] 栾兆进,曲绪仙,贺建宁,等.羊肌内脂肪调控研究进展[J].家畜生态学报,2014,35(9):8-13.
[13] Michal J J,Zhang Z W,Gaskins C T,et al.The bovine fatty acid binding protein 4 gene is significantly associated with marbling and subcutaneous fat depth in Wagyu×Limousin F2crosses[J].Animal Genetics,2006,37(4):400-402.
[14] Gerbens F,Verburg F J,Van Moerkerk H T,et al.Associations of heart and adipocyte fatty acid-binding protein gene expression with intramuscular fat content in pigs[J].Journal of Animal Science,2001,79(2):347-354.
[15] Hoashi S,Hinenoya T,Tanaka A,et al.Association between fatty acid compositions and genotypes of FABP4 and LXR-alpha in Japanese Black cattle[J].BMC Genetics,2008,9(1):84.
[16] 张 丽,张良志,张爱玲,等.Overlap-PCR克隆秦川牛HCRTR1基因及其在大肠杆菌中的表达[J].农业生物技术学报,2008,16(4):568-572.
[17] 关伟军,马月辉,丁 鸿,等.小尾寒羊耳组织成纤维细胞系的建立与生物学特性研究[J].畜牧兽医学报,2005,36(5):511-516.
[18] Cong L,Ran F A,Cox D,et al.Multiplex genome engineering using CRISPR/Cas systems[J].Science,2013,339(6121):819-823.
[19] 蔡伟光,习欠云,肖 敏,等.精子与慢病毒共孵育条件的优化以及转基因猪的制备[J].中国农业科学,2013,46(9):1903-1914.
[20] 欧阳曼,王海龙,赵 影,等.过表达FGFR2重组HEK293细胞株的构建和鉴定[J].中国医药工业杂志,2017,48(1):38-42.
[21] 唐大运,朱化彬,吴健敏,等.Myostatin基因沉默绵羊成纤维细胞系的建立[J].畜牧兽医学报,2011,42(10):1368-1373.
