六例对称性肢端角化病的透射电镜观察
2018-03-15周英王思捷吴亚运黎世杰黎兆军张国学樊翌明
周英 王思捷 吴亚运 黎世杰 黎兆军 张国学 樊翌明
524001广东湛江,广东医科大学附属医院皮肤科(周英、吴亚运、黎世杰、黎兆军、张国学、樊翌明),电镜室(王思捷)
对称性肢端角化症(symmetrical acrokerato⁃derma,SAK)是我国学者于2008年首次描述的皮肤病[1⁃2],截至2015 年我国共报道212 例 SAK[3]。SAK病因与发病机制不明,超微结构研究较少[4⁃5]。我们用透射电镜观察6例SAK患者腕部皮损及其周围外观正常皮肤超微组织病理变化。
资料与方法
一、临床资料
6例SAK初诊患者中男5例,女1例,年龄19~48岁,病程0.7~10.7年,5例伴发寻常型鱼鳞病。SAK诊断根据临床特征和病理检查[1⁃4]。6例在双侧腕部出现浅褐色至黑褐色角化过度性斑片,其中5例累及踝部,3例累及手足背、膝、肘部(图1A)。皮损浸水或出汗后变白,干燥后逐渐恢复正常。5例皮损夏季出现,冬季消失。1例有轻微瘙痒。皮损组织病理检查显示表皮角化过度,颗粒层减少,不规则或银屑病样棘层增厚,真皮浅层小血管周围以淋巴细胞为主炎症细胞浸润(图1B)。患者皮损及其周围外观正常皮肤、正常皮肤均在腕部进行活检。3例正常男性来自本单位学生及青年医生志愿者,年龄25~27岁。本研究通过广东医科大学附属医院医学伦理委员会批准,所有入选者均签署知情同意书。
二、方法
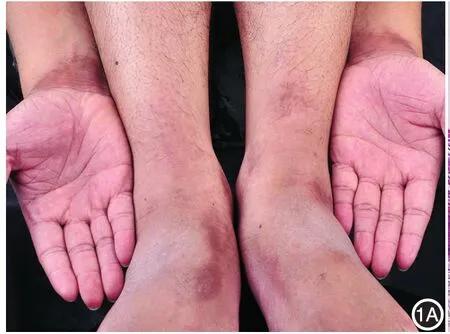
图1A 患者褐色至黑色角化过度性斑片对称分布于腕、踝、足背
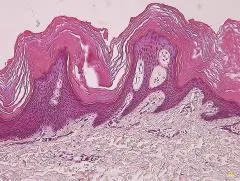
图1B 皮损组织病理 表皮角化过度,颗粒层减少,棘层增厚,真皮浅层小血管周围以淋巴细胞为主炎症细胞浸润(HE × 100)
皮肤活检标本用3%戊二醛4℃固定4 h,二甲砷酸钠缓冲液冲洗3次。1%锇酸4℃固定2 h,二甲砷酸钠缓冲液冲洗2次。饱和醋酸铀溶液染色2 h。梯度乙醇脱水,室温丙酮渗透,Eponate12树脂包埋。UC7型超薄切片机(德国Leica公司)切片,切片厚度90 nm。JEM⁃1400型透射电子显微镜(日本电子株式会社)观察,工作电压80 kV。
结 果
一、SAK皮损超微结构
见表1,图2。角质层共有23~41(平均33.4)层,角化细胞(corneocyte)形态不规则,中上部细胞排列杂乱、间隙增大,角化包膜(cornified envelope)不连续,黑素颗粒增多,角化桥粒(corneodesmosome)较少。角质层与颗粒层移行区可见较多大小不等的空泡,可能是脂质溶解形成。颗粒层由1~2层角质形成细胞(KC)组成,胞质中角蛋白细丝粗细不一,排列紊乱;透明角质颗粒形态不规则,黑素颗粒常见,被膜颗粒(membrane⁃coating granule)少见。棘层KC胞质中角蛋白细丝明显聚集、排列紊乱,靠近胞核,桥粒较少;Langerhans细胞(LC)偶见,核不规则,核沟明显,胞质内有丰富线粒体,未见典型Birbeck颗粒。基底层中KC胞质内有较多角蛋白细丝、黑素颗粒,基底膜带完整,可见清晰的半桥粒;黑素细胞与KC比值平均为1∶6.2,胞质中含有大量Ⅳ期黑素小体。真皮浅层中成纤维细胞和胶原纤维无明显异常,可见少数淋巴细胞浸润。

表1 6例SAK患者皮损及其周围皮肤、3例正常皮肤的超微结构变化
二、SAK皮损周围外观正常皮肤超微结构
见表1,图3。角质层共有20~32(平均28.6)层,角化细胞形态较规则,中上部细胞排列较杂乱、间隙增大,角化包膜基本连续,黑素颗粒较少,角化桥粒较多。颗粒层由2~3层KC组成,胞质中角蛋白细丝粗细比较一致,排列较紊乱;透明角质颗粒形态不规则,黑素颗粒常见,被膜颗粒少见。棘层KC内角蛋白细丝增粗、排列较紊乱,有较多黑素颗粒和典型桥粒;可见个别LC,胞质内有丰富线粒体和Birbeck颗粒。基底层KC胞质内角蛋白细丝排列较杂乱,黑素颗粒较少;基底膜带完整,由半桥粒、透明板、致密板及锚原纤维组成;黑素细胞与KC比值平均为1∶9.6,胞质中含有较多Ⅲ、Ⅳ期黑素小体。真皮浅层中成纤维细胞和胶原纤维无明显异常,偶见个别淋巴细胞浸润。
三、正常皮肤超微结构
见表1,图4。角质层共有15~17(平均16)层,角化细胞形态规则,角化包膜连续,黑素颗粒较少,角化桥粒较多。颗粒层由3~4层KC组成,胞质中角蛋白细丝粗细基本一致,相互交织成网状;透明角质颗粒大小较一致、形态规则,被膜颗粒多见,黑素颗粒和桥粒少见。棘层KC内角蛋白细丝相互交织、排列规则,有较多黑素颗粒和典型桥粒;单个LC核不规则,核沟明显,未见Birbeck颗粒。基底层KC胞质内角蛋白细丝排列规则,黑素颗粒较少,基底膜带完整;黑素细胞与KC比值平均为1∶11,胞质中含有较多Ⅲ、Ⅳ期黑素小体。真皮浅层中成纤维细胞和胶原纤维正常,未见炎症细胞;真皮乳头层中可见1个有髓神经纤维,由Schwann细胞包绕几个轴突形成,轴突内含有线粒体和小泡。

图2 对称性肢端角化病皮损超微结构 2A(×5 000)、2B(×30 000):角质层层数增多,角质形成细胞形态不规则,中上部细胞排列杂乱、间隙增大,角化包膜不连续,黑素颗粒(2A右上图箭头)增多,角化桥粒(2B右上图箭头)较少;角质层与颗粒层移行区可见较多大小不等空泡。2C(×30 000):颗粒层中透明角质颗粒(红色箭头)形态不规则,角蛋白细丝(黄色箭头)粗细不一、排列凌乱,被膜颗粒(右上图箭头)少见。2D(× 8 000)、2E(× 30 000):棘层中角质形成细胞内角蛋白细丝(右上图箭头)异常聚集,靠近胞核。2F(× 8 000)、2G(× 30 000):基底层中角质形成细胞(2F绿色箭头)内有较多角蛋白细丝、黑素颗粒,可见半桥粒(2F红色箭头);Langerhans细胞(2G红色箭头)核不规则,核沟明显,胞质内有丰富线粒体;黑素细胞(2F黄色箭头)中含有大量Ⅳ期黑素小体;真皮中成纤维细胞和胶原纤维无明显异常。2H(×8 000):基底膜带完整,半桥粒(红色箭头)清晰;真皮浅层中淋巴细胞(黄色箭头)浸润,成纤维细胞和胶原纤维未见异常
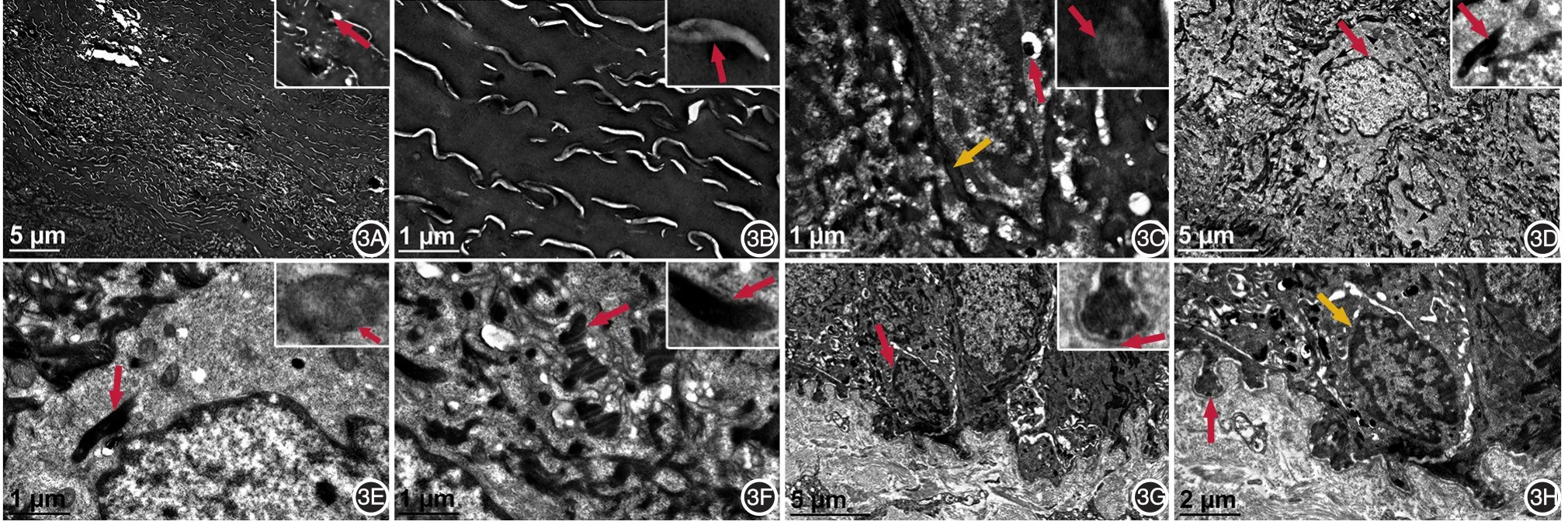
图3 对称性肢端角化病皮损周围外观正常皮肤的超微结构 3A(×5 000)、3B(×30 000):角质层层数增多,角质形成细胞形态较规则,中上部细胞排列较杂乱、间隙增大,角化包膜基本连续,黑素颗粒(3A右上图箭头)较少,角化桥粒(3B右上图箭头)较多。3C(×30 000):颗粒层中透明角质颗粒(红色箭头)形态不规则,角蛋白细丝(黄色箭头)粗细较一致、排列较紊乱,被膜颗粒(右上图箭头)少见。3D(×8 000)、3E(×30 000):棘层中角质形成细胞内角蛋白细丝排列较紊乱;Langerhans细胞(3D红色箭头)胞质内有丰富线粒体(3E右上图)和1个Birbeck颗粒(3D右上图箭头,3E红色箭头),核不规则、核沟明显。3F(×30 000):棘层中角质形成细胞内角蛋白细丝(右上图箭头)排列较紊乱,有较多黑素颗粒和典型桥粒(红色箭头)。3G(×8 000)、3H(×30 000):基底层中角质形成细胞内角蛋白细丝排列较杂乱;基底膜带完整,半桥粒(3G右上图箭头,3H红色箭头)清晰;黑素细胞(3G红色箭头,3H黄色箭头)中含有较多Ⅲ、Ⅳ期黑素小体;真皮浅层中成纤维细胞和胶原纤维无明显异常

图4 正常皮肤超微结构 4A(×8 000)、4B(×30 000):角质层层数较少,角质形成细胞形态规则,角化包膜连续,黑素颗粒(4A右上图箭头)较少,角化桥粒(4B右上图箭头)较多。4C(×30 000):颗粒层中透明角质颗粒(红色箭头)大小较一致、形态规则,角蛋白细丝(黄色箭头)粗细基本一致、交织成网状,被膜颗粒(右上图箭头)多见。4D(×8 000):棘层中角质形成细胞(红色箭头)内角蛋白细丝排列规则,黑素颗粒常见;Langerhans细胞(黄色箭头)核不规则,核沟明显。4E(×15 000):棘层中角质形成细胞内角蛋白细丝(右上图箭头)排列规则,有较多黑素颗粒和典型桥粒(红色箭头)。4F(×8 000)、4G(×15 000):基底层中角质形成细胞内角蛋白细丝排列规则;基底膜带完整,半桥粒(4F右上图,4G黄色箭头)清晰;黑素细胞(4F红色箭头,4G红色箭头)中含有较多Ⅲ、Ⅳ期黑素小体;真皮浅层中成纤维细胞和胶原纤维无明显异常。4H(×30 000):基底膜带完整,半桥粒(黄色箭头)清晰;真皮浅层中可见有髓神经纤维(红色箭头),由Schwann细胞包绕几个轴突(右上图箭头)形成
讨 论
SAK主要超微病理特征是角质层明显增厚,颗粒层减少,角化包膜不连续,表皮各层角蛋白细丝聚集和排列异常,颗粒层中透明角质颗粒形态及大小异常,真皮浅层中淋巴细胞浸润,这些结果与既往报道基本一致[4⁃5]。此外,我们还发现被膜颗粒减少或消失,此发现既往未见报道。Li等[4]发现1例SAK皮损周围外观正常皮肤中角蛋白细丝异常聚集仅见于角质层,而本研究显示皮损周围外观正常皮肤具有皮损相似的超微病理变化,只是程度较轻,说明这些外观正常皮肤已发生病变。
丝聚蛋白基因功能缺失突变导致寻常型鱼鳞病皮损中角化过度、颗粒层减少、透明角质颗粒减少或缺乏,但仅有轻度表皮屏障功能障碍[6]。SAK一般伴有寻常型鱼鳞病个人史或家族史[7],本组中有5例合并寻常型鱼鳞病,但这些病例是否存在丝聚蛋白基因突变未见报道。颗粒层细胞质内透明角质颗粒由角蛋白(主要为K1、K10)与丝聚蛋白原形成,在转变为角化细胞时透明角质颗粒逐渐消失,而去磷酸化的丝聚蛋白原裂解为丝聚蛋白单体[8]。角化包膜是在谷氨酰胺转移酶交联作用下,由角蛋白和表皮分化复合体蛋白(如丝聚蛋白、外皮蛋白、兜甲蛋白、富含脯氨酸小蛋白、S100A蛋白等)沉积于细胞膜内侧形成,逐步替换细胞膜,并作为脂质板层附着的支架[9⁃10]。本研究及田歆等[5]的结果显示,SAK皮损中角蛋白细丝异常聚集,角化包膜不连续,透明角质颗粒形态不规则。我们发现,这些超微结构变化在伴有或不伴有寻常型鱼鳞病患者中未见显著差异。结果提示本病与寻常型鱼鳞病有不同发病机制,可能主要为角蛋白和(或)表皮分化复合体蛋白代谢异常所致。
被膜颗粒(又称板层小体或Odland小体)在棘层上部和颗粒层KC中由Golgi体合成,含有糖脂、磷脂、胆固醇、酶类,位于细胞膜内侧;在KC移行至颗粒层最上层时,被膜颗粒与细胞膜融合并将内容物释放至细胞间隙;被膜颗粒分泌的极性脂质转变为非极性脂质,形成脂质板层,填充于角化细胞间隙[8,11]。本研究显示,SAK皮损中被膜颗粒减少,角质层与颗粒层移行区有许多大小不等的空泡。鉴于锇酸后固定使角质层细胞间隙呈现空白[12],这些空泡可能是脂质溶解所致。同时,SAK皮损中皮脂含量明显降低[13],而脂肪酸结合蛋白5表达增加[3]。这些结果提示本病存在局部脂质代谢异常。
本研究显示,基底层黑素细胞及胞质内Ⅳ期黑素小体增多,表皮各层中黑素颗粒增多。Li等[4]发现棘层和基底层中黑素颗粒增多。这些结果提示,本病皮损色素沉着可能是黑素细胞增生及成熟黑素小体增多所致。综上所述,本病皮损中可能存在角蛋白、表皮分化复合体蛋白及脂质代谢异常,从而导致表皮增厚及屏障功能受损,但具体发病机制及其与寻常型鱼鳞病关系有待进一步研究。
志谢南京总医院病理科吴波教授
[1]姜袆群,曾学思,薛燕宁,等.对称性肢端角化病—一种新命名的皮肤病[J].临床皮肤科杂志,2008,37(7):428⁃430.
[2]朱晓浚,李希清,杨容青,等.表现为色素性对称性肢端角化性皮损的一组患者临床分析[J].中华皮肤科杂志,2008,41(8):539⁃541.
[3]杨珮珮,彭晶,于作忠,等.对称性肢端角化病皮损中脂肪酸结合蛋白5及二氢硫辛酰胺脱氢酶表达[J].中华皮肤科杂志,2015,(12):844 ⁃848.doi:10.3760/cma.j.issn.0412 ⁃4030.2015.12.004.
[4]Li CX,Wen J,Zeng K,et al.Ultrastructural study of symmetrical acral keratoderma[J].Ultrastruct Pathol,2014,38(6):420⁃424.doi:10.3109/01913123.2014.930080.
[5]田歆,刘玉梅,张三泉,等.16例季节性对称性肢端角化症临床及病理超微结构分析[J].皮肤性病诊疗学杂志,2014,(2):108⁃111.doi:10.3969/j.issn.1674⁃8468.2014.02.005.
[6]Perusquía ⁃Ortiz AM,Oji V,Sauerland MC,et al.Complete filaggrin deficiency in ichthyosis vulgaris is associated with only moderate changes in epidermal permeability barrier function profile[J].J Eur Acad Dermatol Venereol,2013,27(12):1552 ⁃1558.doi:10.1111/jdv.12079.
[7]Liu Z,Zhou Y,Chen RY,et al.Symmetrical acrokeratoderma:a peculiar entity in China?clinicopathologic and immunopathologic study of 34 new cases[J].J Am Acad Dermatol,2014,70(3):533⁃538.doi:10.1016/j.jaad.2013.10.061.
[8]Matsui T,Amagai M.Dissecting the formation,structure and barrier function of the stratum corneum[J].Int Immunol,2015,27(6):269⁃280.doi:10.1093/intimm/dxv013.
[9]Kypriotou M,Huber M,Hohl D.The human epidermal diffe⁃rentiation complex:cornified envelope precursors,S100 proteins and the ′fused genes′family[J].Exp Dermatol,2012,21(9):643⁃649.doi:10.1111/j.1600⁃0625.2012.01472.x.
[10]Candi E,Schmidt R,Melino G.The cornified envelope:a model of cell death in the skin[J].Nat Rev Mol Cell Biol,2005,6(4):328⁃340.doi:10.1038/nrm1619.
[11]Menon GK,Cleary GW,Lane ME.The structure and function of the stratum corneum[J].Int J Pharm,2012,435(1):3 ⁃9.doi:10.1016/j.ijpharm.2012.06.005.
[12]Fartasch M,Bassukas ID,Diepgen TL.Structural relationship between epidermal lipid lamellae, lamellar bodies and desmosomes in human epidermis:an ultrastructural study[J].Br J Dermatol,1993,128(1):1⁃9.
[13]李常兴,李红杏,官飞凤,等.对称性肢端角化病患者皮肤屏障功能及其意义[J].广东医学,2015,36(21):3340⁃3341.
