STAG2基因在肾癌的表达及功能研究
2018-03-15倪新强曹永凯杜端明唐爱发
王 翰,倪新强,曹永凯,杜端明,唐爱发
目的研究骨髓基质抗原2(STAG2)基因在人肾癌组织和肾癌细胞中的表达水平并研究STAG2基因对肾癌细胞生物学表型的影响。方法使用实时荧光定量PCR(qRT-PCR)检测STAG2基因在5株肾癌细胞、1株正常肾细胞和68对肾癌及其对应的癌旁组织中的表达水平;使用Western blot法分析STAG2蛋白在5株肾癌细胞、1株正常肾细胞的表达特点;使用慢病毒包装感染ACHN、786-O细胞并使用qRT-PCR检测感染效率;CCK8试剂盒检测STAG2过表达后对肾癌细胞增殖的影响;Transwell法检测STAG2过表达后对肾癌细胞侵袭的影响;流式细胞术检测STAG2过表达后对肾癌细胞凋亡的影响。结果① qRT-PCR结果显示,与正常肾细胞相比,STAG2基因在5株肾癌细胞的表达显著下降,差异有统计学意义(P<0.01);② Western blot结果显示在5株肾癌细胞中STAG2蛋白表达明显低于正常肾细胞;③ qRT-PCR检测肾癌及其癌旁组织的STAG2表达水平结果显示与其对应癌旁组织相比,72.06%(49/68)肾癌组织中STAG2表达水平下降(P<0.01);肾癌组织中STAG2表达水平与肿瘤的临床病理分期相关(P=0.029),与患者年龄、性别、肿瘤组织学分级无明显相关性;④ 慢病毒感染ACHN、786-O细胞后STAG2表达水平明显升高(P<0.01);⑤ 体外实验中,过表达STAG2基因明显抑制肾癌细胞的增殖和迁移能力,促进肾癌细胞的早期凋亡(P<0.05,P<0.01)。结论① 在肾癌细胞和肾癌组织中STAG2的表达水平均有明显的下降,提示STAG2可能参与肾癌的发生和发展的过程,STAG2低表达对肾癌的早期诊断可能提供一些帮助;② 上调STAG2基因的表达明显抑制肾癌细胞的增殖和迁移能力、促进肾癌细胞的凋亡,提示STAG2可能成为治疗肾癌的一个潜在靶点。
STAG2;肾肿瘤;细胞增殖;细胞迁移
肾细胞癌约占肾脏肿瘤的80%~90%,由多种肾实体瘤构成的,其中约75%为肾透明细胞癌,10%为乳头状癌,5%为嫌色细胞癌,是常见的恶性肿瘤之一,每年约有200 000例新增患者,发病率在男性恶性肿瘤中排第5位,女性中排第7位,且发病率呈逐年上升趋势[1]。20%的患者会进展为局部晚期,30%的患者会发生远处转移,寻找更有效的免疫治疗靶点开发新的靶向药物是当前迫切需要解决的问题,而骨髓基质抗原2(stromal antigen 2,STAG2)基因在多种肿瘤中研究被证实与肿瘤发生发展密切相关[2]。STAG2基因位于X染色体上,含有39个外显子以及4种编码mRNA,翻译的SA2蛋白分子量大小为141 ku,是黏合复合蛋白的4个核心亚基之一(SMC1A、SMC3、 RAD21、STAG1/2),黏合复合蛋白在减数分裂期间参与染色单体的分离和联会,同时也参与有丝分裂及减数分裂期间的DNA修复、基因表达调节、基因组印记以及上皮细胞向间质细胞的转变过程。该实验主要研究STAG2基因在肾癌组织及肾癌细胞中的表达并研究STAG2对肾癌细胞生物学表型的影响,为临床上肾癌的诊断和治疗提供新的诊断依据和治疗靶点。
1 材料与方法
1.1材料根据随机化原则,选取2013年10月~2014年10月于珠江医院保存的肾癌组织及其癌旁正常组织样本68例。所需样本得到医院的伦理委员会的批准并获得患者知情同意。本实验所用的人种属的正常人胚肾细胞293-FT以及肾癌细胞CAKI-1、CAKI-2、786-O、769-P、ACHN均购自美国模式培养物集存库;DMEM、1640培养基、McCoy′s5A、PBS、澳洲胎牛血清培养基、Annexin V-FITC/ PI细胞凋亡检测试剂盒购自美国赛默飞世尔公司;细胞毒性检测试剂盒(CCK-8)购自美国Sigma Aldrich公司;反转录试剂盒购自德国QIAGEN公司;TRIzol购自美国Invitrogen Burlington公司;Anti-SA2 antibody、Anti-Tubulin antibody购自美国Abcam公司;慢病毒包装购自上海吉凯基因公司。
1.2方法
1.2.1RNA提取、cDNA合成、实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)实验 按照TRIzol reagent使用说明提取细胞RNA以及组织RNA,使用反转录试剂盒去除基因组DNA后合成20 μl单链cDNA。反应混合物在37 ℃孵育5 min,95 ℃、30 min,之后置于冰上。qRT-PCR实验试剂选用SYBR Premix Taq Ⅱ,β-actin作为内参,引物序列见表1,每20 μl的反应体系中含有0.5 μm的前引物和0.5 μm后引物,10 μl的SYBR Premix,7 μl无酶水,2 μl的cDNA。具体反应步骤如下:第一阶段:反应预变性,95 ℃、30 s;第二阶段PCR反应,95 ℃、5 s,60 ℃、1 min;第三阶段,溶解曲线分析,95 ℃、15 s(温度上升速率1.6 ℃/s),60 ℃、1 min(温度上升速率1.6 ℃/s),95 ℃、15 s(温度上升速率0.05 ℃/s)。
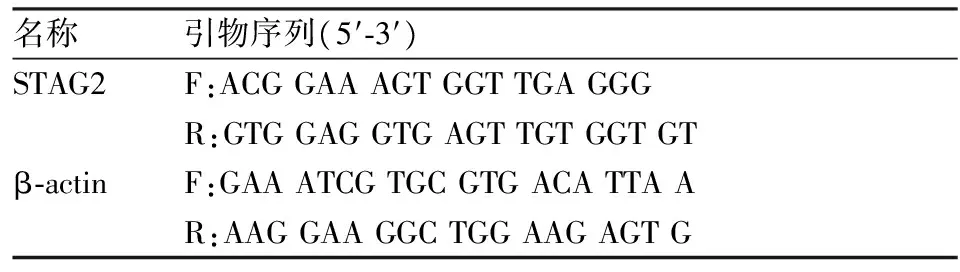
表1 引物序列
1.2.2Western blot实验 配制分离胶,灌入2/3的分离胶后立即封胶,30 min后倒掉上层液体,灌入浓缩胶,插上梳子;将样品蛋白调至等浓度,充分混合沉淀加上样缓冲液后上样,以初始电压90 V电泳约30 min后改成120 V约110 min,在目的蛋白泳动至胶下缘1 cm左右结束电泳结束前15 min左右准备转膜缓冲液剪与胶大小差不多一致的PVDF膜,分别在无水乙醇、水、转膜缓冲液浸没15、2、5 min将膜取出,转膜90 mA 100 min;将膜取出浸泡于5%的封闭液中1 h,浸泡完过后用TBST清洗膜3次,每次6 min。根据抗体说明书将抗体用2%的封闭液稀释,将膜浸泡于抗体液中4 ℃孵育过夜。次日取出膜,TBST清洗膜3次,每次6 min,而后加入二抗继续室温孵育1 h。接着TBST清洗膜3次,每次6 min。曝光,查看条带。
1.2.3慢病毒转染及效果验证 STAG2过表达慢病毒包装购自上海吉凯基因公司。选取对数生长期的细胞消化、离心、去上清液加培养基,接种至6孔板内,每孔50 000个细胞,次日加入已经确定的最佳感染细胞的感染复数值病毒,1 μl聚凝胺/ml,8 h后观察细胞形态,无明显变化则更换正常培养基,72 h后荧光显微镜下观察细胞表达丰度,更换含有适量浓度嘌呤霉素的培养基筛选稳转细胞株直到镜下荧光丰度接近100%。
1.2.4CCK-8法检测细胞增殖能力 取对数生长期的感染后慢病毒后的肾癌细胞、消化、离心,接种至96孔板中,每孔100 μl,含有4×103~6×103个细胞,标注实验组与对照组(含有目的基因为实验组,空载病毒为对照组),设置0、24、48、72 h 4个时间组别,每组5个复孔。24 h后,0 h组每孔加入10 μl的CCK-8溶液,避光放入5%的CO2和37 ℃的培养箱中孵育1 h,在酶标仪上检测加入CCK-8组的细胞在450 nm处的吸光值,记录实验结果。24、48、72 h操作步骤如上,统计实验数值绘制生长曲线。
1.2.5Transwell法检测细胞侵袭能力 使用纯的培养基按照8 ∶1的比例稀释基质胶,再把稀释后的基质胶铺在Transwell小室上(Coring,膜孔径8 μm),每个小室铺60 μl基质胶,放置于5%的CO2和37 ℃的培养箱过夜。取感染慢病毒后的肾癌细胞,弃掉细胞中旧的培养基,PBS清洗2遍,换成纯培养基(不含血清),放置于5%的CO2和37 ℃的培养箱过夜。取前1 d换成纯培养基的细胞,消化、离心、制备细胞悬液、平板计数器计数,每个小室接种60 000个转染后的细胞,上室液体体积定容到200 μl,同时下室加入600 μl的含有30%胎牛血清的培养基,放置于5%的CO2和37 ℃的培养箱孵育36 h。吸掉小室内的培养基,PBS清洗小室内部2次,注意不要清洗小室外侧底部,加入甲醇500 μl固定30 min,之后风干3 min,再取0.1%的结晶紫,染色20 min,用棉签轻轻擦掉上层未穿过基底膜的细胞,显微镜下观察计数,随机选取5个视野计数。将小室放回24孔板中,空板内加入1 ml/孔的冰醋酸,放置摇床慢摇20 min,将孔板内的醋酸等分10份打入96孔板,酶标仪选择570 nm测量光密度(optical density,OD)值。
1.2.6细胞凋亡实验 使用去离子水将10×结合缓冲液稀释成1×结合缓冲液。取感染后慢病毒后的肾癌细胞,PBS清洗2遍,0.25%胰酶(不含乙二胺四乙酸)消化后吸取加到15 ml离心管内,如果没有不含乙二胺四乙酸的胰酶则需要在标记前用PBS或者1×结合缓冲液彻底清洗干净,避免感染Annexin V离心管放置于离心机内,配平离心机调节转速1 000 r/min离心3 min。加入1×结合缓冲液重悬细胞,使细胞密度在0.2×106~1×106个/ml。取200 μl的离心管,然后取上述配置好的混合液100 μl、5 μl Annexin V-FITC、5 μl PI Staining Solution充分混合均匀,避光15 min。反应结束后加400 μl 结合缓冲液轻轻混匀再1 h内上流式细胞仪检测。
1.3统计学处理采用SPSS 19.0软件进行分析。使用配对样本t检验分析STAG2基因在肾癌及其配对癌旁组织中的表达差异;χ2检验用于分析STAG2表达与临床病理特征之间的关系;单因素方差分析以及独立样本t检验用于其他数据分析;以P<0.05为差异有统计学意义。
2 结果
2.1STAG2基因在肾癌组织中低表达通过qRT-PCR检测68对肾癌组织及其配对的癌旁组织中的STAG2基因的mRNA表达水平,结果如图1A所示,STAG2基因在肾癌组织的表达水平明显低于癌旁组织的表达水平(P<0.01)。而且从图1B中可以看出,癌旁组织中的STAG2表达水平平均明显高于肾癌组织的表达水平,约2.17倍(P<0.01)。
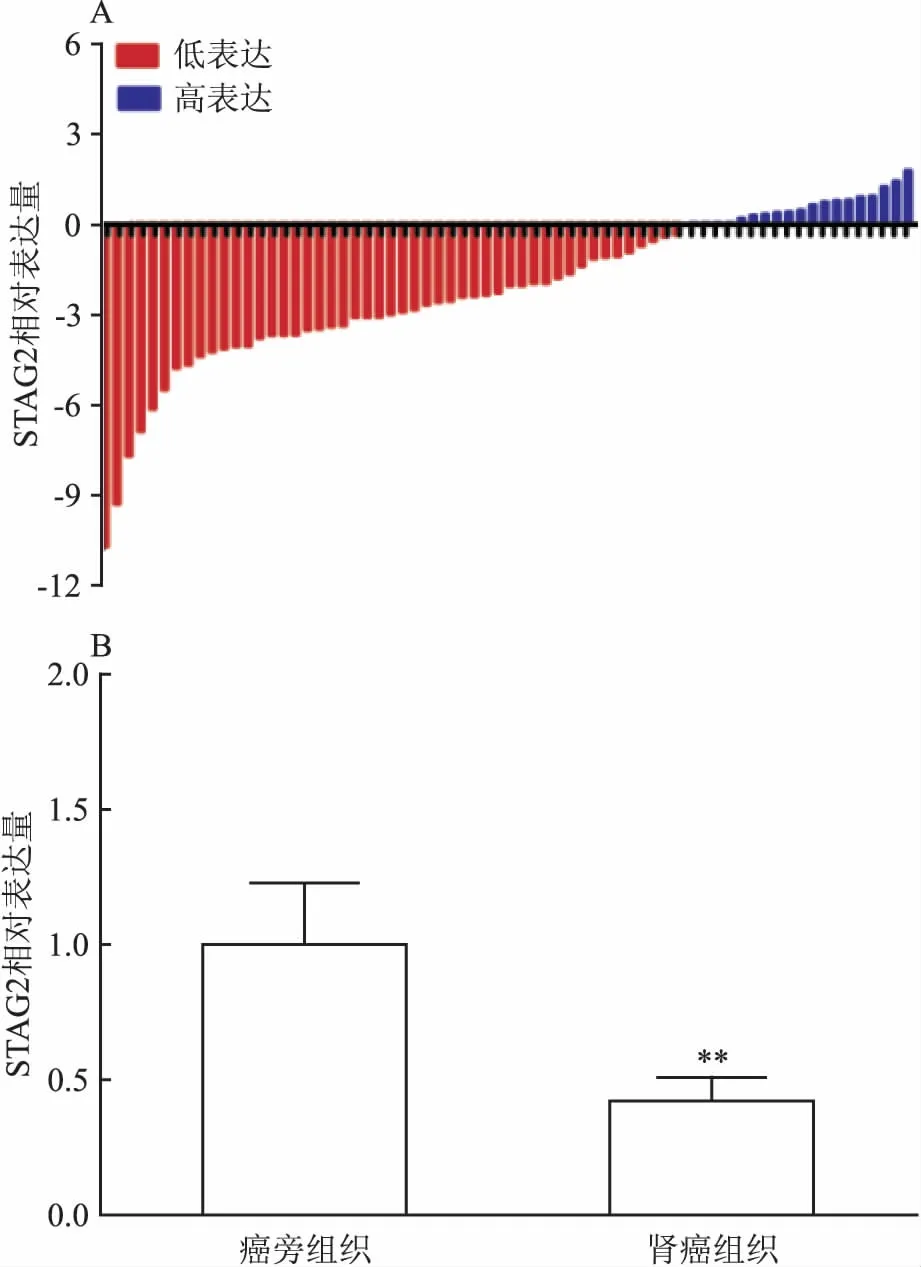
图1 STAG2基因在肾癌及其癌旁组织表达水平
A:STAG2在68对肾癌及癌旁组织中的表达;B:STAG2在肾癌组织中表达水平;与癌旁组织比较:**P<0.01
2.2STAG2基因表达降低与肾癌患者临床病理特征之间的关系通过qRT-PCR检测68对肾癌组织及其配对的癌旁组织中的STAG2基因的mRNA表达水平,显示有72.06%(49/68)的肾癌组织中STAG2相比较于癌旁组织低表达,而27.94%(19/68)的肾癌组织中STAG2相比较于癌旁组织高表达(P<0.01)。而STAG2表达水平与患者临床病理特征之间的关系如表2所示:结果显示STAG2在肾癌组织中的表达水平患者的临床病理分期显著相关(P=0.029),STAG2表达水平与TNM分期呈负相关性(P<0.05);而与患者年龄、性别、组织分级无明显相关性;这些结果提示STAG2在肾癌中可能作为抑癌基因发挥作用,抑制肿瘤的生长。
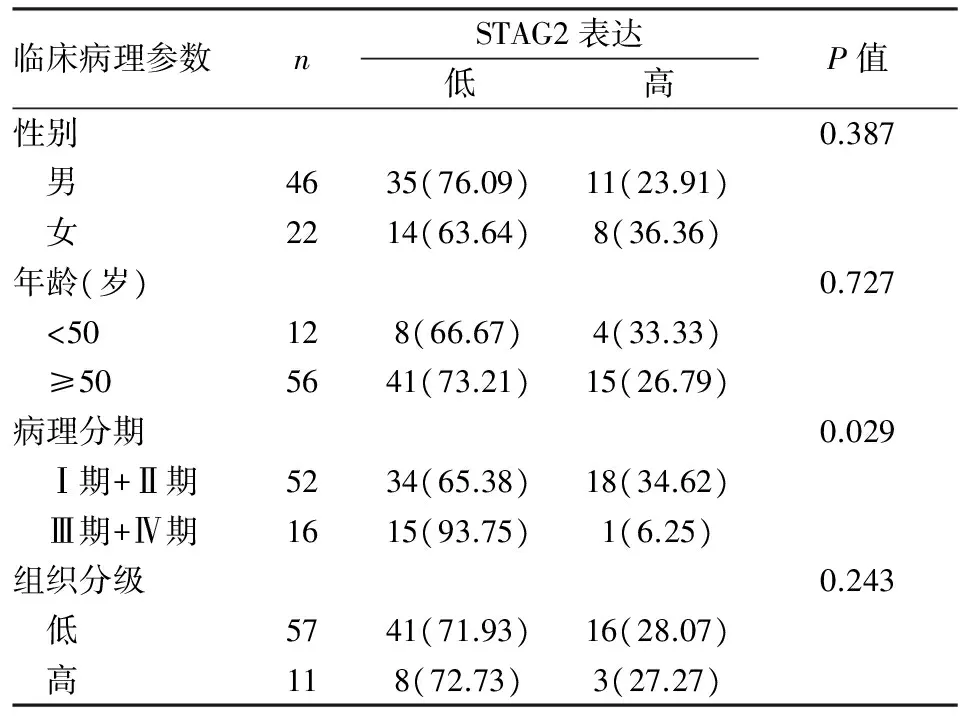
表2 STAG2表达与患者临床病理特征的关系[n(%)]
2.3STAG2基因在肾癌细胞系中的表达采用qRT-PCR检测STAG2基因在人正常胚肾细胞293-FT以及ACHN、CAKI-1、CAKI-2、786-O、769-P等6株细胞中的mRNA表达水平,相比较于人正常胚肾细胞293-FT细胞而言,STAG2基因在ACHN、CAKI-1、CAKI-2、786-O、769-P 5株肾癌细胞中的表达水平明显降低,差异有统计学意义(P<0.01);Western blot检测STAG2基因在6株细胞中的蛋白表达水平,相比较于人正常胚肾细胞293-FT细胞而言,STAG2基因在5株肾癌细胞中的蛋白表达水平明显降低。见图2。
2.4过表达STAG2基因的效率检测qRT-PCR检测感染STAG2慢病毒过表达载体后的ACHN、786-O两株肾癌细胞系STAG2表达水平。将STAG2慢病毒过表达载体和阴性对照病毒载体分别感染ACHN和786-O细胞,结果如图3所示,相对于阴性对照而言,感染STAG2慢病毒过表达载体的细胞STAG2表达水平明显升高,差异有统计学意义。
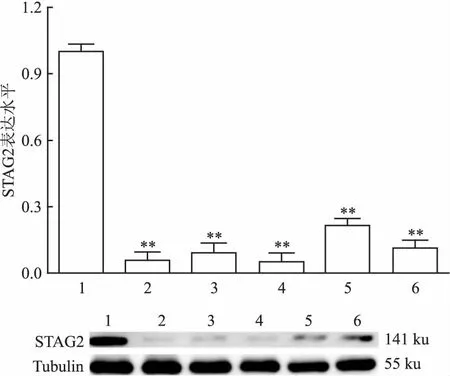
图2 STAG2基因在肾癌细胞中的表达水平
1:293-FT;2:ACHN;3:769-P;4:786-O;5:CAKI-2;6:CAKI-1;与293-FT比较:**P<0.01
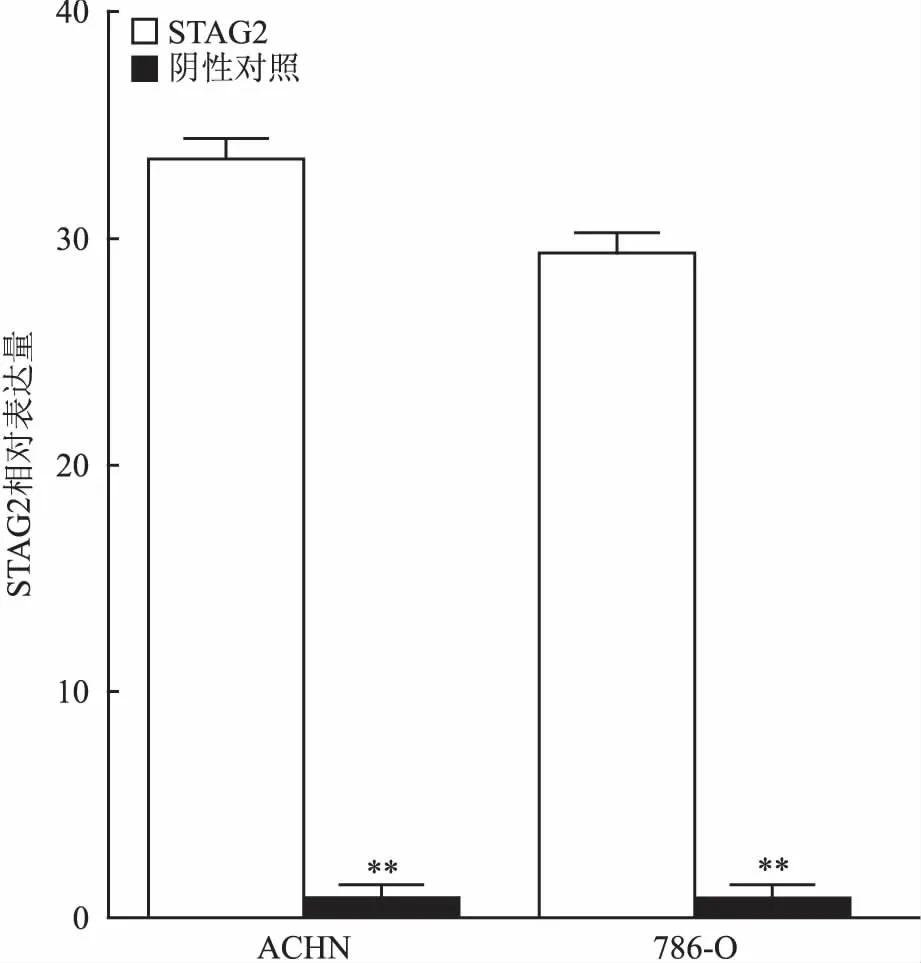
图3 肾癌细胞感染慢病毒后的STAG2表达水平
2.5过表达STAG2基因对肾癌细胞增殖的影响CCK-8法检测感染STAG2慢病毒过表达载体后的ANCH、786-O两株肾癌细胞系的增殖能力的变化,每隔24 h检测一次OD值,统计分析5 d的结果,结果如图4 所示,在786-O和ACHN两个细胞系中,均显示相对于阴性对照,过表达STAG2细胞的增殖能力明显受到抑制,差异有统计学意义(P<0.05,P<0.01)。
2.6过表达STAG2基因对肾癌细胞侵袭的影响Transwell法检测感染STAG2慢病毒过表达载体后的ANCH、786-O两株肾癌细胞系侵袭能力的变化。相较于阴性对照,ACHN、786-O细胞系中STAG2基因过表达细胞穿过小室基底膜的细胞数明显减少(图5A、C);同时经过检测洗脱下来的细胞的结晶紫OD值如图6B、D所示,STAG2基因过表达的OD值明显低于阴性对照,差异有统计学意义(P<0.01)。
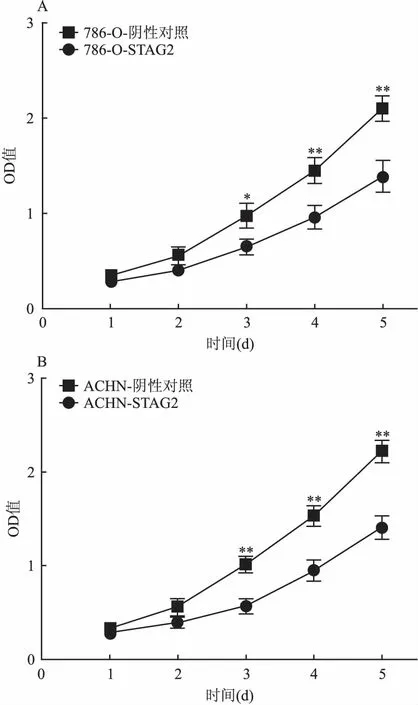
图4 STAG2基因过表达后的肾癌细胞增殖能力的变化
A:786-O细胞系;B:ACHN细胞系;与STAG2比较:*P<0.05,**P<0.01
2.7过表达STAG2基因对肾癌细胞凋亡的影响采用Annexin V-FITC/ PI细胞凋亡检测试剂盒检测感染STAG2慢病毒过表达载体后的ACHN、786-O两株肾癌细胞系凋亡能力的变化。图6A、B显示在786-O中,感染STAG2慢病毒过表达载体后早期凋亡细胞数明显增多,差异有统计学意义(P<0.01);图6C、D显示在ACHN中,感染STAG2慢病毒过表达载体后早期凋亡细胞数明显增多,差异有统计学意义(P<0.01)。
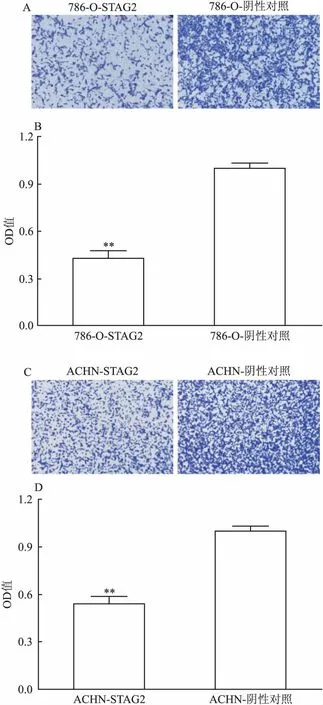
图5 STAG2基因过表达后的肾癌细胞侵袭能力的变化 结晶紫染色×20
A、B:过表达STAG2基因抑制786-O细胞侵袭能力;C、D:过表达STAG2抑制ACHN细胞侵袭能力;与阴性对照比较:**P<0.01
3 讨论
肾癌在所有成人肿瘤发病中占约2%~3%,在男性中排第7位,女性中排第9位的恶性肿瘤,每年约有20 900例新发病例,102 000例死亡[3]。肾癌不是单一性疾病,主要由多重不同组织学类型的肿瘤构成,不同的临床类型由不同的基因引起,了解肾癌的遗传基础可以给治疗肾癌提供新的治疗契机。目前针对肾透明细胞癌的治疗通过靶向治疗有了长足的进展,最新研究[4]显示,染色质重塑以及组蛋白修饰基因如PBRM1和SETD2等可能在肾细胞癌遗传学基础上有着重要作用,新的免疫治疗药物如CTLA4抑制剂、伊匹单抗等开辟了新的临床试验方向,一些新的针对血管内皮生长因子受体信号通路、哺乳动物雷帕霉素靶蛋白通路以及缺氧诱导因子2靶向药物的开发为肾细胞癌的免疫治疗提供了有效的帮助。Linehan et al[5]对肾癌的遗传学基础提出了概括,指出目前已知至少有12个基因导致肾癌:FLCN,延胡索酸水合酶、琥珀酸脱氢酶、琥珀酸脱氢酶、TFE3、TFEB、MITF、TSC1、TSC2和PTEN,然而这些基因参与细胞的有氧呼吸、铁、营养物质的运输等重要环节,提示肾肿瘤本质上可能是一种代谢性疾病。STAG2基因是黏合复合蛋白的4个核心亚基之一,与RAD21、SMC1、SMC3共同构成黏合复合蛋白参与细胞有丝分裂以及减数分裂的染色体分离、联会以及姐妹染色单体的形成[6-7];Solomon et al[2]研究发现STAG2靶向失活突变可导致人染色体非整倍体;Balbás-Martínez et al[8]研究结果显示在膀胱癌中STAG2频繁失活突变并不会产生染色体非整倍体;可能与不同的肿瘤细胞染色体稳定性差异有关。Kim et al[9]发现在胃癌、结直肠癌、前列腺癌中均有STAG2表达缺失但是无突变;而在髓样肿瘤中STAG2频繁发生突变和表达缺失[10];在结直肠癌、胃癌以及前列腺癌中均发现有STAG2基因表达缺失[11-12],目前尚未有关STAG2基因与肾癌之间的关系的报道。
本研究主要阐明了STAG2基因表达水平与肾癌的相关关系,初步揭示了STAG2在肾癌中的生物学功能。本研究显示STAG2基因在肾癌组织中表达水平降低,且与患者的临床病理分期有关,而与患者的年龄、性别、组织学分级并无明显相关性。本研究在此基础上又验证了STAG2基因在肾癌细胞中mRNA表达水平,结果显示与正常的肾组织相比,STAG2在肾癌细胞的表达水平明显下降,Western blot结果显示STAG2基因蛋白表达水平与mRNA表达基本一致,结合STAG2基因在其他肿瘤的表达研究,初步表明STAG2基因在肾癌的发生发展中扮演者抑癌基因的角色。为了验证此假设,接着,进一步验证STAG2基因在肾癌中的相关生物学功能,本研究构建慢病毒过表达载体过表达STAG2基因感染肾癌细胞,分别使用CCK-8法、Transwell以及流式细胞术检测在肾癌中过表达STAG2基因对肾癌细胞的生物学功能产生的影响,实验结果显示过表达STAG2基因后,肾癌细胞的增殖、侵袭能力明显下降,肾癌早期凋亡明显增多。通过上述生物学功能实验结果表明STAG2基因在肾癌的发生发展中可能起着重要的作用,在临床上可能由于STAG2基因的表达缺失而导致肾癌不断进展,如肿瘤体积增大,局部浸润以及发生远处转移。本研究初步揭示了STAG2在肾癌中的生物学功能,但是其在肾癌发生发展过程中的具体作用机制尚不清楚,有待进一步研究。后续研究可从以下几个方面着手:由本研究结果提示STAG2在肾癌的增殖和侵袭过程中发挥着重要作用,后续可以研究STAG2基因信号通路,找出其下游或上游的作用靶基因,利用免疫共沉淀等技术找出相关作用蛋白,找出其共同作用的基因后可以分析几个基因之间的作用关系和特点,在裸鼠上进一步进行验证试验结果,找出有效的作用基因或蛋白。
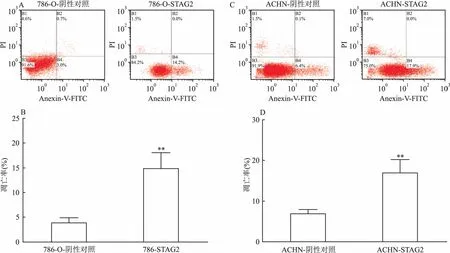
图6 STAG2基因过表达后细胞凋亡能力的变化
A、B:过表达STAG2促进786-O细胞早期凋亡;C、D:过表达STAG2促进ACHN细胞早期凋亡;与阴性对照比较:**P<0.01
综上所述,本实验数据提示STAG2基因在肾癌中可能起着抑癌基因的作用抑制肿瘤细胞的生长,STAG2低表达对肾癌的早期诊断可能提供一些帮助,可能成为治疗肾癌的一个潜在靶点。
[1] Larkin J, Goh X Y, Vetter M, et al. Epigenetic regulation in rcc: Opportunities for therapeutic intervention[J] .Nat Rev Urol,2012,9(3):147-55.
[2] Solomon D A, Kim T, Diaz-Martinez L A, et al.Mutational inactivation of stag2 causes aneuploidy in human cancer[J].Science,2011,333(6045):1039-43.
[3] Gupta K, Miller J D, Li J Z, et al.Epidemiologic and socioeconomic burden of metastatic renal cell carcinoma(mrcc): A literature review[J].Cancer Treat Rev, 2008,34(3):193-205.
[4] Linehan W M, Rathmell W K.Kidney cancer[J]. Urol Oncol,2012,30(6):948-51.
[5] Linehan W M, Srinivasan R, Schmidt L S. The genetic basis of kidney cancer: a metabolic disease[J]. Nat Rev Urol,2010,7(5):277-85.
[6] Franca J A, Diniz M G, Bernardes V F, et al. Cohesin subunits, STAG1 and STAG2, and cohesin regulatory factor, PDS5b, in oral squamous cells carcinomas[J].J Oral Pathol Med,2017,46(3):188-93.
[7] Chung N G, Kim M S, Yoo N J, et al.Somatic mutation of stag2, an aneuploidy-related gene, is rare in acute leukemias[J].Leuk Lymphoma,2012,53(6):1234-5.
[8] Balbás-Martínez C, Sagrera A, Carrillo-de-Santa-Pau E, et al.Recurrent inactivation of stag2 in bladder cancer is not associated with aneuploidy[J]. Nat Genet, 2013,45(12):1464-9.
[9] Kim M S, Kim S S, Je E M, et al.Mutational and expressional analyses of stag2 gene in solid cancers[J]. Neoplasma,2012,59(5):524-9.
[10] Kon A, Shih L Y, Minamino M, et al. Recurrent mutations in multiple components of the cohesin complex in myeloid neoplasms[J]. Nat Genet,2013,45(10):1232-7.
[11] Kim J S, He X, Orr B, et al. Intact cohesion, anaphase, and chromosome segregation in human cells harboring tumor-derived mutations in stag2[J]. PLoS Genet, 2016,12(2):e1005865.
[12] Hill V K, Kim J S, Waldman T. Cohesin mutations in human cancer[J]. Biochim Biophys Acta, 2016,1866(1):1-11.
