SIRT1/NF-κB通路参与白藜芦醇改善大鼠脑缺血再灌注损伤炎性反应
2018-03-15李传文管叶明1汪青松
李传文,张 嵘,侯 亮,管叶明1,,汪青松
脑卒中具有高发病率、高死亡率、高致残率及高复发率等特点,系威胁人类健康的重要疾病之一,给家庭和社会带来严重的负担[1]。在我国,脑卒中所致的死亡率已跃居死亡原因的首位,其中缺血性脑卒中占整个卒中约70%,发病率呈逐年上升趋势,并出现年轻化趋势。在缺血性卒中的治疗上,目前主要是采用超早期溶栓和神经保护等措施,但由于有效治疗时间窗短和易诱发脑内出血等特点使其临床应用受到限制[2],而神经保护药物虽然在临床前实验中效果显著,但在临床试验中均以失败告终。因此,深入研究缺血性脑卒中的发病机制,寻找有效的新药物和(或)新方法并能在临床推广应用是目前亟待解决的问题。
沉默信息调节蛋白 1(silent information regulator protein 1,SIRT1)是一种依赖NAD+的组蛋白去乙酰化酶。该物质主要作用依赖于烟酰胺腺嘌呤二核苷酸/NADH 的信号转导,通过多种转录因子调节蛋白质表达,起到神经保护的作用。SIRT1因参与多种细胞功能的调节而成为研究的热点。既往研究[3]提示SIRT1的上调能够抑制炎性反应和细胞凋亡,减轻缺血再灌注损伤,促进神经功能恢复,具有一定的脑保护作用。该实验通过建立大鼠大脑中动脉栓塞模型,通过尾静脉注入SIRT1的激活剂白藜芦醇及抑制剂EX527,观察SIRT1表达变化对缺血再灌注大鼠脑组织中炎性因子白细胞介素(interleukin,IL)-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、IL-6水平影响及其与核转录因子-κB (nuclear factor-κB,NF-κB)通路的关系。
1 材料与方法
1.1实验动物和分组选择普通级健康雄性SD大鼠40只,7~8周龄,260~300 g ,购自安徽医科大学实验动物中心。采取自然光照,自由进食喂养,1周后进行实验。所有大鼠随机分为4 组:假手术组、模型组、白藜芦醇组、EX527组,每组10 只。
1.2试剂及来源EX527、白藜芦醇、DMSO(美国Sigma公司);兔抗IL-1β、兔抗SIRT1(北京Bioss公司);兔抗NF-κB p65、兔抗IL-6(英国Abcam公司);兔抗TNF-α(美国Bioworld公司);β-actin和二抗 (北京中杉金桥生物技术有限公司);逆转录-聚合酶链反应(reverse transcriotion-polymerase chain reaction,RT-PCR)的TRIzol试剂盒(美国Invitrogen公司);逆转录试剂盒(RevertAidTMfirst Strand cDNA Synthesis Kit)(美国Thermo公司)。
1.3大鼠大脑中动脉梗塞模型建立除假手术组外,其余三组采用改良线栓法[4]构建大鼠右侧大脑中动脉栓塞模型,假手术组大鼠仅单纯分离血管。在缺血期内死亡或出现昏迷及抽搐的大鼠均被弃去。模型成功的标准:提大鼠尾部,使其悬空,30 s内出现转颈超过10°,左前肢(脑缺血对侧)屈曲内收,肌张力下降,爬行时呈典型追尾征,若无此典型症状予以剔除。术后保持动物体温 (37 ±0.5) ℃。白藜芦醇和EX527溶于5%DMSO,白藜芦醇组分别于缺血前15 min和再灌注前1 min按照20 mg/kg经尾静脉注入白藜芦醇; EX527组给药时间同白藜芦醇组,按照1 μg/kg经尾静脉注入EX527。
1.4神经功能缺损评分除假手术组外,采用改良的神经功能缺损评分mNSS量表[5]分别对其余三组于1、3、7、14 d时对其进行神经功能缺损评分,共18分,其中13~18分为重度神经功能缺损, 7~12分为中度神经功能缺损,1~6分为轻度神经功能缺损。
1.5RT-PCR法检测梗死脑组织周边SIRT1、NF-κB、IL-1β、TNF-α、IL-6mRNA表达在脑梗死周边缺血半暗带区取标本,TRIzol法提取目的细胞总RNA。42 ℃反转录50 min,95 ℃ 5 min灭活反转录酶。RT-PCR检测。PCR热循环参数:96 ℃、4 min,然后三步反应:94 ℃、30 s,58 ℃、30 s,72 ℃、30 s,40个循环,于每个循环的第三步即:72 ℃ 30 s收集荧光信号。RT-PCR结果分析得到目的基因表达的相对定量值(RQ值),以2-ΔΔCT计算所得结果,见表1。
1.6Westernblot法检测梗死周边脑组织SIRT1、NF-κB、IL-1β和TNF-α、IL-6表达在脑梗死周边缺血半暗带区取标本,加入RIPA细胞裂解液裂解,12 000 r/min,离心10 min,收集上清液,即含有组织总蛋白,取等量蛋白样品,聚丙烯酰胺凝胶垂直电泳分离;分离后湿法转至PVDF膜上,5%脱脂奶粉封闭过夜;之后加入一抗4 ℃过夜;加入TBST洗涤3次;二抗室温封闭2 h,TBST洗涤3次,ECL显色,拍照进行灰度扫描,以β-actin 为内参,将目的基因与内参β-actin条带的灰度值比值作为目的基因的相对表达量 。
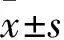
2 结果
2.1各组不同时间段神经功能缺损评分比较假手术组各时间点神经功能缺损评分均为0分。与模型组与EX527组比较,白藜芦醇组在3、7、14 d神经功能缺损评分明显降低(F=1.533、9.112、8.820、13.793,P<0.01),见表2。
2.2缺血区周边脑组织IL-6、IL-1β、TNF-α、SIRT1、NF-κBmRNA水平白藜芦醇组IL-1β、TNF-α、IL-6、NF-κB mRNA表达量均低于模型组和EX527组(P<0.01),SIRT1 mRNA表达高于模型组和EX527组(F=104.260、111.703、218.101、58.318、277.261,P<0.01),见图1。
2.3缺血区周边脑组织IL-6、IL-1β、TNF-α、SIRT1、NF-κB蛋白表达水平白藜芦醇组NF-κB、IL-1β、TNF-α、IL-6表达均低于模型组和EX527组(P<0.01),SIRT1表达高于模型组和EX527组(F=179.998、305.022、110.542、401.454、78.912,P<0.01),见图2。

表1 RT-PCR引物序列及产物片段
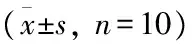
表2 各组不同时间段神经功能缺损评分比较
与模型组比较:**P<0.01;与EX527组比较:##P<0.01
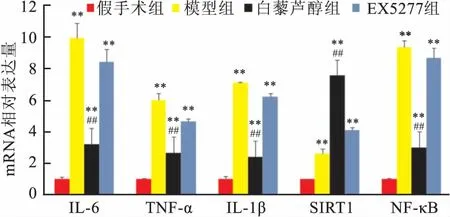
图1 各组缺血脑组织半暗带IL-6、TNF-α、IL-1β、 SIRT1、NF-κB mRNA表达的变化
与假手术组比较:**P<0.01;与模型组和EX527组比较:##P<0.01
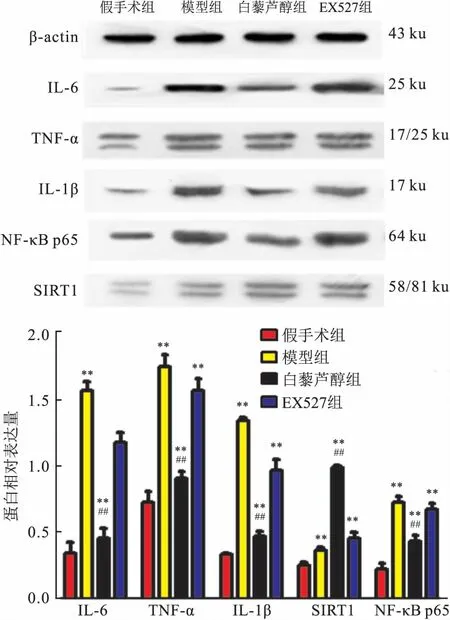
图2 各组缺血脑组织半暗带IL-6、IL-1β、TNF-α、 SIRT1、NF-κB蛋白表达量的变化
与假手术组比较:**P<0.01;与模型组和EX527组比较:##P<0.01
3 讨论
既往研究[6]显示SIRT1能够减轻氧化应激和炎性反应, 还能够抑制缺血再灌注所致脑组织损伤凋亡, 保护神经细胞[7]。近年研究[8]显示在小鼠的脂肪肝模型中,白藜芦醇可以通过激活SIRT1抑制NF-κB炎性反应通路,该研究提示白藜芦醇可减少炎性因子TNF-α、IL-1β、IL-6及NF-κB p65的表达。
白藜芦醇是一种多酚化合物, 广泛存在于植物如花生、中药的虎杖 、葡萄以及红葡萄酒中等。随着老龄化上升和细胞的衰老,SIRT1的水平和活性在缓慢下降[9]。在大鼠脑缺血模型治疗前,尾静脉注射白藜芦醇,可以增加SIRT1的活性,改善炎性反应,减少大鼠神经元的死亡[10]。白藜芦醇能穿过血脑屏障到脑组织,对中枢神经病变起保护作用。本实验中, 课题组发现与模型组和抑制剂组比较, 白藜芦醇明显提高了SIRT1的蛋白表达,下调TNF-α、IL-1β、IL-6及NF-κB p65炎性因子的表达。提示白藜芦醇抑制大鼠脑缺血再灌注损伤的炎性反应,对抗大鼠脑损伤的保护作用可能与其激活SIRT1/NF-κB 信号通路有关。而 EX527组与模型组比较差异无统计学意义,理论上两组应该有意义,本实验未作出相应的结果,可能主要是由于当大鼠脑缺血损伤时,本身的SIRT1消耗过多,导致体内含量较少,使得抑制剂未发挥作用,其次是注射药物浓度低及样本量少的原因。本研究表明SIRT1的激活能够有效改善大鼠缺血再灌注损伤的炎性反应。
脑缺血再灌注损伤后激活白细胞、小胶质细胞和星形胶质细胞等炎性细胞产生大量炎性因子,如细胞因子、趋化因子和黏附分子等。NF-κB是一种介导细胞内信号转导的核转录因子, 在炎症反应中发挥重要作用,通过增强TNF-α、IL-1β及IL-6等促炎性因子基因的表达进一步促进炎性反应[11]。越来越多的证据显示,SIRT1 激活能使 NF-κB的 RelA/p65 亚单位去乙酰化, 抑制 NF-κB 的转录活性, 在炎症损伤中起保护作用。既往研究[12]表明,SIRT1具有抗炎并抑制细胞间黏附分子表达的作用,当炎性反应途径激活转录因子NF-κB,刺激线粒体产生大量氧自由基,而SIRT1则通过使Rel A/p65去乙酰化,抑制其与NF-κB启动子的结合,从而干扰 NF-κB信号转导来减少氧自由基的产生,最终起到抗炎作用[13]。
综上所述,本研究结果表明在白藜芦醇激活SIRT1的条件下,能够减轻大鼠缺血再灌注损伤后的炎性发应,改善大鼠神经功能缺损的恢复, 其机制可能是通过抑制NF-κB通路实现的。
[1] Go A S, Mozaffarian D, Roger V L, et al. Executive summary: heart disease and stroke statistics--2014 update: a report from the American Heart Association[J]. Circulation, 2014, 129(3):399.
[2] Gumbinger C, Reuter B, Stock C, et al. Time to treatment with recombinant tissue plasminogen activator and outcome of stroke in clinical practice: retrospective analysis of hospital quality assurance data with comparison with results from randomised clinical trials[J]. BMJ, 2014, 348:g3429.
[3] Meng X, Jin T, Li M, et al. Sirt1: Role under the condition of ischemia/hypoxia[J]. Cell Mol Neurobiol, 2016,37(1):17-28.
[4] 帕尔哈提·热西提, 更·党木仁加甫, 汪永新, 等. 改良线栓法制作大鼠局灶性脑缺血模型[J].新疆医科大学学报,2006,29(2):145 -7.
[5] Chen J, Sanberg P Y, Wang L, et al. Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J]. Stroke,2001, 32(11):2682-8.
[6] Pantazi E, Zaouali M A, Bejaoui M, et al. Role of sirtuins in ischemia-reperfusion injury[J]. World J Gastroenterol,2013, 19(43):7594-602.
[7] Wan D, Zhou Y, Wang K, et al. Resveratrol provides neuroprotection by inhibiting phosphodiesterases and regulating the cAMP/AMPK/SIRT1 pathway after stroke in rats[J]. Brain Res Bull, 2016, 121:255-62.
[8] Tian Y, Ma J, Wang W, et al. Resveratrol supplement inhibited the NF-κB inflammation pathway through activating AMPKα-SIRT1 pathway in mice with fatty liver[J]. Mol Cell Biochem, 2016, 422(1-2):75-84.
[9] Petegnief V, Planas A M. SIRT1 regulation modulates stroke outcome[J]. Transl Stroke Res, 2013, 4(6):663.
[10] Simão F, Matté A, Matté C, et al. Resveratrol prevents oxidative stress and inhibition of Na(+)K(+)-ATPase activity induced by transient global cerebral ischemia in rats[J]. J Nutr Biochem, 2011, 22(10):921-8.
[11] Harari O A, Liao J K. NF-κB and innate immunity in ischemic stroke[J].Ann N Y Acad Sci, 2010, 1207(1):32-40.
[12] Hernández-Jiménez M, Hurtado O, Cuartero M I, et al. Silent information regulator 1 protects the brain against cerebral ischemic damage[J]. Stroke, 2013, 44(8):2333-7.
[13] Chen J, Zhou Y, Mueller-Steiner S, et al.SIRT1 protects against microglia-dependent amyloid-beta toxicity through inhibiting NF-kappaB signaling[J]. J Biol Chem, 2005, 280(48):40364.
