USP22在女性宫颈癌组织中的表达及与患者病理学特征和预后的关系
2018-03-14常静
常静
(周口市儿童医院(周口市妇幼保健院)妇产科,河南 周口 466000)
宫颈癌是在我国女性中常见的恶性肿瘤之一,其在临床上的高发病率以及高死亡率严重影响我国女性的生活质量、生育甚至威胁生命安全[1-3]。近年来临床上对宫颈癌的治疗取得了不小的进步,但由于其发生到形成是一个多源性、多个步骤及多阶段的过程,并且其发病原因并不十分清楚,常规治疗难以达到理想的治疗效果,因此对宫颈癌的患者来说,发现新的分子靶点,并对其采取针对性治疗成为临床的热点[4-6]。特异性肽酶22(USP22)是泛素特异性水解酶之一,其在多种恶性肿瘤中都有表达,近年来有研究表明USP22在肿瘤细胞生长过程中起到关键作用,其可以调控基因的复制和表达,从而调控细胞周期,USP22缺乏的癌细胞出现细胞生长缓慢和停滞的现象[7-9]。因此本文通过研究USP22的表达水平对宫颈癌肿瘤细胞的生长的影响,来探讨其与患者预后的关系。
1 资料与方法
1.1 一般资料 选取我院因宫颈癌行手术治疗的术后标本100例(收集时间:2012年1月~2013年12月),因宫颈上皮瘤变(CIN)行手术治疗的术后标本60例。
宫颈癌组织, 年龄 41~66 岁, 平均 52.4±9.5岁,临床分期:Ⅰ期42例、Ⅱ期58例,病理学分级:G1级24例、G2级40例、G3级32例,发生淋巴结转移54例。CIN组织,年龄37~65岁,平均50.4±10.8 岁,其中 CINⅡ级 29 例、CINⅢ级 31 例:两组患者的年龄比较,差异无统计学意义 (P>0.05)。
1.2 纳入排除标准
1.2.1 纳入标准 ⑴宫颈癌的诊断标准参考人民卫生出版社《妇产科学》第八版中的标准;⑵所有患者均在本院接受手术治疗,标本来源于手术后;⑶CIN组织标本来源于因CINⅡ级~Ⅲ级手术后标本;⑷宫颈癌患者临床分期:Ⅰ期~Ⅱ期;⑸所有患者手术前均未接受放化疗。
1.2.2 排除标准 ⑴转移性宫颈癌;⑵合并其他部位恶性肿瘤疾病疾病;⑶未经病理学证实;⑷既往具有放化疗病史。
1.3 免疫组化染色方法 二甲苯脱蜡后,采用梯度乙醇水化各5min,再用PBS冲洗,抗原修复后再次用PBS冲洗液冲洗切片,先滴加1:150稀释的一抗 (兔抗人USP22单克隆抗体),4℃保持10-12h;以PBS冲洗后再滴加二抗,37℃保持半小时,PBS清洗后DAB显色,苏木精复染后梯度乙醇脱水,二甲苯透明,并用中性树胶封片。
1.4 免疫组化结果判断 免疫组化结果判定:USP22蛋白阳性着色表达于细胞核,呈黄色、棕黄色、褐色表达,⑴根据着色强度:0分为无色、1分为淡黄色、2分为棕黄色、3分为褐色、黑色;⑵根据阳性细胞比例:阳性细胞数目所占比例≤10%为1分、阳性细胞所占比例11%~50%为2分、阳性细胞数51%~75%为3分、阳性细胞数所占比例>75%为4分,两种积分相乘总分<3分为阴性、≧3分为阳性。总分<3 分:“-”表达;为 3~5 分,“+”表达;为6~9 分,“++”表达;>9 分,“+++”表达。
1.5 术后随访 本研究纳入的100例宫颈癌患者,术后均进行了随访观察,主要观察患者的生存率、生存时间,随访方式主要通过电话、患者到门诊接受相关诊查,每一次随访做好记录,术后第1年每一个病例随访1次,术后第2年和第3年每3个月进行一次随访。
1.6 统计学方法 统计软件采用SPSS 16.0,采用均数±标准差进行统计描述;计数资料组间比较采用χ2检验;生存分析采用kaplan-meier法,生存时间分析采用log-rank秩和检验;P值<0.05表示差异具有统计学意义。
2 结果
2.1 两组标本中USP22蛋白阳性表达率比较 宫颈癌组中的USP22蛋白阳性表达率58.00%、CIN组中的USP蛋白阳性表达率31.67%,两组比较差异具有统计学意义(P<0.05);(表 1,图 1)。
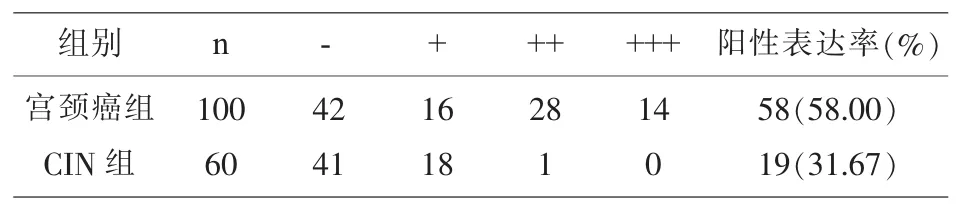
表1 两组标本中USP22蛋白阳性表达率比较

图1 A为USP22蛋白在宫颈癌组织中阳性表达,B为USP22蛋白在CIN组织中呈阴性表达,(100倍)
2.2 宫颈癌患者癌组织中USP22蛋白阳性表达率与患者临床病理学特征的关系 组织学分级G3级、发生淋巴结转移、肿瘤病灶直径>5cm宫颈癌组织中的USP22蛋白阳性表达率显著的高于宫颈癌组织学分级G1+G2级、未发生淋巴结转移、肿瘤病灶直径≤5cm的患者,两组比较差异具有统计学意义(P<0.05);(表 2)。
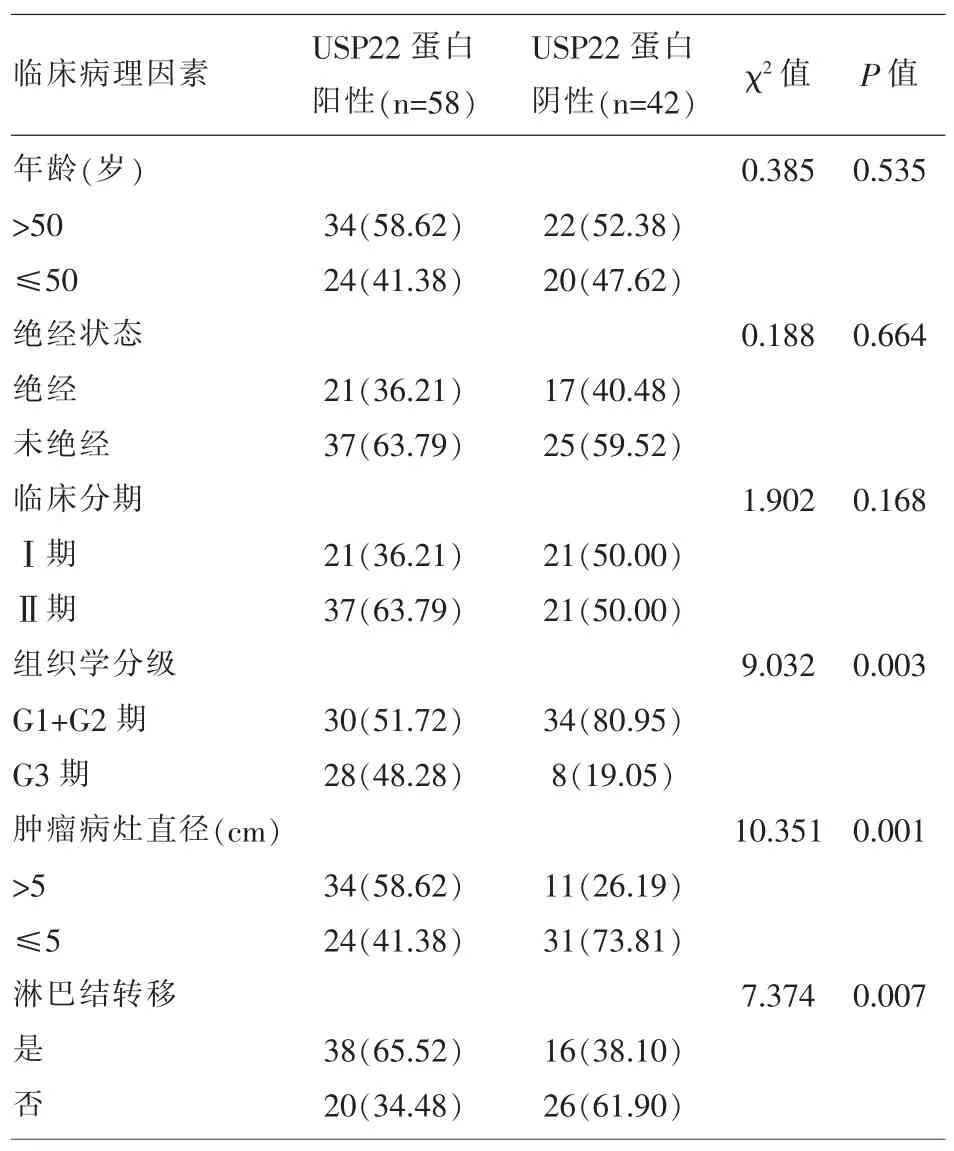
表2 USP22蛋白阳性表达率与患者临床病理学特征的关系
2.3 宫颈癌患者癌组织中USP22蛋白阳性表达率与患者预后的关系 USP22蛋白阳性表达患者的3年无病生存率58.62%、3年总生存率60.34%均显著的低于 USP22蛋白阴性患者的 78.57%、85.71%,差异均具有统计学意义(P<0.05);(表 3)。USP22蛋白阳性表达患者的生存时间显著的低于USP22 蛋 白 阴 性 表 达 患 者 (Z=4.465,P=0.035<0.05);图 2。

表3 宫颈癌患者癌组织中USP22蛋白阳性表达率与患者预后的关系[n(%)]
3 讨论

图2 两组患者的生存时间函数图
在全球范围内,宫颈癌在女性生殖系统恶性肿瘤的发病率中高居首位,尤其我国为该类肿瘤疾病的高发地区,据统计我国每年发病患者占全球总数的1/3-1/4,且随着人们生活方式和观念的转变,目前宫颈癌的发病有明显年轻化的趋势,严重影响了我国女性的正常生活、生育以及生命。为了尽可能的降低该疾病对女性的伤害,目前临床上多采用更先进的筛查手段,并逐步提高女性的普查意识,做到该类疾病的早发现早治疗,以提高临床上的治愈率。宫颈癌发病的重要原因是乳头瘤病毒(HPV)感染导致的宫颈正常细胞癌变,临床上是对确诊宫颈癌的患者可采用手术、放疗、化疗、药物及基因等个性化的综合治疗[10],但目前对于宫颈癌的发病原因仍不十分清楚,其发病是一个多源性、多个步骤及多阶段的过程,其与诸多因素有关,例如早婚、早育、多个性伴侣、吸烟、免疫力低下等,因此对宫颈癌发病机制更深入全面的研究,有助于对于该病的诊断及治疗[11]。虽然近年来手术治疗宫颈癌的效果逐渐提高,但是由于癌细胞的浸润和转移的出现,严重影响了相关治疗的疗效,因此在分子水平上寻找治疗肿瘤的靶向治疗逐渐在临床上获得认可,而宫颈癌治疗常关注的分子靶点是VEGF,其可以控制肿瘤组织的血管的生成,从而抑制肿瘤的生长,在临床上取得了一定疗效,因此这也提示我们可以寻找新的抑制肿瘤生长的分子靶点[12,13]。DUBs是一类蛋白酶超家族,可以作用于特异性蛋白质-泛素,切断泛素链,从而避免底物降解,其中USP22是DUBs中最多一类,作为一个人类转录辅助因子复合物(hSAGA)的亚单位,可以降解对组蛋白H2A、H2B的尾端特异的泛素化分子,并通过这种方式改变核酸的复制和表达,进而影响癌细胞的增殖,从而控制肿瘤的生长,并有希望成为抑制肿瘤的关键靶点[14,15],目前已经在多种恶性肿瘤发现其存在,但在宫颈癌却报道较少,因此本文通过研究UPS22与宫颈癌的关系,来为临床上的治疗提供新的选择。
3.1 两组标本中USP22蛋白阳性表达率比较 本文考察了USP22在宫颈癌和CIN中的表达,发现宫颈癌组中的USP22蛋白阳性表达率高于CIN组,两组比较差异具有统计学意义,这表明USP22在宫颈癌肿瘤细胞的生长过程中扮演着重要角色,其与癌细胞的增殖关系密切,因此可以以USP22为分子靶点,采用治疗药物干扰其正常的表达,进而抑制癌细胞的增殖,提高患者的治疗效果。
3.2 宫颈癌患者癌组织中USP22蛋白阳性表达率与患者临床病理学特征的关系 肿瘤病情的发展进程可由组织学分级、发生淋巴结转移和肿瘤病灶直径等指标来表达,因此可以通过研究USP22与以上指标的关系,来表达其与肿瘤病情发展的关系。本文发现组织学分级G3级、发生淋巴结转移、肿瘤病灶直径>5cm宫颈癌组织中的USP22蛋白阳性表达率显著的高于宫颈癌组织学分级G1+G2级、未发生淋巴结转移、肿瘤病灶≤5的患者,两组比较差异具有统计学意义,这表明USP22与肿瘤病情发展关系密切,推测其与宫颈癌的分化程度有关,并且参与宫颈癌的淋巴转移过程,还可能参与了肿瘤的生长和浸润。
3.3 宫颈癌患者癌组织中USP22蛋白阳性表达率与患者预后的关系 由于以USP22为分子靶点的治疗药物,具有更高的靶向性,可以在更大程度上抑制癌细胞的扩散,从而达到改善预后的目的,因此本文以USP22蛋白阳性表达患者治疗后的生存率为考察指标,发现USP22蛋白阳性表达患者的3年无病生存率和3年总生存率均显著的低于USP22蛋白阴性患者的;USP22蛋白阳性表达患者的生存时间显著的低于USP22蛋白阴性表达患者,结果均具有统计学意义,这表明USP22不仅参与了宫颈癌变的发生发展过程,并且还参与了癌细胞的转移和扩散,以USP22为分子靶点的治疗明显可以改善患者预后,提高患者生存率,延长患者生存时间。
综上所述,本文通过研究USP22蛋白阳性表达与宫颈癌的关系,阐明了USP22参与了宫颈癌发生、发展、转移以及扩散,并以其为分子靶点的治疗明显提高生存率和改善患者预后,有望成为新的宫颈癌的治疗靶点。
[1]孔琳,雷张涛,周亮.宫颈癌化疗进展[J].中国医师进修杂志,2015,38(7):541-543.
[2]幸琼,幸情.HR-HPV与TCT筛查宫颈癌及其癌前病变的临床价值[J].实验与检验医学,2016,34(6):761-763.
[3]Mckee SJ,Bergot A,Leggatt GR.Recent progress in vaccination against human papillomavirus-mediated cervical cancer[J].Reviews in Medical Virology,2015,25(S1):54-71.
[4]张燕茹,王月云.宫颈癌防治研究进展[J].中国肿瘤,2015,24(12):998-1002.
[5]黄璇,张询,HUANGXuan,等.宫颈癌预后相关分子标志物的研究进展[J].肿瘤防治研究,2016,43(9):806-810.
[6]Kahng J,Kim EH,Kim HG,et al.Development of a cervical cancer progress prediction tool for human papillomavirus-positive Koreans:A support vector machine-based approach[J].Journal of International Medical Research,2015,43(4):217-230.
[7]郑凤霞,聂丽菊,孙平风,等.宫颈癌中表皮生长因子受体基因状态的研究进展[J].中国妇幼保健,2015,30(15):2465-2467.
[8]王技军,贺岩.USP22在恶性肿瘤中的研究进展[J].实用肿瘤学杂志,2016,30(6):551-554.
[9]Jones J,Dean JL,Schrecengost RS,et al.Abstract 1862:Discerning the role of USP22 in prostate cancer development and progression[J].Cancer Research,2015,75(15):1862-1862.
[10]古杰超,冯秀兰,黄伟刚.鳞状上皮细胞癌抗原(SCCA)与细胞角蛋白19(CK19)联合检测对早期宫颈癌及癌前病变诊断的临床价值[J].实验与检验医学,2016,34(5):618-620.
[11]李霓,郑荣寿,张思维,等.2003~2007年中国宫颈癌发病与死亡分析[J].中国肿瘤,2012,21(11):801-804.
[12]宋春丽.宫颈癌组织中KISS-1、VEGF的表达及意义[J].中国热带医学,2015,15(10):1221-1223.
[13]王广娇,杨欣,郝敏.血管内皮生长因子A在宫颈癌发病机制中的研究进展[J].国际妇产科学杂志,2016,43(5):519-523.
[14]Hu J,Yang D,Zhang H,et al.USP22 promotes tumor progression and induces epithelial-mesenchymal transition in lung adenocarcinoma[J].Lung Cancer,2015,88(3):239-245.
[15]敖宁,刘玉琴,AONing,等.USP22在肿瘤发生发展中的作用研究进展[J].基础医学与临床,2012,32(10):1235-1238.
