EDTA依赖性血小板假性减少的分析与处理
2018-03-14黄小红林晋郜秋芳王小中
黄小红,林晋,郜秋芳,王小中
(南昌大学第二附属医院检验科,江西省检验医学重点实验室,江西 南昌330006)
目前全自动血液分析仪因操作简便、速度快、计数准确、重复性好,在临床检验工作中被广泛应用。血细胞分析是临床常规检测项目,而乙二胺四乙酸盐(EDTA)由于其对血细胞形态影响较小,适用于血液学检查,尤其是血小板计数,被国际血液学标准化委员会 (international committee for standardization of hematology,ICSH)推荐为血细胞计数的一种抗凝剂,然而EDTA偶尔能引起血小板聚集而使血液分析仪不能正确辨别,使血小板测得值显著低于真实值,使血小板假性减少,称为EDTA依赖性血小板假性减少 (EDTA-dependent pseudothrombocytopenia EDTA-PTCP)现象。 EDTAPTCP现象容易被误认为血小板减少血液性疾病,从而造成误诊误治,给临床及患者带来不必要的麻烦,本文对我室检验工作中发现的5例EDTAPTCP现象及相关处理办法进行分析和总结。
1 资料和方法
1.1 一般资料 南昌大学第二附属医院2017年4月至2017年6月底门诊和住院患者EDTA-K2抗凝静脉血2ml,通过实验室复检规则和血涂片镜检结果筛选出6例镜下血小板聚集的患者,其中男2例,女4例,标本的采集严格按照《全国临床检验操作规程》(第4版)进行。6例患者体格检查均无出血点、紫癜等,肝脾无肿大,凝血功能检测均正常。
1.2 仪器与试剂 采用希森美康sysmex-XN9000全自动血细胞分析仪及其原装的配套试剂,EDTA-K2抗凝、肝素钠抗凝、枸橼酸钠凝真空采血管,洁净的玻璃管。准备人工计数的草酸铵稀释液、瑞氏染液、牛鲍计数板、玻片及OLYMPUS显微镜,草酸铵稀释液及瑞氏染液按照 《全国临床检验操作规程》(第4版)配制。
1.3 方法
1.3.1 仪器法 分别用 EDTA-K2、肝素、枸橼酸盐抗凝管采集患者静脉血2ml,充分混匀,立即上机检测,检测前用配套的血液分析质控品进行质控检测,室内质控在控后进行标本检测,检测前、中、后仪器状态良好。血小板的参考范围是(100-300)×109/L。
1.3.2 仪器稀释法 取清洁小试管1支加入300ul的CELLPACK DCL稀释液,采集末梢血50ul入准备好的玻璃试管中,擦去管外余血,置于稀释液中,充分混匀,立即采用sysmex-XN9000的稀释模式进行测试。该项测定方法已通过15189实验室认证,且与sysmex-XN9000仪器静脉全血检测比对,比对通过。
1.3.3 手工法 用血小板稀释液草酸铵稀释采集的末梢血20ul,按照《全国临床检验操作规程》(第4版)操作人工计数。取清洁小试管1支加入0.38ml 1%草酸铵稀释液;准确采集患者末梢血20μl,擦去管外余血,置于试管内,立即充分混匀,室温静置,待完全溶血后再次混匀1min;取均匀的血小板悬液1滴,充入计数池内,放置10min~15min,待血小板下沉后在1h内完成计数。
1.3.4 瑞氏染色 分别对 EDTA-K2、肝素钠、枸橼酸钠抗凝血及末梢血涂片,用瑞氏染液进行染色,用显微镜观察血小板的形态、分布情况及有无聚集现象。
2 结果
6例患者均排除采血原因、仪器故障导致的血小板减少。EDTA-K2抗凝血常规报告中白细胞、红细胞均正常,单独出现血小板减低,且血小板直方图均存在异常,有2例患者白细胞直方图出现明显异常,血涂片镜检1例患者出现血小板卫星现象,其他5例出现血小板聚集,6例患者都由血涂片证实血小板假性减少。1例患者出现肝素、枸盐酸盐抗凝血血小板仍低下,仪器稀释及手工计数血小板正常,是多种抗凝剂引起的假性血小板减低。另外5例用肝素钠、枸盐酸钠、仪器稀释及手工法血小板数量处于正常范围,并且血小板直方图无明显异常。明确有5例是由EDTA引起的血小板假性减少,结果见表1。
3 讨论
EDTA-PTCP是一种发生在体外的血小板聚集现象,国内外研究报道EDTA-PTCP的发生率为0.07%~0.2%[1-4], 不少报道显示这种现象不仅发生在健康个体,也发生在恶性肿瘤、慢性肝病、自身免疫病及心血管疾病[5]。虽然发生率低,却给临床工作带来困扰。
目前EDTA-PTCP的发生机制至今仍不明确,Gowland[6]率先提出可能血清中存在某些抗体使血小板聚集和EDTA改变血小板表面结构的假说,自此血小板的聚集逐渐引起大家关注。目前普遍认为EDTA螯合钙离子,使血小板活化从而发生形态的改变,导致血小板膜蛋白GPⅡb/Ⅲa异二聚体构像发生改变,同时也使得血小板隐匿抗原的暴露,经过一系列通路导致血小板膜上的磷脂酶A2活化,该酶会激活花生四烯酸(ASA)代谢通路,最终形成导致血小板聚集的血栓烷A2,活化血小板纤维蛋白原受体,促使血小板与纤维蛋白原聚集成团[7-9]。仝德胜[10]等研究者认为在EDTA-K2作用下出现的免疫介导血液中的冷抗血小板自身抗体,使血小板发生凝聚。
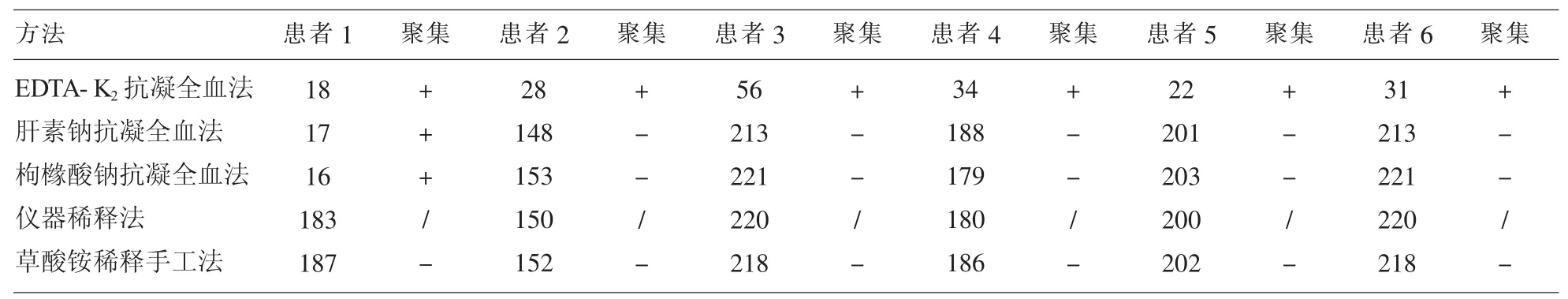
表1 6例患者血小板检测及涂片镜检结果(×109/L)
在平常的检验工作中,用血细胞分析仪对EDTA抗凝的标本进行计数时,要特别重视血小板减少的现象,尤其是单独的血小板减低,仔细观察标本有无凝块,认真查看血液分析仪图形及报警提示,同时涂片镜检观察有无大血小板及聚集现象,及时与临床沟通有无采血不顺畅及患者有无出血症状。排除其他原因造成血小板假性减低,如发现血小板聚集,可以从以下几个方面进行解决:一、重抽血复查,用不同的抗凝剂进行比对,如肝素、枸盐酸盐等,并同时进行涂片染色镜检,避免因为EDTA引起的血小板假性减少的发生,有研究显示换用MgSO4也能有效解决血小板计数问题[11]。然而换用抗凝剂只能解决EDTA引起的血小板聚集,对多种抗凝剂引起的聚集现象不起作用,比如我们的研究患者1换用抗凝剂就不能很好的得到正确的报告,此方法不宜作为首选。二、仪器稀释法,采用全血或末梢血置于稀释液中,再上机检测,能很好的避免人工计数不准确的弊端,但是这种方法须立即置于稀释液中和上机检测,否则离体的血液会凝固引起计数误差。三、手工计数,采取末梢血和草酸铵稀释液以一定的比例进行稀释,在显微镜下计数,此方法虽然操作较为复杂,对人员要求高,但对EDTA-PTCP有效,而且对其他抗凝剂引起的血小板聚集也有效,手工计数常作为首选方法。四、有文献报道,在不改变抗凝剂的情况下,加入阿米卡星可以使已经聚集的血小板发生解聚[12,13]。加入阿米卡星可以减少患者重复采血,避免麻烦。张莉[14]研究显示加入阿米卡星须在30min内完成,超过30min对血小板解聚作用弱,而常菁华[15]等人证明不同患者对阿米卡星有敏感型和加速型,加入阿米卡星须在4h完成,在1h内能达到理想效果,否则达不到解聚作用。
总之,临床工作中,虽然EDTA-PTCP发生率小,但仍应引起检验工作者的重视,血小板结果的准确性直接影响患者的诊断和治疗,漏检EDTAPTCP,会给医生带来错误的指导,导致误诊、错治,给患者带来不必要的检查及心理负担,应加强检验与临床的沟通,不能过分依赖仪器检测,细胞形态学镜检不容忽视,且EDTA-PTCP发生的机制不是很明确,仍有待进一步研究。
[1]Sweeney JD,Holme S,Heaton WA,et al.Pseudothrombocytopenia in plateletpheresis donors[J].Transfusion,1995,35(1):46-49.
[2]Wu W,Guo Y,Zhang L,et al.Clinical utility of automated platelet clump count in the screening for ethylene diamine tetraacetic acid-dependent pseudothrombocytopenia[J].Chin Med J(Engl),2011,124(20):3353-3357.
[3]Mao WY,Huo M,Ye SD,et al.Experimental analysis and countermeasures for EDTA-dependentPseudothrombocytopenia[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2014,22(5):1345-1347.
[4]王怀莲,王颖.血小板假性减少的原因分析[J].中国医药指南,2016,14(12):54.
[5]Shi X,Lin Z,He L,et al.Transient appearance of EDTA-dependent pseudothrombocytopenia in a postoperative patient with sepsis:A case report[J].Medicine(Baltimore),2017,96(11):e6330.
[6]Gowland E,Kay HE,Spillman JC,et al.Agglutination of platelets by a serum factor in the presence of EDTA[J].J Clin Pathol,1969,22(4):460-464.
[7]Lippi G,Plebani M.EDTA-dependent pseudothrombocytopenia:further insights and recommendations for prevention of a clinically threatening artifact[J].Clin Chem Lab Med,2012,50(8):1281-1285.
[8]Chae H,Kim M,Lim J,et al.Novel method to dissociate platelet clumps in EDTA-dependent pseudothrombocytopenia based on the pathophysiological mechanism[J].Clin Chem Lab Med,2012,50(8):1387-1391.
[9]Shi X,Lin Z,He L,et al.Transient appearance of EDTA-dependent pseudothrombocytopenia in a postoperative patient with sepsis:A case report[J].Medicine(Baltimore),2017,96(11):e6330.
[10]仝德胜,杨静,沈国强.抗凝剂EDTA导致血小板假性减少现象的分析[J].实验与检验医学,2015,33(1):102-103.
[11]Schuff-Werner P,Steiner M,Fenger S,et al.Effective estimation of correct platelet counts in pseudothrombocytopenia using an alternative anticoagulant based on magnesium salt[J].Br J Haematol,2013,162(5):684-692.
[12]Zhou X,Wu X,Deng W,et al.Amikacin can be added to blood to reduce the fall in platelet count[J].Am J Clin Pathol,2011,136(4):646-652.
[13]赵丽艳,刘昕鸣,庞孟煜,等.硫酸阿米卡星对EDTA依赖性假性血小板减少症血小板聚集的解离作用[J].吉林大学学报(医学版),2010,36(1):178-182.
[14]张莉.阿米卡星在EDTA依赖性假性血小板减少的探讨[J].国际检验医学杂志,2017,38(2):269-270.
[15]常菁华,王剑飚.EDTA依赖性假性血小板减少的实验室解决思路[J].检验医学,2014,29(7):733-737.
