中缅边境流行区恶性疟原虫野生株驯化方式的研究
2018-03-13韦焕苹洪明阳朱晓彤曹雅明
闫 妍 韦焕苹 洪明阳 朱晓彤 曹雅明
(中国医科大学免疫学教研室,辽宁沈阳 110122)
疟疾是严重危害人类健康的重要全球性虫媒传染病。过去十年,虽然世界各地抗疟的努力大大削弱了疟疾的传播,但疟疾特别是在热带地区仍威胁着数百万儿童的生命(WHO, 2017)。疟疾实验室研究在许多重要科研进展的推动下发展迅速,其中就包括疟原虫的红内期体外培养。至今只有恶性疟原虫Plasmodiumfalciparum和诺氏疟原虫P.knowlesi可体外连续长期培养,且前者是导致人类疟疾发病率和死亡率最高的疟原虫(Grüringetal., 2014; Claessensetal., 2017)。1976年William Trager等建立了对恶性疟原虫体外无性阶段超过50 d的连续培养,大大加速了恶性疟原虫的研究进展(Trageretal., 1976)。恶性疟原虫体外培养的出现奠定了疟疾科学研究的基础,为疟疾的研究及药物的发展开启了一扇大门。人血浆为恶性疟原虫体外培养重要的营养成分,但是由于其不能商品化,在探索恶性疟原虫体外培养的历史中,研究人员试图体外使用动物血浆来代替人血浆,但是并没有获得成功(Ifedibaetal., 1980; Divoetal., 1982; Divoetal., 2010)。
自然选择过程使物种适应环境,体外培养的恶性疟原虫同样在体外生长过程中逐渐适应实验室环境而最终处于基因稳定状态(Stewart, 2012; Epstein, 2013),参照《中华人民共和国种子法》的有关定义处于基因稳定的虫株具有寄生虫学研究价值,可作为恶性疟原虫种质资源。美国标准菌种收藏中心(American Type Culture Collection-ATCC)收藏了多种活体疟原虫,其中包括多种恶性疟原虫株FCR-1、HB-2、HB-3等,它们被广泛的用于疟疾研究。但是中国恶性疟原虫标准株建立及虫株资源却相对匮乏,而生物活体资源的保存及开发已成为评价国家综合国力的指标之一,因此建立适应我国实验室条件的恶性疟原虫标准株具有重要意义。本研究旨在探讨恶性疟原虫野生株体外培养的驯化方法,采用添加ALBUMAX II 及次黄嘌呤的改良培养基配方(Srivastava, 2007),通过逐渐脱离人血浆的培养方式进行人工驯化临床恶性疟原虫株。最终建立了可脱离人血浆连续培养的实验室活体虫株,为今后恶性疟原虫实验室研究做积累。
1 材料与方法
1.1 材料
RPMI Medium 1640(gibco)、HEPES(GENVIEW)、NaHCO3(北京化工)、次黄嘌呤(MACKLIN)、ALBUMAX II(gibco)、庆大霉素(华润双鹤)、健康人A型红细胞(沈阳市中心血站)、健康人A型血浆(沈阳市中心血站)、哌喹(DBI)、双氢青蒿素(DBI)、甲氟喹(SIGMA)、氯喹(SIGMA)、萘酚喹(MCE)、D-山梨醇(SIGMA)、SYBR green(Thermo)、吉姆萨染液(Solarbio)、人造香柏油(上海标本模型厂)、离心管(15 mL、50 mL,BEAVER)、25T培养瓶(LabServ)、无菌注射器(50 mL,上海凯乐)、孔径0.22 μm滤器(MILLEX)、96孔培养板(Sunub)、96孔药测板(上海晶安)、载玻片(SAIL BRAND)。
1.2 流行区恶性疟原虫野生株的采集
恶性疟原虫野生株F09A28、F09H34、N13-1231、N13-29、N13-764、N13-579、F07-50、F08B71、F08B38、F09N76、N13-1047、N13-1124,取于中缅边境2007~2009年疟疾感染区临床病人血样,样本采集均获中国及缅甸卫生部医学伦理委员会批准。采集病人新鲜抗凝血样经过涂片吉姆萨染色及快速诊断试验(Rapid diagnostic test, RDTs)诊断为恶性疟原虫单一感染;经RPMI-1640培养基洗涤3遍去除血浆及白细胞,取100 μL样本血添加150 μL新鲜洗涤红细胞进行培养。
1.2.1恶性疟原虫培养条件: 红细胞压积2.5%;培养体系10 mL;培养液采用添加ALBUMAX II 及次黄嘌呤的改良培养基配方,1 L培养基成份及量为:RPMI 1640 10.4 g,NaHCO32.1 g,HEPES 5.94 g,ALBUMAX II 5 g,次黄嘌呤 0.05 g,庆大霉素 50 mg;培养环境为37 ℃,5% CO2,5% O2,90% N2气体孵箱;无菌环境。培养液在复苏初期对临床虫株进行驯化的过程中加入2%人血浆,虫株生长平稳后撤掉血浆,生长平稳即形态:环状体期环结构完整清晰,滋养体及裂殖体期胞浆丰富饱满且虫体结构完整;虫株每个生长周期的增长率基本一致为生长稳定状态。培养方法:换液,根据感染率情况决定换液时间,原虫感染率 <1%,间隔48 h换液;1% < 原虫感染率 < 4%时,间隔24 h换液。在保持恶性疟原虫感染率于0.2%~1%之间的同时按时补充新鲜的红细胞,如培养物寄生率过低或无法查看到原虫则采用二倍稀释的方式每周进行1次新鲜红细胞的补充,且在每周中间即第3~4 d时吸走70 μL培养瓶中血同时添加70 μL的新鲜红细胞于10 mL培养体系中,进而保证红细胞的新鲜。
1.2.2恶性疟原虫5%山梨醇同步化: 当恶性疟原虫的感染率 >1%,环状体比率 >30%时,取虫血,加入10倍体积的5%山梨醇,边加边混匀。37 ℃孵育10 min,去上清,加入10倍体积不完全培养基,快加,混匀重悬红细胞后离心。由于渗透压的作用,恶性疟原虫各个时间的虫株只有环状体期可存活,以此可同步虫株处于环状体时期。
1.2.3人血浆对实验室驯化过称虫株生长影响探究: 在复苏后第28 d选择生长情况较稳定的2株虫株N13-1231、N13-764,分为4瓶培养:N13-1231加人血浆组、N13-1231无人血浆组、N13-764加人血浆组、N13-764无人血浆组。N13-1231及N13-764加人血浆组分别给予含2%人血浆的培养基培养;起始24 h感染率均调整为0.5%且同步化为环状体时期,连续观察120 h,每24 h进行感染率的计数。
1.2.4人血浆对实验室驯化后虫株生长影响探究: N13-1231和F08B38两株虫株1~38 d进行2%人血浆培养,第38 d撤掉人血浆后依旧生长稳定。两株虫株体外培养第38 d分别设置加血浆组及不加血浆组进行生长情况观察,两株虫株于第38 d冻存处理,留微量液体补液补血继续培养,默认初始感染率为0做分析,每个2 d(每虫株生长周期)对4组虫株感染率监测,对第38~46 d数据进行分析。
1.2.5虫株药物敏感性测定(SYBR green半数抑制浓度值IC50法): 恶性疟原虫同步化至环状体比率 >70%。配制恶性原虫细胞悬浊液,配制红细胞压积为2%原虫感染率为0.5%细胞悬浊液。药物稀释液与配置好的疟原虫细胞液混匀于96孔板中在37 ℃ CO2培养箱培养72 h;置药板-80°冰箱30 min后室温放置至孔中虫血完全溶化,加入等体积的SYBR green 的裂解液,混匀后,避光放置0.5 h,转移入96孔黑色酶标板。采用Bio-Rad酶标仪,采用485 nm激发波长和535 nm发射波长测量荧光信号值。对适应体外连续培养的恶性疟原虫株N13-1231,F08B38进行抗疟药物哌喹(PQ)、双氢青蒿素(DHA)、甲氟喹(MQ)、氯喹(CQ)、萘酚喹(NQ)体外药物敏感性测定。
1.2.6统计学分析: 应用GraphPad Prism拟合出抗疟药物抑制曲线及计算抗疟药物IC50值;人血浆对恶性疟原虫培养影响显著性分析:首先检验加人血浆和不加人血浆感染率差值随时间的变化是否有显著趋势,如果有则表明加血浆与不加人血浆对恶性疟原虫的培养有显著差别。如果没有显著趋势,则需检验差值是否为0,如果接受为0则表示没有显著差异,否则有显著差异。趋势检验采用KPSS平稳性检验,差值为0的检验采用t检验。对于人血浆和时间变化对恶性疟原虫生长进行多因素相关性分析,应用matlab进行多元线性回归模型拟合,拟合方程可见时间及人血浆对感染率的影响相关性正负及相对大小;复决定系数R2可见人血浆及时间对虫株感染率相关性强弱,越接近1,则相关性越强。
2 结果
2.1 12株恶性疟原虫野生株体外培养生长情况
N13-29和F08B71株复苏失败。另外10株进行加2%人血浆培养基培养至第38 d,此时虫株生长稳定即每个周期增长倍数稳定且虫株环状体期形态完整,滋养体裂殖体胞浆丰富完整疟色素及核完整清晰,配子体罕见,显微镜下死虫罕见。10株虫株复苏0~144 h生长曲线见图1,横坐标为复数后的小时数,每隔24 h做一次换液及吉姆萨染色计数感染率,纵坐标为虫株的活虫感染率。生长曲线可见复苏初期虫株的生长情况不一,曲线的斜率表示虫株的生长快慢。图中可见复苏后0~144 h内N13-764虫株生长速率最快,且在第96 h开始生长加速生长;F09N76生长速率最慢,曲线极其平缓;且各个虫株都表现为复苏后的生长速率逐渐增加,是虫株逐渐适应体外实验室培养的过程。
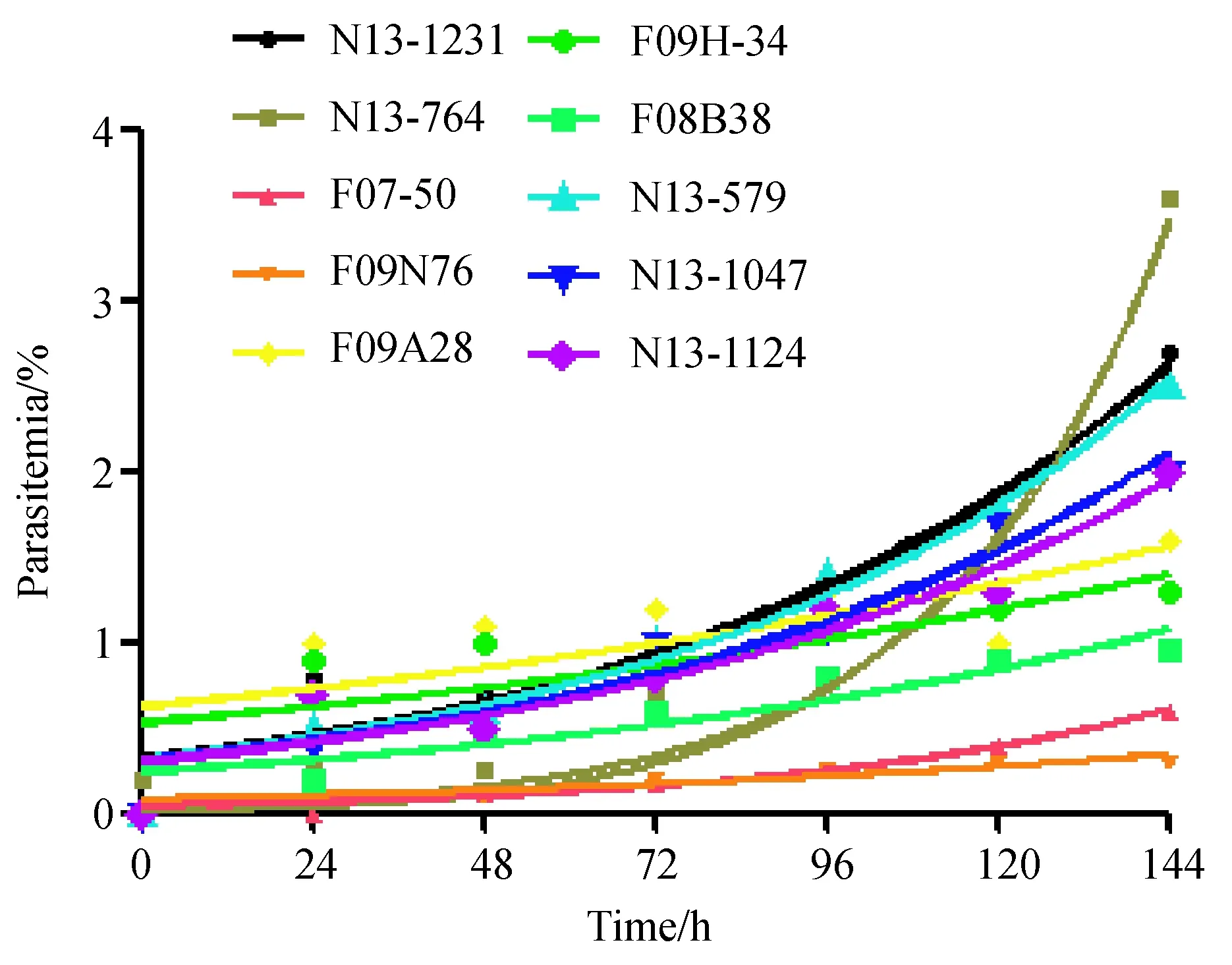
图1 10株恶性疟原虫复苏后0~144 h的生长曲线Fig.1 Growth curve of 10 P. falciparum isolates in 0-144 hours after recovery不同颜色曲线表示不同虫株 Different color curves represent different strains.
2.2 人血浆对实验室驯化过程中虫株生长影响
探讨人血浆对于体外培养临床恶性疟原虫的驯化过程作用,在复苏后第28 d对N13-1231加人血浆、N13-1231不加人血浆、N13-764加人血浆、N13-764不加人血浆4组虫株,由于虫株的连续生长至120 h感染率已经大于5%,必须进行处理来调整感染率,这样就进行了一个新的120 h起始生长周期,且一般认为疟原虫经3周左右的适应性培养即可达到稳定状态,综上选择第5个120 h对4组虫株连续观察,每24进行感染率的计数后进行统计分析观察120 h,结果见下图2,横坐标表示时间,每24 h为1个观测点,对虫株进行换液及感染率分虫株时期计数;纵坐标为计数的2 000个红细胞中活虫数量;不同色块代表实验组是否加人血浆培养。将加血浆数据和未加血浆对应时间的数据相减,得到时间序列,通过KPSS检验法检验时间序列的平稳性,即加血浆和不加血浆感染率差值是否有明显随时间变化趋势。原假设为平稳,备选假设为不平稳。通过计算得N13-1231拒绝原假设,具有显著差异,P=0.033,N13-764拒绝原假设,具有显著差异,P=0.047,即血浆在驯化过程中对虫株的生长具有不可替代的作用。人血浆和时间变化对恶性疟原虫生长影响进行多因素相关性分析,通过多元线性回归模型拟合,拟合平面见图4,其中横向(x)为是否加人血浆(加为1,不加为0);纵向(y)为时间(h);竖向(z)为感染率(%)。N13-1231拟合方程为z= -0.9353+0.4806x+0.04391y;N13-764拟合方程为z=-0.5544+0.737x+0.0134y。可见时间及人血浆与虫株生长为正相关;N13-1231复决定系数R2=0.760,N13-764复决定系数R2=0.716,说明人血浆和时间变化对恶性疟原虫生长相关性较强。
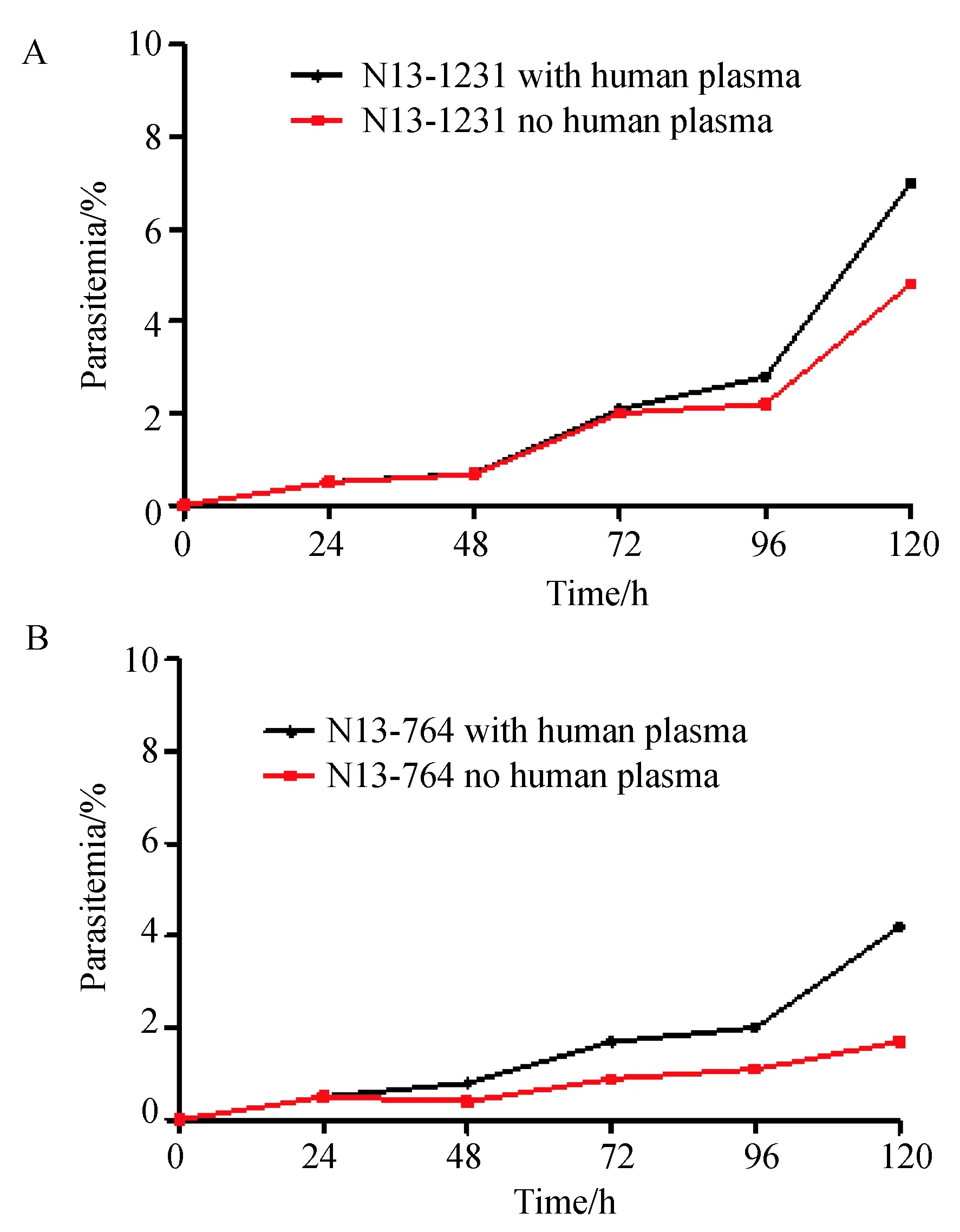
图2 人血浆对恶性疟原虫株培驯化过程生长影响Fig.2 Effect of human plasma on the domestication and growth of P.falciparum isolates in 120 hoursA. N13-1231虫株生长折线图; B. N13-764虫株生长折线图。B. A. Line chart of N13-1231 growth; B. Line chart of N13-764 growth.
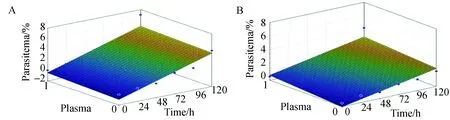
图4 人血浆和时间与恶性疟原虫株驯化过程生长多因素关联性分析Fig.4 Multivariate correlation analysis between human plasma,time and parasitemia during acclimationA. N13-1231虫株; B. N13-764虫株。A.P. falciparum isolate N13-1231;B. P. falciparum isolate N13-764.
2.3 人血浆对实验室驯化后虫株生长影响
N13-1231和F08B38两株虫株体外连续加灭活去纤维蛋白原人血浆培养第38~46 d分别设置加血浆组及不加血浆组,生长曲线见图3,横坐标为复苏起后虫株连续培养的天数;纵坐标为原虫感染率,两株虫株于第38 d冻存处理,默认初始感染率为0做分析;曲线黑色为N13-1231加人血浆培养组,灰色为N13-1231无人血浆培养组;红色为F08B38加人血浆培养组,粉色为F08B38无人血浆培养组。继续无血浆培养至第90 d,两株虫株生长一直保持平稳。将加血浆数据和未加血浆对应时间的数据相减,得到时间序列,通过KPSS检验法检验时间序列的平稳性,即加血浆和不加血浆感染率差值是否有明显随时间变化趋势。原假设为平稳,备选假设为不平稳。N13-1231 KPSS检验没有显著趋势,P=0.0837,t检验没有显著差异,P=0.3347。F08B38 KPSS检验没有显著趋势,P=0.1,t检验没有显著差异,P=0.5767。结果可见血浆对于驯化成功虫株生长影响无统计学差异。
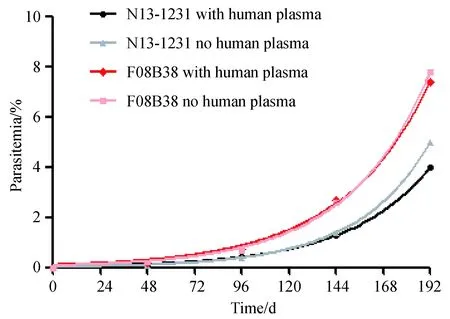
图3 N13-1231和F08B38生长曲线(38~46 d)Fig.3 The growth curves of N13-1231 and F08B38 between 38-46 days
2.4 薄血片吉姆萨染色恶性疟原虫形态
恶性疟原虫株N13-1231,F08B38体外90 d连续培养,各个时期虫株形态,见图5-A,从左至右分别复苏后第10个生长周期显微镜油镜下为环状体、滋养体、裂殖体期虫株形态,可见环状体期环结构完整清晰,滋养体及裂殖体期胞浆丰富饱满且虫体结构完整,为生长稳定活跃状态,两虫株已适应体外无血浆培养连续培养。恶性疟原虫株驯化过程中撤掉血浆后会出现配子体增多现象,见图5-B,从左至右分别为第28 d驯化过程中撤掉血浆组虫株血片出现的未成熟配子体、雌配子体、雄配子体期虫株油镜下形态。
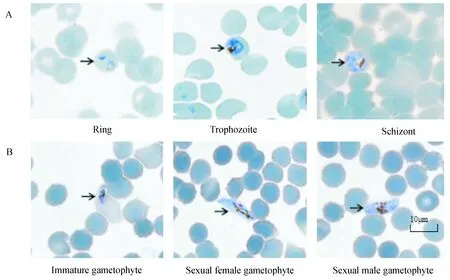
图5 野生株恶性疟原虫体外培养形态观察Fig.5 Morphological observation of P. falciparum wiled isolates cultured in vitroA. N13-1231、F08B38虫株3个时期显微镜下(10×100)形态; B. 退化虫株三种配子体显微镜下(10×100)形态。A. The morphology of three stages from N13-1231 and F08B38 isolates under microscope (10×100); B. The morphology of three gametocyte from degenerate strains under microscope (10×100).
2.5 体外抗疟药物抑制曲线及IC50值
N13-1231、FO8B38虫株体外5种抗疟药物抑制曲线,为药物浓度log10值与抑制率关系曲线,不同药物的测定都设立一个3D7标准株对照,可知3D7为药物敏感株。见图6,横坐标为药板终浓度的log10值,纵坐标为对应浓度药物对虫株生长抑制率,不同颜色代表不同抗疟药物;参考文献中抗疟药物抗性阈值PQ 12.80、DHA 7.70、MQ 20.00、CQ 25.00、NQ 5.24 nmol/L(Price, 1999; Suwandittakul, 2009; Cui, 2012; 郝明明, 2013; 袁丽莉, 2013),可见N13-1231虫株具有PQ、DHA及MQ抗性,而CQ、NQ敏感性;F08B38虫株具有PQ、DHA、CQ抗性,而MQ、NQ敏感性。
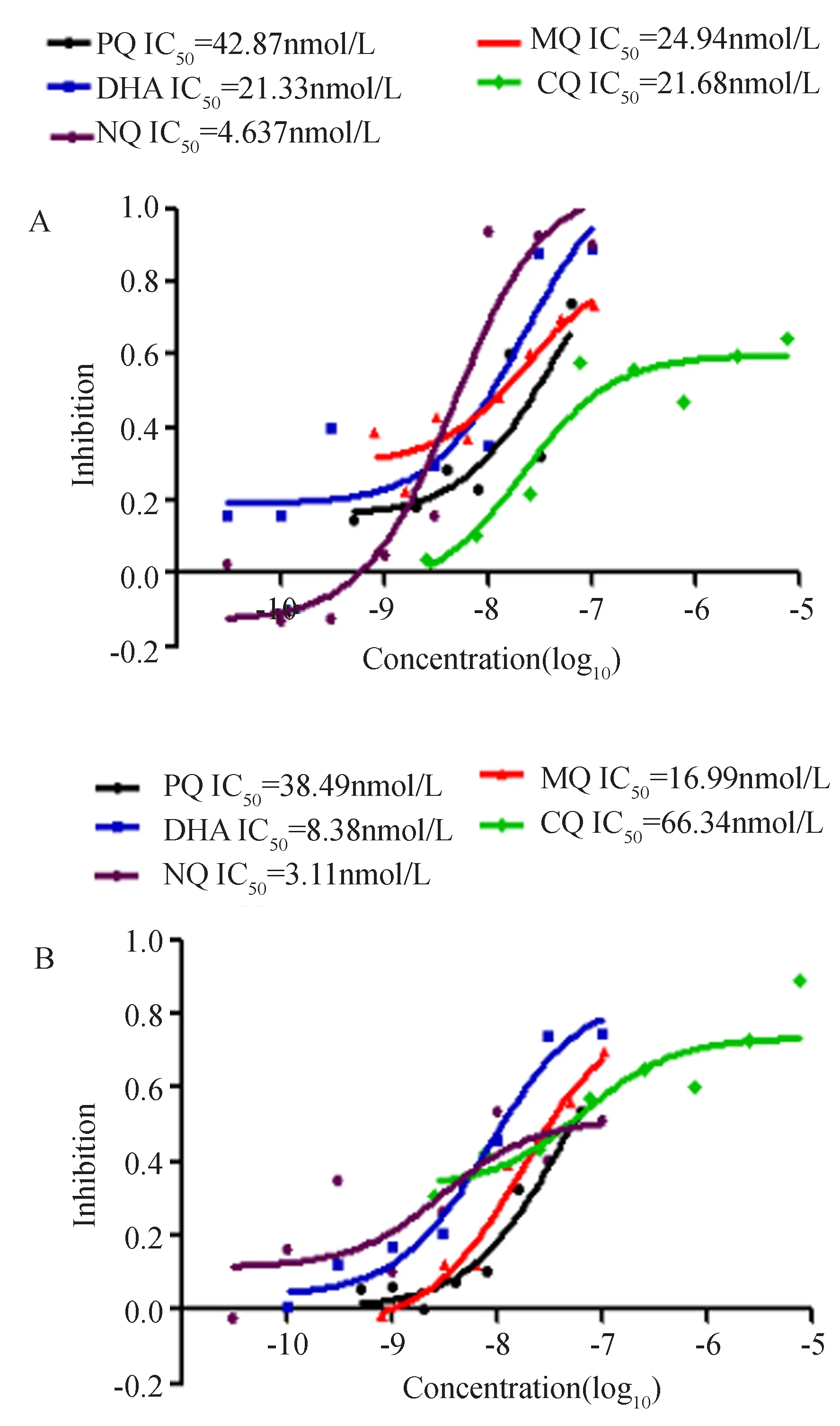
图6 体外5种抗疟药物抑制曲线Fig.6 The inhibition curves of five antimalarial drugs in vitro cultureA. N13-1231虫株; B. F08B38虫株。A. N13-1231 P. falciparum isolates; B. F08B38 P. falciparum isolates.
3 讨论
体外复苏0~6 d(0~144 h)恶性疟原虫株生长拟合曲线各个点曲线斜率不同,反映了不同虫株的生长速率不一致性。尽管复苏的虫株冻存体系一致(红细胞250 μL,疟原虫环状体感染率2%),但仍然会有冻存时活虫多少的量误差。冻存时环状体期的早晚也是影响复苏后生长速率的因素,除人为操作影响因素外虫株自身红细胞侵袭能力有关。有研究发现裂殖子表面蛋白1(Msp 1)与恶性疟原虫的红细胞侵袭能力有关,裂殖子表面主要的GPI相关蛋白,可能参与逃避宿主免疫应答为机制(Holder, 1994)。恶性疟原虫体外培养的历史中,研究人员试图在体外培养初期使用动物血浆来代替人血浆,但是并没有获得成功(Ifediba, 1980; Divo, 1982; Divo, 2010)。本实验中在两株恶性疟原虫株体外培养初期加人血浆和不加人血浆对照组KPSS时间序列平稳性检验差异具有统计学意义,人血浆和时间变化对恶性疟原虫生长影响进行多因素相关性分析,可见时间及人血浆与虫株生长为正相关,且人血浆和时间变化对恶性疟原虫生长相关性较强。进一步证实恶性疟原虫体外驯化过程中,人血浆为必不可少的营养成分。复苏生长至38 d撤掉人血浆培养,此时所有虫株体外驯化生长平稳,虫株为N13-1231和F08-38可在无人血浆的培养条件下平稳连续生长至90 d,其余虫株逐渐退化。人血浆不能商品化生产,实验室使用存在供应途径及量的问题,且人血浆成分不利于科研实验设计,因此本实验采自中缅边境恶性疟流行区两虫株可在无血浆长期连续培养具有科学研究价值。N13-1231和F08B38体外驯化成功不需要人血清/血浆生长刺激,基因型稳定(Duffyetal., 2018),在后续研究中需进行测序以明确虫株的基因型。对驯化成功两虫株进行抗疟药物敏感性测定,所测结果N13-1231虫株具有PQ、DHA及MQ抗性,F08B38具有PQ、DHA、CQ抗性,取样于中缅边境地区,此地区有报道出现DHA-PQ联合用药抗药性及MQ、CQ抗药性(郝明明, 2013; WHO, 2017),两虫株对抗药性机制研究及地域性基因突变进化具有价值,对于抗性是否稳定仍需以后长期观察。
恶性疟原虫临床株实验室培养驯化过程中人血浆成分不可取代。N13-1231和F08-138两虫株,通过实验室初期加人血浆培养逐渐过渡适应无血浆且长期连续培养,具有恶性疟科学研究价值。两实验室新株具有特定的实验室抗性,其中N13-1231虫株具有PQ、DHA及MQ抗性而CQ、NQ敏感性;F08B38具有PQ、DHA、CQ抗性MQ、NQ敏感性。本研究可为今后疟原虫实验室研究提供活体虫株资源及实验室依据。
