超声引导下经皮微波消融治疗原发性肝癌患者疗效分析*
2018-03-13柏涛龚凤云胡旭东王娟夏冰程海林甘丽娟
柏涛,龚凤云,胡旭东,王娟,夏冰,程海林,甘丽娟
原发性肝癌(PLC)是一种常见的恶性肿瘤。流行病学调查显示PLC发病率呈不断上升的趋势[1]。手术切除仍为治疗PLC患者的首选方法,但大部分患者因多发病灶、严重的肝硬化及病灶靠近大血管等不能接受手术[2,3]。超声引导下经皮消融是一种微创的肝肿瘤治疗方法,也越来越受到临床医师的重视[4]。α-1胸腺素应用于肝癌和自身免疫缺陷性疾病的治疗,取得了良好的疗效[5]。本研究旨在探讨在超声引导下经皮微波消融治疗肝癌患者继续接受α-1胸腺素巩固治疗,对肿瘤复发和转移的影响,现将结果报道如下。
1 对象与方法
1.1 研究对象 2011年3月~2013年3月我院收治的PLC患者104例,男性76例,女性28例;年龄30~75岁,平均年龄(48.53±4.15)岁。经临床和组织病理学检查诊断为HCC。肝功能Child A级64例,B级40例。纳入无肝外转移患者。排除标准:①合并其他恶性肿瘤者;②顽固性腹水、食管胃底静脉曲张破裂出血或有肝性脑病史者;③合并肺、肾、心等功能严重障碍者;④对药物过敏者;⑤精神疾病者。采用随机数字表法将患者分为观察组52例和对照组52例,两组一般资料比较无统计学差异(P>0.05)。本研究经我院医学伦理委员会批准,患者签署知情同意书。
1.2 射频消融治疗 在对照组,采用超声引导下经皮微波消融术治疗,使用美国RITA射频消融系统(美国Angiodynamics公司)和GE LOGIQ E8彩色多普勒超声诊断仪(美国GE公司)。于介入治疗前,给予哌替啶(青海制药厂有限公司)、地西泮(南通精华制药股份有限公司)静脉注射。局部麻醉,在超声引导下穿刺,消融范围超出肿瘤边缘0.5~1.0 cm。对于肿瘤直径≤1.3 cm者,使用单针电极治疗。对于肿瘤直径>1.3 cm者,使用联合双极电极治疗。行完全热凝,术后实施针道消融,防止术后针道出血或者肿瘤种植;在观察组,在超声引导下行经皮微波消融术,术后给予α-1胸腺素(海南双成药业有限公司)1.6 mg皮下注射,3次/w,连续治疗4 w。
1.3 检测 使用流式细胞仪检测外周血CD3+、CD4+细胞和CD4+/CD8+比值(美国BD公司FACSCantoll流式细胞仪);采用化学发光免疫定量法检测血清甲胎蛋白(alpha fetoprotein,AFP,西门子 Centuar配套试剂盒和西门子Centuar化学发光仪);使用日本日立7600型全自动生化分析仪及其配套试剂盒检测血生化指标。
1.4 统计学处理 应用SPSS 16.0统计学软件进行数据分析,应用 Microsoft Excel建立数据库,计量资料以(±s)表示,采用 t检验;计数资料的比较采用卡方检验;采用Kaplan-Meier绘制生存曲线,两组生存曲线的比较采用Log-Rank检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组外周血T淋巴细胞亚群的变化 在治疗4周结束时,两组均未出现死亡病例。观察组CD3+、CD4+、CD4+/CD8+比值显著高于对照组(P<0.05,表1)。
2.2 两组肝功能指标和血清AFP比较 在4周后,观察组血清ALB水平显著高于对照组,ALT、AST、AFP水平显著低于对照组(P<0.05,表2)。
表1 两组外周血T淋巴细胞亚群(±s)的变化
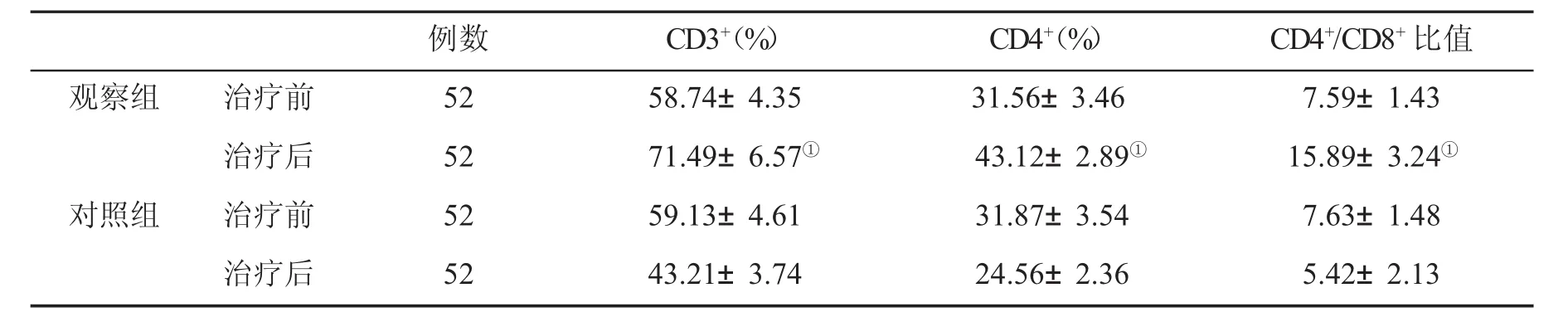
表1 两组外周血T淋巴细胞亚群(±s)的变化
与对照组比,①P<0.05
?
表2 两组肝功能指标和AFP(±s)比较

表2 两组肝功能指标和AFP(±s)比较
与对照组比,①P<0.05
?
2.3两组并发症情况 观察组术后4例出现气胸,对照组出现6例气胸。
2.4 两组复发和转移情况 随访3年,观察组肿瘤复发率和远处转移率显著低于对照组(P<0.05,表3)。
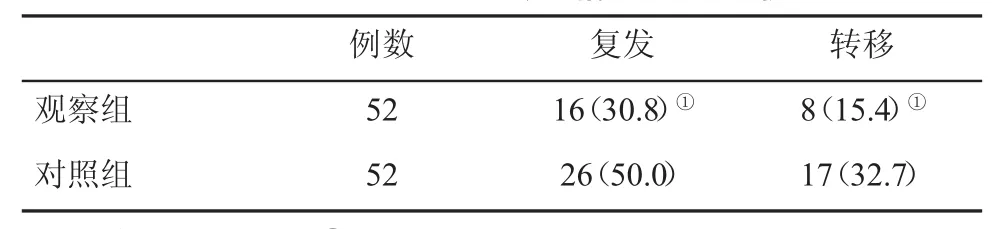
表3 两组复发和转移情况(%)比较
2.5 两组生存率比较 观察组3 a生存率为23.1%(12/52),显著高于对照组的 5.8%(3/52,P<0.05)。
3 讨论
不足30%PLC患者适用于手术切除治疗[6-8]。超声引导下经皮微波消融是治疗肝癌非手术方法的一种,微波消融系统包括微波发生器、微波天线、同轴电缆3个基本组件,为能够获得较大消融坏死体积且方便穿刺进针,通常多应用针状线型微波天线[9-11]。该法具有相对安全、创伤小以及无严重并发症等特点,其目的主要在于通过利用热效应高温致使癌细胞死亡,而射频消融主要通过高频交变电流导致电极附近组织离子高速震动受热,传导加热至远处组织[12-15]。张雪花等[16]研究表明,采用超声引导下微波消融治疗PLC患者术后并发症主要有疼痛、发热、高血压、肝功能受损等,多为一过性、且具有可逆性。
胸腺素是胸腺组织上皮细胞分泌的一种多肽激素,而胸腺素α1是从人胸腺素第5组分中纯化出来的生物因子,具有促进淋巴细胞功能和体内细胞因子分泌作用。胸腺素α1是一种由28个氨基酸组成的多肽,分子量为3108 KD,且为生物反应调节因子,能够特异性地诱导Lyt1+、2+、3+T细胞表面标志的表达,促使自然杀伤细胞和T淋巴细胞的分化和成熟,促进致敏的T细胞在各种有丝分裂原或抗原刺激后产生各种淋巴因子,同时还可激活T4细胞,提高异体和自体淋巴细胞反应,从而增强机体的免疫功能[17,18]。胸腺素-α1可能影响自然杀伤细胞前提细胞的募集,前体细胞暴露于干扰素后变得更有细胞毒性,从而使得机体能够有效发挥免疫防护功能[19-22]。此外,胸腺素-α1还具有增强红细胞免疫功能、增强巨噬细胞吞噬功能、增强外周血单核细胞γ-干扰素的产生及增强超氧化物歧化酶活性作用[23,24]。本研究结果表明,观察组生存率高于对照组,说明胸腺素-α1联合超声引导下经皮微波消融术治疗可延长PLC患者生存时间。观察组复发转移率低于对照组,说明胸腺素-α1联合超声引导下经皮微波消融术可降低肿瘤的复发或转移。
正常免疫功能的维持主要依赖于各种细胞因子和免疫细胞相互制约和相互协调,以产生适度的免疫应答,使其能够清除异物抗原,同时又不会使机体组织损伤,在肿瘤的形成过程中或者病毒感染中,均存在免疫功能的异常,致使恶性肿瘤的产生。PLC患者普遍存在免疫功能下降,可能与在肿瘤生长过程中产生或者分泌一些免疫因子,从而使得免疫细胞的增殖和分化受到抑制相关,进一步致使机体免疫功能受抑制程度随肿瘤发展而加重。免疫调节功能紊乱与机体免疫功能下降有利于肿瘤的生长,以及促进肿瘤的形成、扩展和转移。T淋巴细胞在免疫应答过程中具有重要作用,其中CD3+T细胞所特有的一种膜表面分子具有调节免疫功能的作用。CD4+细胞具有辅助性T细胞的功能,以及促进效应性细胞抗肿瘤作用。CD8+细胞具有细胞毒性T细胞的功能,且具有免疫抑制作用。CD4+/CD8+比值能够直接反映机体细胞免疫的功能状态。近年来,T细胞亚群的失调在PLC发生发展过程中的作用越来越受到关注。当出现T细胞亚群活性和数量改变,CD4+/CD8+比值失衡时,则会致使机体免疫紊乱且可发生肿瘤。因此,临床上对于PLC患者T淋巴细胞亚群检测对控制其发生、发展以及指导临床治疗具有重要的临床研究意义和重要的理论指导意义。本研究结果表明,术后对照组CD3+、CD4+、CD4+/CD8+比值增加,而观察组 CD3+、CD4+、CD4+/CD8+比值下降,观察组 CD3+、CD4+、CD4+/CD8+比值高于对照组,说明胸腺素-α1可明显增强患者免疫功能。观察组ALT、AST、AFP等的下降均优于对照组,提示超声引导下经皮微波消融治疗方案对肝功能影响较小,患者恢复更快。有研究报道显示,微波消融可杀灭肿瘤切缘的肿瘤细胞,减少肿瘤复发率,提高患者生存率。本研究随访3年,观察组复发率和转移率分别为30.8%和15.4%,显著低于对照组的50.0%和32.7%(P<0.05),观察组生存率为23.1%,显著高于对照组的5.8%(P<0.05)。
本研究还存在一些不足之处,观察例数相对较少,观察时间相对较短,故还需在后续研究中增加观察例数和延长观察时间,以提供可靠的临床资料。
[1]宋书红,郭俊,邹灿.肝癌手术切除术后复发相关因素分析.实用肝脏病杂志,2017,20(2):203-206.
[2]全彬,张波,王照红,等.TACE联合外科手术与单纯外科手术治疗原发性肝细胞肝癌的疗效对比研究.中外医学研究,2014,27(10):61-62.
[3]赵刚,张洪义,冯志强,等.介入栓塞和手术切除在肝癌术后复发治疗中的价值比较.海南医学院学报,2014,20(4):13-14.
[4]张婷婷,李开艳,张伟,等.经皮微波消融治疗术后复发性肝癌的长期生存影响因素分析.中华超声影像学杂志,2013,22(11):957-961.
[5]曹亮,郭彦伟,王志伟,等.胸腺素α1对改善中晚期肝癌肝动脉栓塞化疗术后肝损害的临床观察.药物与人,2014,19(7):92-92.
[6]张春晨,董勤.原发性肝癌发病相关因素研究进展.世界最新医学信息文摘,2015,8(75):19-21.
[7]王红治,赵子粼,罗敏,等.超声引导经皮微波消融治疗肝癌的个体化方案及疗效.现代肿瘤医学,2012,20(11):2338-2340.
[8]罗鸿昌,张婷婷,张伟,等.超声引导下经皮微波消融治疗肝细胞性肝癌术后复发灶远期疗效评估.影像诊断与介入放射学,2014,15(5):367-370.
[9]杨晓环,黄十佳,于杰,等.超声引导经皮微波消融治疗邻近血管的原发性肝癌的长期疗效.肿瘤学杂志,2016,22(1):24-28.
[10]高孟,李开艳,罗洪昌,等.原发性小肝癌超声引导下经皮微波消融与手术切除疗效的对比研究.中华超声影像学杂志,2015,24(1):19-21.
[11]He ZX,Xiang P,Gong JP,et al.Radiofrequency ablation versus resection for barcelona clinic liver cancer very early/early stage hepatocellular carcinoma:a systematic review.Therap Clinl Risk Manag,2016,12(1):295-303.
[12]Kim HJ,Lee HK,Cho JH.Comparison between the treatment area of electrode used for radiofrequency ablation of liver cancer focusing on 15G cooled-tip and CWT electrode.Pakist J Med Sci,2016,32(3):555-558.
[13]Yun F,Zhang SJ.Experimental study of radiofrequency catheter ablation with negative pressure automatic biopsy gun in rabbit liver cancer model.J Biomate Tissue Eng,2016,6(4):334-328.
[14]Chen K,Zhu S,Xiang G,et al.Ablation effects of noninvasive radiofrequency field-induced hyperthermia on liver cancer cells.Saudi Pharmaceut J,2016,24(3):329-332.
[15]钱彩艳,俞凯.超声引导下原位经皮微波消融术在转移性肝癌中的应用. 中国乡村医药,2014,7(22):21-22.
[16]张雪花,张潆化,梁萍.超声引导下微波消融治疗肝癌246例并发症分析. 解放军医学院学报,2015,36(9):883-885.
[17]赵莉,侯敬申.原发性肝癌TACE及胸腺素α1治疗对T淋巴细胞亚群的影响. 广州医学院学报,2013,41(2):5-8.
[18]盛竹鸽,李红兵,郭剑.胸腺素α1联合肝动脉导管化疗药物灌注栓塞术治疗原发性肝癌.中国药师,2013,16(9):1383-1384.
[19]姚永华,门琼,施媛,等.高能聚焦超声治疗联合胸腺素α1对原发性肝癌免疫功能的影响.中国医院药学杂志,2009,29(24):2095-2097.
[20]薛红娣,柏斗胜.胸腺素α1联合TACE治疗原发性肝癌的效果分析. 中国现代医学杂志,2010,20(19):3003-3005.
[21]罗羽宏,梁忠平,李接兴,等.肝癌术后早期应用胸腺素α1对T淋巴细胞亚群的影响.中国病理生理杂志,2009,25(6):1117-1121.
[22]李艳丽.胸腺素α1对原发性肝癌TACE术前术后T淋巴细胞亚群的影响. 实用癌症杂志,2009,24(5):512-513.
[23]黄霞.胸腺素α1联合门静脉肝动脉灌注化疗对肝癌术后免疫功能及远期疗效的影响.中国药业,2015,13(3):62-63.
[24]田贵金,刘军红,孙江华,等.肝癌术后早期应用细胞因子白介素2(IL-2)联合胸腺素α1治疗对免疫功能(CD3/CD4/CD8)的影响. 中国煤炭工业医学杂志,2014,24(10):1583-1585.