小檗碱对内毒素刺激致Caco-2细胞间高通透性的保护作用*
2018-03-13李鑫王洪岩迟程徐有青
李鑫,王洪岩,迟程,徐有青
肠源性内毒素血症在酒精性肝病发生和进展中的重要作用已被证实。长期饮酒引起肠道高通透性的主要原因为肠道菌群失调,革兰阴性菌增多,内毒素(endotoxin)入血,造成内毒素血症。目前研究已明确,慢性酒精摄入引起的肠道高通透性的原因并非肠上皮细胞的破坏或脱落,而是细胞间紧密连接(tight junctions,TJs)构型改变,导致其透过率增加,大分子物质,如内毒素经肠腔进入血液,经门静脉到达肝脏进而引起肝损伤。我们既往的研究发现在酒精性肝炎小鼠,小檗碱(berberine,BBR)能减轻肠上皮细胞间紧密连接结构破坏,改善“肠漏”,从而保护酒精性肝损伤。本实验体外培养肠上皮细胞(Caco-2细胞),加入脂多糖(LPS)模拟酒精刺激,检测细胞间通透性、观察紧密连接结构形态和构成蛋白的变化,以探讨BBR对LPS刺激致Caco-2细胞间高通透性的保护作用。
1 材料与方法
1.1 细胞、主要试剂和仪器 Caco-2细胞购自北京协和医学院基础学院细胞库。BBR、LPS、荧光黄购自Sigma公司,DMEM高糖培养基、胎牛血清等细胞培养液购自美国Gibico公司。兔抗occludin、抗Toll样受体-4(TLR4)、抗MyD88单克隆抗体购自英国Abcam公司,BCA检测试剂盒购自上海碧云天生物技术公司,Western blot超敏发光试剂盒购自美国Pierce公司,细胞免疫荧光试剂购自北京中杉金桥生物技术公司,酶标仪购自芬兰Themo公司,DMLI型荧光显微镜(Leica公司),荧光分光光度计购自日本日立公司。
1.2 细胞分组与培养 取20~30代Caco-2细胞,用含有10 g/L非必需氨基酸、10 g/L谷氨酰胺、1 g/L丙酮酸钠的DMEM培养液,加入体积分数10%胎牛血清、青霉素-链霉素常规培养。每7 d按1∶2传代,传代7 d后待细胞达融合状态,分为4组,加入LPS模拟酒精刺激,处理时间为48 h:①对照组(培养基);②LPS组(培养基 +LPS 2 μg/ml);③BBR组(培养基 +BBR 10μM);④BBR/LPS组(培养基 +LPS 2μg/ml+BBR 10μM)。
1.3 荧光黄透过性检测 接种细胞于Transwell小室,实验前测定跨上皮细胞电阻(trans epithelial electrieal resistanee,TEER),以验证细胞融合状态和肠上皮屏障的完整性,TEER不低于l00Ω.cm2提示肠上皮细胞屏障完整,再进行实验。各组处理48 h,吸去Transwell内外的培养液,用HBSS液(pH 7.4)冲洗细胞3次,并在37℃孵育30 min,重新测量TEER值,TEER值降低不超过原测值的10%再继续进行试验。在Transwell顶端腔内加入含有终浓度为 100 μg/ml荧光黄的 HBSS 液 100 μl,37℃孵育4 h,收集腹侧腔液体,在荧光分光光度计下测定吸光度(激发波长427 nm,发射波长536 nm)。根据标准曲线,计算透过到基底侧荧光黄的浓度。
1.4 细胞occludin和TLR4表达检测 采用Western-blot法,收集细胞(约 2×106),PBS洗涤 2 次,加入裂解Buffer 300 μl,置冰上摇晃反应30 min,行蛋白裂解,4℃,12 000 r/m离心,取上清。采用BCA法测蛋白浓度。电泳、转膜、显影。调整不同处理细胞数量,使之蛋白总量一致。取蛋白60 μg,与5×加样缓冲液混匀,100℃变性5 min,冷却后上样。恒压电泳2 h,4℃下将样品转移到PVDF膜上,用TBST洗涤3次,每次5 min。5% 牛奶封闭纤维膜2 h,加入兔抗人 occludin 或抗 TLR4(1:400),4℃过夜,TBST洗涤3次,加入连接有辣根过氧化物酶的羊抗兔IgG(1:4000),室温下振荡孵育2 h,TBST洗涤3次。在ECL试剂盒内曝光、显影。
1.5 细胞MyD88表达检测 采用免疫荧光法,制备Caco-2细胞爬片,模拟肠上皮屏障。将玻片置于24孔细胞培养板孔底,将Caco-2细胞悬液滴加到爬片上,混匀,在37℃、5%CO2培养箱中培养,隔日换液,在倒置显微镜下观察,待细胞连接形成后,用于后续实验。取出处理好的细胞爬片,用PBS缓冲液洗5 min,×3次;加4%多聚甲醛固定30 min,PBS缓冲液洗5 min,×3次;加0.3%Triton×100破膜15 min,PBS缓冲液洗 5 min,×3次;加 3%BSA封闭液封闭;将BSA吸干,将经PBS缓冲液稀释的兔抗 MyD88(1:200)滴加到爬片上,放入湿盒,4℃冰箱过夜;次日,经PBS缓冲液洗5 min,×3次,将FITC荧光标记的羊抗兔IgG用PBS缓冲液稀释后,滴加到爬片上,避光室温孵育1 h,PBS缓冲液洗5 min,×3次;最后,用含有DAPI的封片剂封片,避光4℃保存,在荧光显微镜下观察、照相。
1.6 统计学方法 应用SPSS 17.0软件进行统计学分析,计量资料以(±s)表示,所有数据呈正态分布,采用成组资料的t检验,多组间比较采用LSD法行单因素方差分析,P<0.05被认为差异有统计学意义。
2 结果
2.1 细胞生长形态情况 在倒置显微镜下直接观察,对照组和BBR组细胞连接完整,出现典型的鹅卵石样轮廓;LPS组细胞外周轮廓模糊难辨,出现锯齿样断裂,趋于变细、崩解、消散;BBR/LPS组细胞间紧密连接毛糙、少许点状缺失,但无明显的片状中断(图1)。
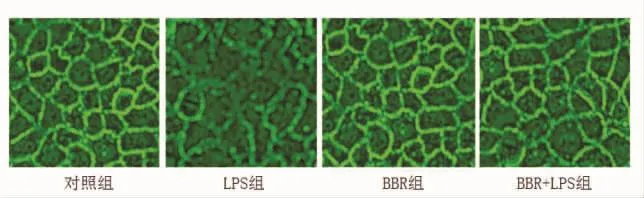
图1 细胞形态表现 (倒置显微镜,200×)
2.2 细胞间透过性变化 通过检测从顶端腔透过至基底侧的荧光黄浓度,评估各组Caco-2细胞间通透性情况,结果BBR组基底侧荧光黄浓度为849.0±89.7 μg/ml,与对照组(683.3±98.9 μg/ml)比,差异无统计学意义(P=0.067);LPS组透过荧光黄浓度为(1886±176.0 μg/ml),较对照组显著升高(P=0.026);在BBR/LPS共培养组,透过荧光黄浓度为(1071.0±65.9 μg/ml),较LPS组显著下降,差异有统计学意义(P=0.043,图2),提示BBR能显著改善细胞间通透性。

图2 各组细胞透过荧光黄浓度比较
2.3 细胞occludin和TLR4蛋白表达情况 对照组和BBR组occludin均呈高表达,LPS组occludin表达减弱,而BBR/LPS组较LPS组表达增强;TLR4与occludin表达情况相反,LPS组TLR4表达最强,对照组和BBR组表达最弱,而BBR/LPS组介于两者之间(图3)。
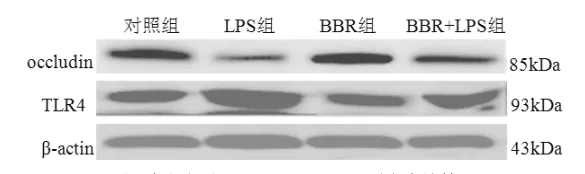
图3 各组细胞occludin和TLR4蛋白表达情况
2.4 Caco-2细胞MyD88表达情况 经荧光检测,发现MyD88在细胞浆表达。对照组、BBR组胞浆MyD88无明显表达,LPS/BBR组绿色荧光在胞浆呈中等度表达,而LPS组则呈高表达。LPS组胞浆MyD88表达显著高于对照组和BBR组。与LPS组比,LPS/BBR组MyD88表达减弱(图4)。
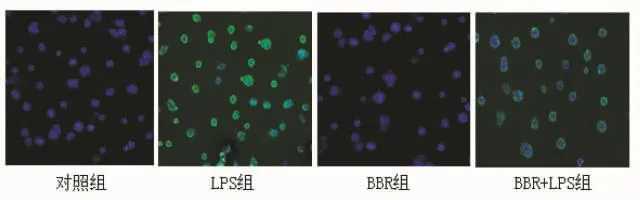
图4 各组细胞MyD88蛋白表达 蛋白呈绿色荧光,细胞核呈蓝色荧光(免疫荧光,100×)
3 讨论
Caco-2来源于人结肠腺癌细胞,可分化成有极性的肠上皮细胞。本研究应用Caco-2细胞株(20~30代)建立肠上皮细胞屏障模型,在研究屏障损伤机制时,有助于排除体液和神经因素的影响[1]。
目前,关于酒精性肝炎发病机制的研究,一般认为有乙醇代谢产物对肝细胞的直接损伤、氧化应激、铁沉积、锌缺乏等因素参与[2,3]。但近年来,随着对肠道菌群、益生菌和益生元等研究的深入,肠源性内毒素血症在酒精性肝炎发生进展中的作用逐渐受到重视[4-6]。在体内试验中发现,慢性饮酒会引起肠道内革兰阴性菌聚集,释放LPS增加,大量LPS经肠道入门静脉到达肝脏,最终导致酒精性肝损伤。所以,在体外实验中,我们用LPS模拟酒精刺激,观察细胞形态及检测细胞间通透性。在倒置显微镜下直接观察细胞生长形态,发现对照组细胞连接完整,出现典型的鹅卵石样轮廓,而LPS组细胞间连接部分模糊难辨,出现锯齿样断裂,趋于变细、崩解、消散,而细胞本身未见坏死、凋亡。荧光黄是大分子物质,不能通过正常细胞间连接。当各种因素引起细胞本身破坏或细胞间结构破坏时,大分子物质,如荧光黄、LPS可以透过。所以,本实验通过检测荧光黄透过性评价细胞间通透性大小,结果发现LPS组透过荧光黄浓度较对照组显著升高,提示LPS组细胞间连接结构被破坏。
肠上皮屏障是由肠上皮细胞和细胞间连接复合体组成,TJs是最重要的连接复合体并负责调整细胞间通透性[7]。Occludin蛋白是TJs的主要结构蛋白。TLR4是内毒素特异性抗体,与内毒素结合后可引起细胞间TJs构型改变,在调节自身免疫应答、维持内环境稳定方面起着重要作用。在通常情况下,肠上皮细胞膜TLR4的微量表达对致病因素有防御作用[8],但是,持续大量的TLR4表达会诱发消化道炎症,进而产生一系列疾病[9,10]。我们既往在小鼠的研究中已发现酒精处理组动物肠上皮细胞较对照组细胞膜TLR4表达显著增加,occludin构型改变,在细胞膜分布减少,细胞间通透性增加[11,12]。本实验亦发现LPS刺激增加了细胞膜TLR4及胞浆中下游分子MyD88的表达,使occludin表达减少。
BBR又名黄连素,是一种异喹啉类生物碱,具有抗炎、抗氧化、抗肿瘤等活性[13,14]。在消化科多用于治疗肠道感染所致的炎性腹泻,具有无细胞毒、无致突变作用、不良反应小、价格低廉等优点。近年来研究发现,小檗碱经口服吸收,能缓解肠粘膜炎性反应[15],减轻内质网应激引起的肠上皮细胞凋亡,从而减轻放疗[16]、酗酒、吲哚美辛[17]引起的肠黏膜损伤。有人[18,19]还发现BBR作为LPS的拮抗剂能阻断LPS/TLR4信号通路。在2型糖尿病大鼠模型中,BBR通过调控TLR4/MyD88/NF-κB信号通路,改善了肠道免疫屏障,减轻了糖尿病大鼠肠道高通透性[20]。
为了研究BBR对LPS刺激致Caco-2细胞间高通透性的保护作用,本实验比较了LPS组和LPS/BBR组细胞间连接形态和细胞间通透功能,发现LPS组细胞连接处出现锯齿样断裂,而BBR/LPS组虽连接毛糙,但无明显中断。LPS/BBR组透过荧光黄浓度较LPS组下降。LPS组与对照组比较,TLR4/MyD88表达增加,occludin表达明显减少,在BBR/LPS共培养的细胞,TLR4和MyD88表达较单纯LPS刺激组减弱,occludin表达增多。以上结果提示BBR可通过减弱TLR4/MyD88活性,增加TJ主要结构蛋白Occludin的表达,从而稳定细胞间紧密连接,进而改善LPS诱导的肠上皮细胞间高通透性。
综上所述,LPS刺激增加了肠上皮细胞TLR4/MyD88活性,减弱了细胞膜occludin蛋白的表达,使细胞间通透性增加。BBR可通过减弱TLR4/MyD88活性,增加occludin表达进而减轻细胞间高通透性。
[1]Keshavarzian A,FarhadiA,Forsyth CB,etal.Evidencethat chronic alcohol exposure promotes intestinal oxidative stress,intestinal hyperpermeability and endotoxemia prior to development of alcoholic steatohepatitisin rats.JHepatol,2009,50(3):538-547.
[2]Abenavoli L,Masarone M,Persico M.et al.Alcoholic hepatitis:Pathogenesis,diagnosis and treatment.Rev Recent Clin Trials,2016,11(3):159-166.
[3]Hayashi N,Saito T,Tsutsumi M,et al.Pathogenesis of alcoholic chronic hepatitis.Nihon Arukoru Yakubutsu Igakkai Zasshi,2014,49(5):219-226.
[4]Han SH,Suk KT,Kim EJ,et al.Effects of probiotics(cultured Lactobacillussubtilis/Streptococcusfaecium)in the treatment ofalcoholic hepatitis:randomized-controlled multicenter study.Eur J Gastroenterol Hepatol,2015,27(11):1300-1306.
[5]Bluemel S,Williams B,Schnabl B,et al.Precision medicine in alcoholic and nonalcoholic fatty liver disease via modulating the gutmicrobiota.Am J PhysiolGastrointestLiver Physiol,2016,311(6):G1018-G1036.
[6]Sung H,Kim SW,Suk KT,et al.Microbiota-based treatments in alcoholic liverdisease.World JGastroenterol,2016,22(29):6673-6682.
[7]Groschwitz KR,Hogan SP.Intestinal barrier function:molecular regulation and disease pathogenesis.J Allergy Clin Immunol,2009,124(1):3-20.
[8]Fukata M,Abreu MT.TLR4 signalling in the intestine in health and disease.Biochem Soc Trans,2007,35(Pt 6):1473-1478.
[9]Neal MD,Sodhi CP,Hackam DJ.A critical role forTLR4 induction of autophagy in the regulation of enterocyte migration and the pathogenesis of necrotizing enterocolitis.J Immunol,2013,190(7):3541-3551.
[10]荆科,孙梅.肠三叶因子对内毒素血症幼鼠肠组织Toll样受体2和4表达的影响.中国当代儿科杂志,2011,13(12):985-988.
[11]Li X,Chen W,Xu YQ,et al.Toll-like receptor 4 increases intestinal permeability through up-regulation of membrane PKC activity in alcoholic steatohepatitis.Alcohol,2013,47(6):459-465.
[12]李鑫,王晨,徐有青,等.Toll样受体4参与了酒精性肝病肠道高通透性.中华肝脏病杂志,2014,22(2):61-64.
[13]Wang K,Feng X,Qiu F,et al.The metabolism of berberine and its contribution to the pharmacological effects.Drug Metab Rev,2017,14:1-54.
[14]Li M,Zhang M,Liao CX,et al.Induction of apoptosis by berber ine in hepatocellular carcinoma HepG2 cells via downregulation of NF-κB.Oncol Res,2017,25(2):233-239.
[15]Yan F,Wang LH,Polk DB,et al.Berberine promotes recovery of colitis and inhibits inflammatory responses in colonic macrophages and epithelial cells in DSS-treated mice.Am J Physiol Gastrointest Liver Physiol,2012,302(5):G504-G514.
[16]Li GH,Zhang YP,Tang JL,et al.Effects of berberine against radiation-induced intestinal injury in mice.Int J Radiat Oncol Biol Phys,2010,77(5):1536-1544.
[17]Watanabe Y,Yamamoto M,Watanabe K,et al.Orengedokuto and berberine improve indomethacin-induced small intestinal injury via adenosine.J Gastroenterol,2009,44(5):380-389.
[18]Chu M,Ding R,Wang YD,et al.Role of berberine in anti-bacterial as a high-affinity LPS antagonist binding to TLR4/MD-2 receptor.BMC Complement Altern Med,2014,14:89.
[19]Li HM,Wang YY,Wang HD,et al.Berberine protects against lipopolysaccharide-induced intestinal injury in mice via alpha 2 adrenoceptor independent mechanisms.Acta Pharmacol Sin,2011,32(11):1364-1372.
[20]Gong J,Hu M,Lu F,et al.Berberine attenuates intestinal mucosalbarrier dysfunction in type 2 diabetic rats.Front Pharmacol,2017,3(8):42.