双黄连对MHV-3诱导的暴发型肝衰竭小鼠的保护作用研究*
2018-03-13黄明邓卫平彭敏吴胜英
黄明,邓卫平,彭敏,吴胜英
急性肝衰竭(ALF)病情危重凶险,病死率高[1,2]。动物实验发现3型鼠肝炎病毒(murine hepatitis virus strain 3,MHV-3)可诱导小鼠暴发型肝炎,其病程和疾病预后与临床急性肝衰竭相似,是研究病毒性肝炎重症化重要的动物模型[3]。MHV-3感染宿主引起免疫反应,产生的炎症介质IL-10可造成肝脏微循环障碍,在肝衰竭患者其水平通常会显著升高,是ALF预后不良的独立危险因素[4,5]。趋化因子IP-10属于CXC类非 ELR亚族的趋化因子,其通过招募淋巴细胞归巢,调控机体的免疫应答反应[6,7]。TGF-βl对肝功能衰竭及肝硬化的形成起到促进作用,TGF-βl水平直接反映肝纤维化程度,高水平的TGF-βl可能抑制肝细胞的再生和分化,而加速肝功能衰竭[8,9]。在ALF病理进程中,IP-10和TGF-βl均出现升高,并提示ALF患者肝细胞有严重的缺血缺氧性损伤,此时肝细胞大量坏死,导致肝功能加速衰竭[10-12]。目前,关于双黄连对MHV-3诱导小鼠暴发性肝衰竭研究还鲜有报导。本实验采用高压水注射法将MHV-3注入BABL/cJ小鼠体内,制备ALF模型,观察了双黄连对小鼠肝组织IP-10 mRNA和血清MHV-3 DNA水平的影响,以探讨抗病毒治疗对ALF发病的阻断作用。
1 材料与方法
1.1 动物、病毒株、药物与试剂 36只6~7周龄雌性BABL/cJ小鼠,体质量14~18 g,由十堰市太和医院肝病研究所提供[SCXK(京)2005-0013]。动物喂养在恒温房(22℃,湿度50%~75%),单笼清洁级饲料喂养,12 h交替光照,自由饮水。实验用MHV-3为Ⅲ型鼠肝炎病毒(十堰市太和医院肝病研究所实验室保存,滴度为1×106PFU/mL)。双黄连(湖南新汇制药股份有限公司,批号:20160226)。TRIZOL试剂(美国Invitrogen公司),PCR分析仪(美国 Roche公司),IP-10逆转录试剂盒和ELISA检测试剂盒(上海麦约尔生物技术有限公司),检测IL-10的ELISA试剂盒(上海美轩生物科技有限公司)。
1.2 ALF小鼠模型制备 将动物编号,采用随机数字表法随机分为对照组、模型组和双黄连组(每组12只)。准确抽取滴度为1×106PFU/ml的MHV-3 200 μL,采用高压水注射法经小鼠尾静脉注入小鼠体内,造成小鼠急性感染,模拟ALF动物模型[13]。成模时间为48 h。ALF成模标准:在注射MHV-3第48 h时,经眶静脉取血50 μL,采用实时定量RT-PCR法检测MHV-3 DNA定量,以小鼠静脉血MHV-3 DNA滴度≥1.3×103copies/ml为阳性标准;对照组经尾静脉注射生理盐水50 μL;根据Meeh-Rubner公式计算,双黄连给药剂量为750 mg·kg-1,先将双黄连配制成10%混悬液备用。在造模后,给予10%双黄连混悬液0.75 ml/10 g灌胃,1次/d,治疗7 d。在对照组和模型组,给予等量的生理盐水灌胃。
1.3 血清检测 采用ELISA法检测MHV-3标志物(上海科华生物技术公司);使用全自动生化分析仪检测血清AST和ALT;采用ELISA法检测血清TGF-βl、IL-10、LN 和 HA 水平[13,14];取静脉血 50 μl,加入 DNase 10 μl混匀,37℃消化 l6 h。然后,采用乙戊醇抽提病毒DNA。上游引物:5'-ATAGGAACCTGTGAATCAG-3',下游引物:5-GCCTTCCAACGACCTGAAAGACG-3',检测 MHV-3DNA。
1.4 肝组织IP-10 mRNA检测 在造模后第48 h和治疗7 d,采用RT-PCR法检测小鼠肝组织IP-10 mRNA。IP-10上游引物:5’-ACGCTGCCCCA AAGCTAACGCTA-3',下游引物:5'-GCCAACTTCG GTCAAGGAGCACT-3',扩增产物长度为312 bp;GAPDH上游引物:5'-CATAACCTCCTCGTCGAG-3',下游引物:5'-CTCGCTCCTGGAAGATGG-3',扩增产物长为 215 bp。反应条件:预变性95℃ 5 s,95℃变性 30 s,56℃退火 30 s,72℃延伸 30 s,36 个循环;72℃终止延伸10 min[15]。
1.5 统计学方法 应用SPSS 17.0统计软件进行数据分析,计量资料以±s表示,先行方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 造模情况 在第48 h时,模型组动物存活9只(75%),双黄连组存活10只(83%);对照组存活12只;模型组和双黄连组存活小鼠血清MHV-3 DNA均为阳性,对照组均为阴性,说明造模成功。在7 d时,模型组动物存活4只,双黄连组存活7只,对照组存活12只。
2.2 三组血清ALT和AST水平比较 在48 h和7 d时,模型组ALT和AST水平显著升高,与对照组比,差异显著(P<0.05);在 7 d时,双黄连组 ALT和AST水平显著降低,与模型组比,差异显著(P<0.05,表1)。
表1 三组肝功能指标(±s)比较
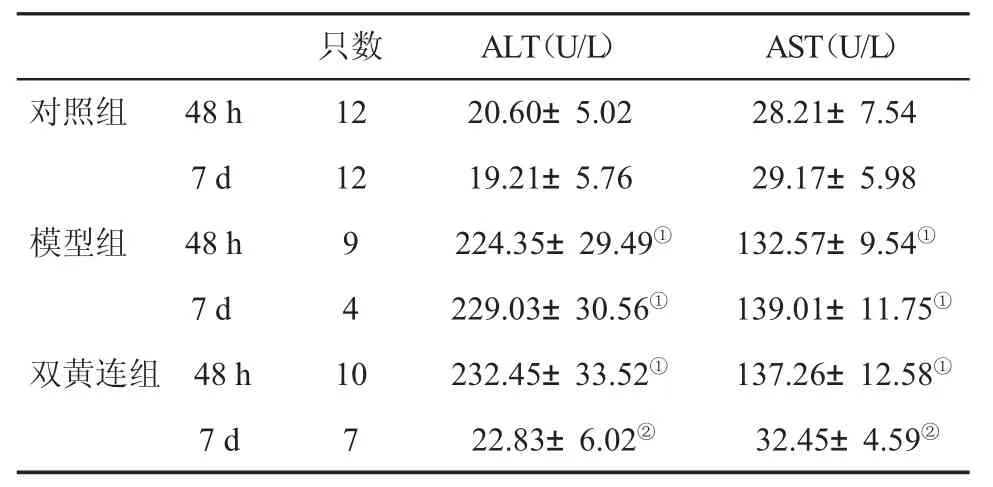
表1 三组肝功能指标(±s)比较
与对照组比,①P<0.05;与模型组比,②P<0.05
?
2.3 三组血清LN和HA含量比较 在48 h和7 d时,模型组血清LN和HA含量显著升高,与对照组比,差异显著(P<0.05);在7 d时,双黄连组LN和HA含量显著降低,与模型组比,差异显著(P<0.05,表2)。
表2 三组血清LN和HA水平(±s)比较

表2 三组血清LN和HA水平(±s)比较
与对照组比,①P<0.05;与模型组比,②P<0.05
?
2.4 三组血清TGF-βl和IL-10水平比较 在48 h和7 d时,模型组TGF-βl和IL-10显著升高,与对照组比,差异显著(P<0.05);在7 d时,双黄连组TGF-βl和IL-10显著降低,与模型组比,差异显著(P<0.05,表3)。
表3 三组小鼠血清TGF-βl和IL-10水平(±s)比较

表3 三组小鼠血清TGF-βl和IL-10水平(±s)比较
与对照组比,①P<0.05;与模型组比,②P<0.05
只数IL-10(pg/ml)TGF-βl(pg/ml)对照组 48 h 12 0.98±0.07 87.54±9.20 7 d 12 1.01±0.05 83.73±10.34模型组 48 h 9 23.34±1.65① 312.09±33.26①7 d 4 25.70±3.87① 319.46±39.12①双黄连组 48 h 10 24.39±2.04① 315.65±31.45①7 d 7 1.07±0.09② 93.87±11.20②
2.5 三组肝组织IP-10 mRNA和血清MHV-3 DNA滴度比较 在48 h和7 d时,模型组肝组织IP-10 mRNA和血清MHV-3 DNA滴度均显著升高,与对照组比,差异显著(P<0.05);在7 d时,双黄连组IP-10 mRNA和MHV-3-DNA滴度均显著降低,与模型组比,差异显著(P<0.05,表4)。
表4 三组肝组织IP-10 mRNA和血清MHV-3 DNA滴度(±s)比较

表4 三组肝组织IP-10 mRNA和血清MHV-3 DNA滴度(±s)比较
与对照组比,①P<0.05;与模型组比,②P<0.05
?
3 讨论
MHV-3属冠状病毒科,据其嗜组织特性的不同可分为呼吸株和嗜肠株,目前关于MHV-3感染后药物干预的研究,特别是体内实验未见报道。双黄连具有明显抗腺病毒、单纯疱疹病毒、流感病毒、呼吸道合胞病毒、轮状病毒、柯萨奇病毒等的作用[16,19]。
本实验中,模型组动物在造模后与治疗7 d后,MHV-3-DNA在肝细胞大量复制增殖,肝细胞严重破坏,特别是IL-10大量分泌造成的肝细胞炎症反应会进一步加重肝细胞变性、坏死。同时,由于IL-10诱导T细胞集聚,细胞免疫应答也加重炎症反应,此时血清纤维化指标LN和HA均显著升高、TGF-βl和IP-10 mRNA高表达。随着病程进展,MHV-3-DNA大量增殖,肝脏组织最终发生纤维化,肝脏彻底丧失解毒功能而导致大量动物死亡。而双黄连组在干预性治疗7 d后,小鼠肝脏IP-10 mRNA低表达,血清MHV-3-DNA滴度显著降低,血清纤维化指标中TGF-βl、LN和HA明显降低,肝功中AST和ALT均明显降低。在造模中所用的MHV-3具有诱导mfgl2凝血酶原酶基因转录活性作用[20]。双黄连是否具有影响mfgl2凝血酶原酶基因转录还有待研究,但双黄连组治疗后血清IL-10降低、肝组织中IP-l0 mRNA低表达,肝功能中AST和ALT等酶都基本恢复正常,这一结果提示双黄连抑制或者阻碍病毒激发相关的免疫损害而保护肝细胞。另有研究表明,抑制TGF-βl高表达可减轻肝纤维化,这也是治疗ALF的关键[21]。双黄连组血清LN、HA及TGF-βl较模型组明显降低,提示双黄连可能具有抑制肝胶原合成、降解肝星状细胞、促进肝细胞再生、从而抑制纤维化进展、改善肝脏组织能量代谢而起促进肝功能恢复的作用。Kpolat等[22]研究表明,ALF患者IL-10分泌明显增多,IL-10作为抗炎细胞因子,在ALF的免疫应答中能迅速控制病毒复制,抑制肝细胞急性损害,但IL-10过多分泌会拮抗T淋巴细胞中Thl型细胞因子分泌,这不利于病毒清除,还会造成机体对MHV-3细胞免疫减弱而导致MHV-3持续复制。而IP-l0在ALF的发生发展及肝脏的免疫损伤中也扮演着十分重要的角色,高表达的IP-l0可诱导大量效应性T淋巴细胞集聚至受MHV-3感染的肝细胞并清除之,但过度释放的IP-l0会致炎症反应扩大而加剧肝细胞损伤[23]。双黄连组血清IL-10降低、肝组织中IP-l0 mRNA低表达,提示双黄连可能通过直接抑制MHV-3在肝脏复制而减轻其对肝脏细胞的破坏。
综上所述,双黄连可在一定程度上抑制MHV-3病毒复制,降低IP-10 mRNA的表达、减轻IL-10对肝细胞的炎性损伤,阻止肝组织纤维化病变而发挥整体保护性效应,但其机制还有待进一步深入研究。
[1]李爽,陈煜.急性肝衰竭病情严重程度评估.实用肝脏病杂志,2017,20(1):17-20.
[2]中华医学会感染病学分会肝衰竭与人工肝学组.肝衰竭诊治指南(2012 年版),实用肝脏病杂志,2013,7(3):210-216.
[3]丁琳,陈韬,师爱超.CXCR3阳性自然杀伤细胞在MHV-3诱导暴发型肝炎小鼠组织分布动态变化.实用肝脏病杂志,2013,l6(3):248-250.
[4]赵攀,毕振华,王春亚,等.急性肝衰竭患者血清炎性细胞因子水平分析. 实用肝脏病杂志,2014,17(1):63-64.
[5]于晓辉,李晓云,段惠春,等.恩替卡韦治疗慢性乙型肝炎患者血清MIF、IL-17和IL-10的变化及临床意义.肝脏,2014,19(3):167-169.
[6]Liu M,Gun S,Hibbert JM,et a1.CXCLI0/IP-10 in infectious diseases pathogenesis and potential therapeutic implications.Cytokine Growth Factor Rev,2011,22(3):121-130.
[7]吴志兰,姚登福,董志珍,等.转化生长因子-βl对原发性肝癌诊断与鉴别的临床价值.胃肠病学和肝病学杂志,2004,13(5):502-504.
[8]孟杰,程书权.恩替卡韦对慢性乙型肝炎和转化生长因子-βl.中国医药导报,2013,l0(20):74-75.
[9]李兵顺,阎文昭,刘金星,等.肝组织与血清转化生长因子βl表达水平与病毒性肝炎患者肝纤维化的关系.中华肝脏病杂志,2004,l2(5):271-273.
[10]赵凯,商庆华.γ-干扰素诱生蛋白10与肝病关系研究进展.实用肝脏病杂志,2017,20(1):120-123.
[11]李晓东,徐东平.MHV-3相关慢加急性肝衰竭免疫病理发病机制研究进展.实用肝脏病杂志,2015,(3):317-320.
[12]丁红晖,郝友华,杨新星,等.MHV-3感染者血清趋化因子 IP-10和RANTES的表达及其临床意义探讨.实用肝脏病杂志,2009,12(3):176-178.
[13]陈韬,朱琳,邹勇.MHV-3诱导暴发型肝衰竭小鼠肝组织细胞因子表达的变化.实用肝脏病杂志,2010,13(5):323-324.
[14]李晓虹,杨蒲芳,戚红霞,等.血清TGF-βl及VEGF在慢性乙型肝炎、肝纤维化、肝硬化患者的临床变化及其意义.临床消化病杂志,2011,2(3):144-145.
[15]邹勇,鲍俊杰,周耀勇,等.急性重症肝炎小鼠肝脏趋化因子IP-10 mRNA 的表达及意义. 广东医学,2011,32(2):141-143.
[16]易文龙,方峰,宁琴,严伟明.双黄连、鱼腥草注射液抗鼠肝炎病毒3型的体外实验研究.东南大学(医学版),2006,25(4):228-231.
[17]贺一新,樊静恒,董金鹏.双黄连口服液(仅适用于儿童)的大鼠毒理学研究. 中国中医药信息杂志,2017,24(4):61-66.
[18]田丽珠.清开灵与双黄连治疗病毒性感冒的EA分析.光明中医,2016,31(16):2356-2357.
[19]董枭,柳阳,马艳.双黄连和利巴韦林联合治疗轮状病毒肠炎的疗效观察. 中国现代医生,2012,50(29):135-136.
[20]宁琴,严伟明,汪之沫.鼠肝炎病毒3型N蛋白I区激活mfg12凝血酶原酶基因.世界华人消化杂志,2004;12:594-599.
[21]李晓虹,杨蒲芳,戚红霞,等.血清TGF-βl及VEGF在慢性乙型肝炎、肝纤维化、肝硬化患者的临床变化及其意义.临床消化病杂志,2011,2(3):144-145.
[22]Kpolat N,Yahsis S,Godekmerdan A,et a1.Relationship between serum eytokine level s and histopathological changes of liverin patientswith hepatitisB.World J Gastmenterol,2005,21(11):3260-3263.
[23]Brownell J,Polyak SJ.Molecular pathways:hepatitis C virus,CX-CL 10,and the inf lamm atory road to liver cancer.Clin Cancer Res,2013,19(6):1347-1352.