电针对APP/PS1转基因小鼠海马及血脑屏障Aβ水平的影响*
2018-03-13张学婷周英奕裴亚妮高堂珂薛卫国
张 磊,张学婷,周英奕,裴亚妮,高堂珂,王 鑫,薛卫国
(北京中医药大学,北京 100029)
阿尔茨海默病(Alzheimer’s disease,AD)是一种发生于中枢神经系统的退行性疾病,病因至今不明,患者主要表现为获得性的认知功能损害,记忆及工作生活能力明显减退[1]。
β-淀粉样蛋白(Amyloid beta,Aβ)是AD的重要致病物质,1992年Hardy和Higgins提出的Aβ级联假说(Amyloid cascade hypothesis)[2]是目前较为公认的AD发病机制假说。脑内Aβ存在主要有两种形式Aβ1-40和Aβ1-42,Aβ1-42比Aβ1-40多两个疏水性氨基酸,具有更强的疏水性而容易聚集,因此认为Aβ1-42更具有致病性并可能对AD的发病更为关键。
近年研究表明,血—脑屏障清除是脑内Aβ清除的重要途径,Aβ可通过脑微血管进行跨血—脑屏障转运[3]。健康状态下,Aβ在脑内产生和清除的动态平衡能够保持正常水平而不出现神经毒性。如果血脑屏障清除Aβ出现障碍,Aβ则沉积于脑微血管壁,引起脑内Aβ水平升高,产生的神经毒性将导致患者认知功能障碍等病理表现[4],所以脑微血管壁的Aβ沉积是血脑屏障清除能力下降的关键指标,免疫电镜胶体金颗粒可反映Aβ的表达部位与强度,其在微血管壁不同层次的表达情况可反映血脑屏障Aβ清除的状况。
本实验将采用Morris水迷宫进行行为学测试,用ELISA检测Aβ1-42在海马的表达水平,以免疫电镜观察海马脑微血管壁Aβ表达情况及电针对其影响,探讨电针改善APP/PS1小鼠空间学习记忆能力是否可能与促进血脑屏障Aβ清除能力有关。
1 材料与方法
1.1 实验动物
本实验选取6月龄大小的APPswe/PS1dE9转基因雄性小鼠[以C57BL/6野生小鼠作为背景鼠,APPswe是指将APP序列595、596位点的Lys和Met分别被Asn和Leu取代,PS1dE9是家族性AD中发现的早老素(presenilin,PS)基因的第9个外显子(dE9)缺失突变[5]]为动物模型,以其背景鼠作为正常对照组。所有动物从南京大学模式动物研究所购入,于北京中医药大学动物中心屏障系统单笼饲养。本实验已经过北京中医药大学实验动物伦理委员会批准。
1.2 动物分组及干预方法
将24只6月龄APP/PS1转基因小鼠随机平均分为模型组和电针治疗组,12只同性别C57BL/6野生小鼠作为正常对照组。因在饲养和干预治疗过程中,各组小鼠均出现死亡现象,最后纳入统计正常对照组和模型组各11只、电针治疗组7只。电针治疗组针刺百会及双侧涌泉穴,平刺2~3 mm,双侧涌泉穴以疏密波接入电针仪,频率1/50 Hz,强度0.1 mA,针柄微颤,每次15 min,隔日治疗1次,持续6周。针刺同时模型组与正常对照组以相同方法用鼠袋束缚15 min。
1.3 主要试剂和仪器
Aβ1-42 ELISA超敏试剂盒(Invitrogen,货号:KHB3544);Aβ1-42兔多克隆抗体(Abcam,货号:ab10148);抗兔二抗(AuroProbeTMEM,GARG10);针灸针(规格0.25 mm×13 mm,北京中研太和医药有限公司);电针仪(北京华卫有限公司,HANs LH202H型);电镜(型号HITACHI H-750);Morris水迷宫(型号BS-124S,东直门中医院实验室,其中上海移动信息技术有限公司提供水迷宫视频分析系统)等。
1.4 学习记忆行为学检测
使用Morris水迷宫对小鼠进行行为学实验。将水池平均分为一、二、三、四象限,三象限内放置平台。实验前加水至高出平台1 cm,溶入奶粉使水面变白,这样视频分析系统可记录小鼠的游泳路线。各组小鼠在前4天进行定位航行实验,开始置小鼠于平台上10 s,对水池环境及平台初步认知,随后依次从一、二、四象限将小鼠面壁放入水中。小鼠在平台停留5 s即可停止记录,而到1 min时也停止记录,这样分别记录小鼠在水中的逃避潜伏时间。第5天进行空间探索实验,将平台撤出,将小鼠按定位航行实验象限顺序放入。检测结果以定位航行实验第四象限为入水点的逃避潜伏时间、空间探索实验穿越平台位置次数及平台所在象限游泳时间、路程占总时间和总路程的百分比作为指标,来评价小鼠的学习记忆能力。
1.5 ELISA检测海马Aβ1-42
取每组小鼠海马,称重后以8倍体积的5 mol/L盐酸胍、50 mmol/L Tris盐酸(调PH至8.0)、1 mmol/L PMSF蛋白酶抑制剂混合溶液匀浆,16 000转/min转速下4℃离心15 min,取上清液。电针治疗组、模型组加入上清液3 200倍体积的样品稀释液进行稀释;正常对照组样品直接取上清作为待测样品。使用ELISA试剂盒分别对待测样品进行检测。首先加入50 μL一抗,室温3 h后洗板4次,加100 μL辣根过氧化酶标记二抗,室温下避光孵育30 min;洗板4次后加入100 μL显色液,依前室温避光30 min;最后加入100 μL终止液,使用用酶标仪于450 nm波长处检测吸光度。用Excel绘制标准曲线,按样品读数及样品稀释浓度计算出海马Aβ1-42浓度。
1.6 胶体金免疫电镜
在显微镜下取海马CA1区(体积约1 cm×1.5 cm×1.5 cm)的组织块,放入配置好的免疫电镜组织固定液中,固定72 h。用100%乙醇洗脱3次,每次5 min。然后用100% LR白树脂渗透1周,逐步将乙醇置换出来。将组织块加入注入包埋液的胶囊中,室温避光1天,放入培养箱中,从30℃调至56℃,约每12 h升高2℃~3℃,56℃培养24 h之后室温保存,用超薄切片机切片,置于镍网上进行免疫化学定位。
将含有组织切块的镍网用PBS-Glycine清洗2次,每次5 min;再用PBGT清洗2次,每次5 min;加入一抗,4℃过夜;再放到室温60 min,PBGT清洗6次,每次5 min;加入二抗,室温90 min;依次用PBGT、PBS-Glycine、双蒸水清洗2次,每次5 min;后加入增感液,避光30 min;双蒸水清洗6次,每次5 min;加入醋酸氧铀15 min,最后用双蒸水清洗6次,每次5 min。滤干镍网,放入无菌培养皿中保存,电镜观察。胶体金是表面带负电荷的疏水性颗粒,与Aβ蛋白的正电荷基团因静电吸附而牢固结合又不影响蛋白生物特性,所以电镜下胶体金颗粒分布可反映Aβ的表达部位与强度。
1.7 数据统计处理
2 结果
2.1 Morris水迷宫行为学检测结果
2.1.1 定位航行试验 重复测量的方差分析显示逃避潜伏时间随时间推移而变化(P<0.01),除模型组外,随着实验天数的增加,各组小鼠逃避潜伏时间均有缩短。组间比较结果:模型组逃避潜伏时间较正常对照组显著增加,差异具有统计学意义(P<0.01);电针治疗组逃避潜伏时间较模型组缩短,差异具有统计学意义(P<0.01);时间因素和分组因素间具有交互作用(P<0.01),说明逃避潜伏时间随时间变化的趋势在各组间也有所不同。见表1、图1。
2.1.2 空间探索试验 模型组小鼠实验中穿越平台次数以及平台所在象限游泳时间和路程所占总时间和总路程百分比较正常对照组降低,差异有统计学意义(P<0.05)。详见表2。

表1 各组小鼠定位航行试验逃避潜伏时间比较
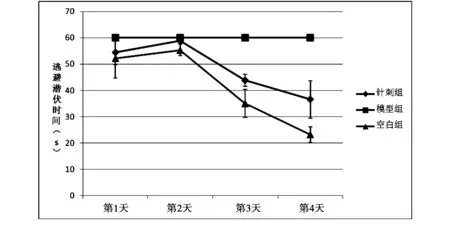
图1 各组小鼠Morris水迷宫逃避潜伏时间比较

组别n平台穿越次数平台象限时间百分比(%)平台象限路程百分比(%)正常对照组111.91±1.64020.89±9.9320.18±8.93模型组110.73±0.786△18.06±8.33△18.11±8.15△电针治疗组70.57±1.13413.59±11.0514.48±11.03
注:与正常对照组比较,△P<0.05
2.2 Aβ1-42 ELISA结果
各组海马Aβ1-42 ELISA检测结果见表3。正常对照组小鼠Aβ1-42浓度较低,模型组与正常对照组比较显著升高(P<0.01);而电针治疗组与模型组相比较,Aβ1-42水平有所降低且差异有统计学意义(P<0.01)。
表3 电针对APP/PS1小鼠Aβ1-42水平的影响
注:与正常对照组比较,**P<0.01;与模型组比较,△△P<0.01
2.3 胶体金免疫电镜结果
从免疫电镜结果来看,胶体金颗粒主要表达于具有类似纤维状结构的老年斑内,周围组织未出现胶体金颗粒,见封三彩图2,提示Aβ免疫电镜定位及表达强度具有特异性。正常对照组脑微血管壁基膜显示完整,管壁细胞内没有或仅有较少的胶体金颗粒,见封三彩图3;模型组脑微血管壁内皮细胞及周细胞结构模糊,基膜增厚,胶体金颗粒出现在细胞胞质以及增厚的基膜上,见封三彩图4;电针治疗组脑微血管壁组织结构较模型组清晰,胶体金颗粒较模型组减少,见封三彩图5。
3 讨论
近年来,Aβ的脑微血管清除途径成为研究热点,主要包括两个途径,一是血—脑屏障的清除途径[6],Aβ在LRP1等受体帮助下通过血—脑屏障清除,脑内大部分的Aβ通过该途径被清除;二是脑血管周隙—淋巴清除途径。当这两条清除途径尤其是血—脑屏障清除出现问题,会致使微血管壁Aβ过量表达,进而在脑实质内出现并引发一系列神经症状[7-8]。有临床报导显示,针刺或针药结合治疗AD临床疗效显著,AD患者的认知功能以及生活能力均得到改善[9-11]。故本次实验基于针刺对脑病的良好疗效,针对Aβ的脑微血管清除途径,结合中医对AD的认识,探讨电针是否可能通过改善脑微血管Aβ清除能力来治疗阿尔茨海默病。
APPswe/PS1dE9双转基因小鼠是由Jankowsky实验室培育出的表达人类APP和PS1突变基因的动物模型,出现Aβ沉积月龄较早,并伴随认知功能障碍等行为学改变,可模拟AD的病理特征和病程。该动物模型在AD的治疗药物、治疗方式等科研中较常用[12],是国际公认的Aβ水平的有效评价模型[13]。本实验行为学结果显示,模型组逃避潜伏时间较正常对照组增加,空间探索试验中穿越平台位置次数及平台象限游泳时间、路程所占总时间和总路程百分比减少(P<0.05),ELISA结果显示模型组Aβ1-42水平明显高于正常照组组,说明此模型适用于本实验研究。
督脉百会穴是治疗头部疾病的重要穴位,脏腑精微要维持脑部机能就要依赖督脉这条重要通路,若督脉瘀阻,脏腑精微不能上输于脑,气血运行不畅则导致痰瘀阻络,进而使脑部机能失用。中医学认为脑为髓海,肾主精生髓,肾精积蓄满盈则髓海充实,而涌泉穴为足少阴肾经“井穴”,经气涌出之处。所以针刺百会穴,能够激发督脉阳气,行气祛瘀,再配合电针双侧涌泉穴,补肾益精填髓,二者相辅相成,共同起到醒脑开窍益智的作用。许安萍等[14]就曾应用电针百会穴来治疗AD,得出电针可改善小鼠的行为学表现并且影响大脑皮层Aβ前体蛋白mRNA表达的结果。
脑微血管是血—脑屏障的重要结构,神经血管的功能稳定要依赖微血管壁细胞的正常工作。脑微血管壁主要由基膜、周细胞、内皮细胞等构成[15],这些结构均与Aβ的转运密切相关,如Aβ可在内皮细胞转运受体LRP1帮助下被转运出脑[16];基膜的硫酸类肝素蛋白多糖是重要的神经突触促进因子[17];而周细胞对于血—脑屏障功能的稳定及血管生成过程也有重要作用[18],其可通过表达LRP1抗体将Aβ内吞清除。根据本实验免疫电镜结果,正常对照组清除能力正常,脑微血管壁Aβ表达弱,而模型组清除能力减弱,不能被内皮细胞向外周血转移或被周细胞吞噬,故见基膜部位表达明显;电针治疗组脑微血管壁Aβ免疫胶体金表达较模型组减弱,提示针刺可能促进了血脑屏障Aβ清除能力,加之在Morris水迷宫定位航行试验中,电针治疗组逃避潜伏时间短于模型组(P<0.01);ELISA结果也显示电针治疗组海马Aβ1-42水平较模型组有所降低(P<0.01),说明电针百会、涌泉穴可能通过改善血脑屏障的Aβ清除能力而减少脑微血管壁Aβ沉积并且降低脑实质内Aβ水平。
综上,本研究结果表明,电针百会、涌泉穴可以改善小鼠行为学认知能力,而其机制可能是通过改善血脑屏障Aβ清除能力来降低脑内Aβ水平,这可能是电针治疗AD的作用靶点之一。
最后,在Morris水迷宫空间探索试验中,电针治疗组小鼠平台位置穿越次数以及平台所在象限游泳时间、路程所占总时间和总路程百分比较模型组略低,但是根据定位航行试验及ELISA检测结果,电针治疗组应该高于模型组,这可能是由于针刺的应激效应使小鼠在进行空间探索试验时体力下降,导致此部分行为学结果偏差,具体原因尚需进一步研究。
[1] Goedert M,Spillantini MG.A century of Alzheimer’s disease[J].Science,2006,314(5800):777-781.
[2] Hardy J,Selkoe DJ.The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics[J].Science,2002,297(5580):353-356.
[3] Monro OR,Mackic JB,Yamada S,et al.Substitution at codon 22 reduces clearance of Alzheimer’s amyloid-beta peptide from the cerebrospinal fluid and prevents its transport from the central nervous system into blood[J].Neurobiol Aging,2002,23(3):405-412.
[4] Xu W,Xu F,Anderson ME,et al.Cerebral microvascular rather than parenchymal amyloid- protein pathology promotes early cognitive impairment in transgenic mice[J].J Alzheimers Dis,2014,38(3):621-632.
[5] Minkeviciene R,heims S,Dobszay MB,et al.Amyloid beta-induced neuronal hyperexcitability triggers progressive epilepsy[J].JNeurosci,2009,29:3453-3462.
[6] Kanekiyo T,Bu G.The low-density lipoprotrin receptor-related Protein 1 and amyloid-β clearance in Alzheimer’s disease[J].Front Aging Neurosci,2014,6(93):1-12.
[7] Brian Jeynes,John Provias.The Case for Blood Brain Barrier Dysfunction in the Oathogenesis of Alzheimer’s Disease[J].Neuroscience Research,2011.89(1):22-28.
[8] Gosselet F,Candela P,Cecchelli R,et al.Role of the blood-brain barrier in Alzheimer’s disease[J].Med Sci(Paris),2011,27(11):987-992.
[9] 姜国华,徐强,张洋,等.针刺对老年性痴呆神经行为学影响的临床研究[J].针灸临床杂志,2004,20(4):1-3.
[10] 董洪涛,白英.针刺疗法对老年性痴呆患者MMSE量表得分的影响[J].中医外治杂志,2002,11(3):6.
[11] 彭贤文,董克礼.针刺结合益智健脑颗粒治疗阿尔茨海默病疗效观察[J].中国针灸,2009,29(4):269-271.
[12] Malm T,Koistinaho J,Kanninen K.Utilization of APPswe/PS1dE9 Transgenic Mice in Research of Alzheimer’s Disease:Focus on Gene Therapy and Cell-Based Therapy Applications[J].Int J Alzheimers Dis,2011,2011(2011):517160.
[13] Yao ZG,Zhang L,Liang L,et al.The effect of PN-1,a Traditional Chinese Prescription,on the Learning and Memory in a Transgenic Mouse Model of Alzheimer's Disease[J].Evid Based Complement Alternat Med,2013,2013(2):518421.
[14] 许安萍,唐银杉,陈万顺,等.不同电针刺激对SAMP8小鼠学习记忆能力及大脑皮层APP、ApoE mRNA表达的影响[J].针灸临床杂志,2014,30(2):62-65.
[15] 步青云,高堂珂,李芙,等.阿尔茨海默病脑内β-淀粉样蛋白经血-脑屏障清除相关研究概况[J].中国脑血管病杂志,2014,11(12):663-668.
[16] Zlokovic BV,Deane R,Sagare AP,et al.Low-density lipoprotein receptor-related protein-1:a serial clearance homeostatic mechanism controlling Alzheimer’s amyloid β-peptide elimination from the brain[J].J Neurochem,2010,115(5):1077-1089.
[17] Dow KE,Mirski SE,Roder JC,et al.Neuronal proteoglycans:biosynthesis and functional interaction with neurons in vitro[J].J Neurosci,1998,8(9):3278-3289.
[18] 赵晨阳,王岚,李砚超,等.周细胞的标记分子、生理功能和相关疾病[J].生理科学进展,2012,43(3):207-210.
