针刺治疗肥胖模型大鼠机制研究进展*
2018-03-13王丽华周仲瑜
王丽华,黄 伟,李 佳,周仲瑜△
(1.湖北中医药大学,湖北 武汉 430061;2.湖北省中医院,湖北 武汉 430061)
单纯性肥胖是由于机体热量摄入大于消耗而造成体内脂肪积聚过多,实测体重远超过标准体重的慢性代谢性疾病[1]。随着现代社会的经济发展和生活方式的改变,肥胖的发病率呈逐年递增趋势,最新流行病学研究发现世界卫生组织预计到2020年,我国肥胖人数可能超过美国,而到2030年全球超重人口将突破21.6亿[2]。伴随肥胖症出现的多种并发性疾病如2型糖尿病、高血压、动脉粥样硬化、高脂血症等也影响和困扰着人们的健康和生活。相关研究证明,肥胖症患者患动脉粥样硬化、高血压、2型糖尿病和乳腺癌等代谢疾病的几率大大增加。针灸作为一种绿色减肥方法,可以通过多条途径来改善肥胖的一系列症状,目前研究报道已证实针灸能够有效调节下丘脑的摄食中枢[3-4]、促进胃肠的消化功能[5]、改善神经内分泌状态[6-7],影响能量的消耗。
近10年来,有关针刺治疗单纯性肥胖相关实验类的机制研究逐渐涌现,本研究对针刺治疗单纯性肥胖模型大鼠的相关文献进行归纳、总结与分析,对筛选出来的文献从肥胖大鼠模型、针刺方法和穴位的选择以及针刺改善肥胖病的相关生物因子这3个角度进行分析,并对涉及到的主要相关生物因子展开综述。
1 方法
1.1 资料来源
选用收录于中国期刊全文数据库(CNKI)以及PubMed英文数据库中近10年的针刺治疗肥胖模型大鼠的相关文献。
1.2 检索策略
检索词“(针or针灸or针刺or电针or温针)And(肥胖or单纯性肥胖or减肥)And“实验”用于中文数据库的检索;“obesity、acupuncture、acupuncture and moxibustion、electroacupuncture”等用于PubMed英文数据库的检索。检索时限:从2007年至今,采用主题词与自由词结合的方式进行检索针刺治疗肥胖模型大鼠的相关文献。
1.3 文献筛选
通过在CNKI中文数据库中按照中文检索词进行检索获得相关文献213篇(包括期刊、学位论文),仔细阅读文献后筛选针刺治疗肥胖模型大鼠的相关文献45篇。通过在Pubmed英文数据库中按照检索词进行检索获得相关文献42篇,仔细阅读文献后筛选获得相关文献6篇,共计51篇。
2 结果分析
纳入的51篇相关文献中,从肥胖大鼠模型的选择、针刺方法及穴位的选择和针刺减肥的机制3个方面进行总结、分析,具体结果如下。
2.1 肥胖大鼠模型的选择
纳入的51篇文献中,单纯性肥胖动物模型的建立可以获得以下一些数据:高脂饮食诱导型肥胖动物模型47篇,谷氨酸钠注射法肥胖动物模型2篇,高脂高糖饮食诱导型肥胖动物模型1篇,高脂饮食+谷氨酸钠注射法肥胖动物模型1篇。综上所述,目前科研人员在研究单纯性肥胖病的过程中,以高脂饮食诱导型肥胖动物模型为主。
糖、脂、蛋白质作为人体三大营养物质,通过相互转换为正常的生命活动提供能量。根据机体的需要在摄入糖、脂、蛋白质的时候应按照一定比例合理摄入,高糖、高脂、高蛋白的食物往往不利于健康。食物是诱导肥胖的主要环境因素之一,长期摄入高糖高脂、油炸食物和高能量饮料是当前大多数肥胖症流行的根源。因此,建立这种肥胖动物模型的必备条件就是饲料所提供的能量大大超过正常生命活动所需的能量[8]。
2.2 针刺方法及穴位的选择
对针刺治疗肥胖模型大鼠的针刺方法统计发现,电针45篇,手针6篇。所取腧穴经统计可以发现,“足三里”45次,“天枢”和“三阴交”各19次,“中脘”18次,“内庭”16次,“关元”14次,“丰隆”8次,“曲池”“大横”4次,“合谷”“内关”“梁门”“脾俞”各2次,“带脉”“阴陵泉”“肝俞”“建里”各1次。综上所述,目前科研人员主要选择足阳明胃经之“足三里”,配合脾经之“三阴交”和任脉之“中脘”“关元”。
足三里为胃经下合穴,“四总穴歌”指出“肚腹三里留”,根据现代文献报道,针刺“足三里”能调节胃肠动力,胃以肠神经系统为转换神经元,并由自主神经系统所支配,其副交感神经系统以促进胃肠运动的功能为主,针刺有可能是通过影响胃投射神经元中的相关神经递质和受体分子的传递来实现对胃肠功能的改善,目前潜在的机制可能是这些神经递质和受体分子参与了副交感神经系统调控胃生理功能的不同神经化学机制[9]。“三阴交”为肝、脾、肾三阴经的交会穴,脾主升清、肝主疏泄、肾主封藏司二便,与人体的新陈代谢密切相关。“中脘”临近脾部,正当胃部,且为胃之募穴,可健脾利水、调理肠胃。“关元”为小肠募穴,“小肠者,受盛之官,化物出焉”。食物的正常代谢与小肠关系密切;小肠主精微吸收功能,是脾主运化和升清功能实现的重要体现。“足三里”与这三穴配伍可增强能量的消耗,与单纯性肥胖病的发病机制相吻合。
2.3 针刺改善肥胖病的相关生物因子
对纳入的51篇文献中所涉及到的出现频次较高的单纯性肥胖病相关生物学指标按频次从高到低进行排序,并对其类别、在肥胖病中的作用以及文献中出现的频次进行详细说明,详见表1。
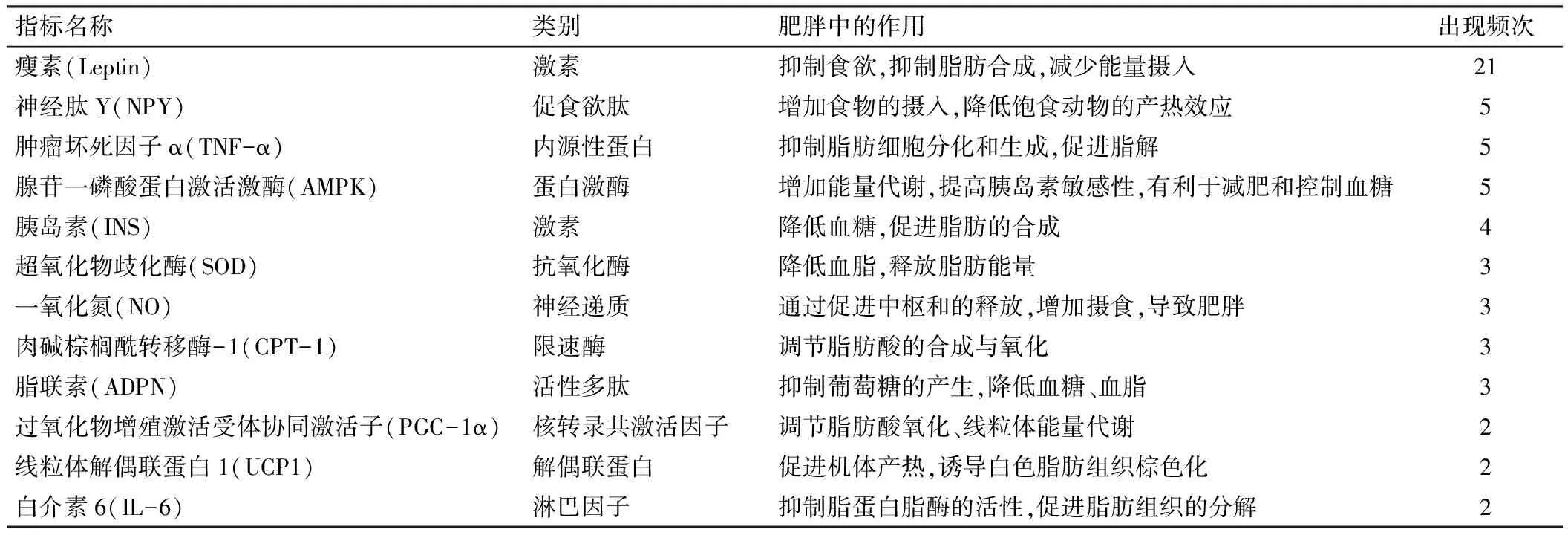
表1 针刺治疗肥胖大鼠模型相关生物因子作用
从表1中发现,现阶段针刺调控肥胖发病机制主要集中于肥胖相关生物因子方面,以下对表1中涉及的近年来在针刺治疗肥胖模型大鼠这一领域研究较深入的肥胖相关生物因子进行分类概述。
3 针刺调控的肥胖相关作用因子
3.1 Leptin与肥胖病
瘦素(Leptin)位于7号染色体上,是脂肪细胞分泌产生的一种由167个氨基酸组成的肽类激素,其相对分子质量为16KD[10]。Leptin主要在棕色脂肪组织(WAT)合成和分泌,但在多种组织中表达,包括胎盘、卵巢、骨骼肌、乳腺上皮、骨髓和淋巴组织[11]。
Leptin与Leptin受体的结合,在中枢神经系统,特别是在下丘脑中激活STAT3依赖和非依赖的信号通路、在维持能量稳态、神经内分泌作用和代谢等方面都发挥了很重要的作用[12]。Leptin主要作用于下丘脑,在肥胖病发病机理的早期研究中被认为是通过调节脑内食欲相关中枢神经元的活动和中枢神经系统的受体来增加饱腹感和促进能量消耗来起作用[13]。据报道,下丘脑中存在两类摄食因子:致厌食肽和促食欲肽,通过组成的神经环路感受能量存储的外周信号,从而调节机体的摄食行为[14]。近年来,生理学研究[15]发现当血清中瘦素水平升高时,瘦素通过作用于下丘脑使阿黑皮素原系统功能增强, 进一步激发一系列的生理反应 , 从而使交感神经兴奋性和机体的耗能加强,摄食减少。此外,Banks等[16]把有放射性标记的Leptin经静脉注射后, 经过外周血液循环最终在大脑组织中检测到了75%的标记Leptin,表明Leptin主要是通过作用于脑来对摄食和能量代谢进行调节的。目前研究[17]证实Leptin通过3条途径进入脑内:①直接从缺乏血脑屏障的下丘脑弓状核区域进入脑;②由受体介导的转运系统通过血脑屏障而进入脑;③由迷走神经介导传入孤束核和下丘脑。
基于Leptin在肥胖病中的重要角色,已成为了肥胖病药物治疗的潜在靶点。目前一系列与Leptin相关的分子正在被作为减肥药物的靶点进行研究开发,如Leptin受体激动剂、Leptin增敏剂-蛋白酪氨酸磷酸化酶1B(PTP1B)抑制剂等,将成为未来肥胖病治疗的新希望[18]。
3.2 NPY与肥胖病
神经肽Y(NPY)是一种强效的下丘脑促食欲肽,广泛分布于中枢神经系统和外周神经系统。中枢部的NPY普遍存在于大脑皮质、海马、边缘系统和下丘脑区域,其中下丘脑是NPY神经元最主要的分布部位;外周部的NPY产生于交感神经系统,包括交感神经节后肾上腺髓质和神经元等处,从而协同去甲肾上腺素影响交感神经功能[19]。
NPY调节机体的摄食行为和能量平衡,对肥胖病的发病过程起着关键作用。Clark JT教授等向大鼠的脑室中注射NPY观察发现大鼠的食物摄入增加,并且这种作用随着NPY剂量的增多逐渐增强[20]。随后的研究发现,肥胖动物模型的NPY基因均呈高表达状态,并且肥胖状态下更容易激活NPY的释放,即使对大鼠进行促进摄食药物的处理后也会激发NPY基因的高表达[21]。高表达的NPY基因进一步导致食欲过剩,机体为维持能量的平衡状态会增加能量消耗。一项关于NPY促进白色脂肪(WAT)大量堆积的研究结果显示中枢性和外周性的NPY均可以通过促进机体WAT的堆积进一步诱导肥胖病的发生,一方面伴随BAT在体内的含量减少,另一方面BAT的活性受到抑制,均可能是导致肥胖病的潜在机制[22]。此外,在小鼠下丘脑中调节NPY的水平使之过表达,3周之后观察到小鼠的体重显著增加,且体内WAT含量增加接近4倍[23]。
上述一系列研究可以提示NPY的水平是诱发肥胖病相关症状的一个重要因素,虽然NPY基因的异常表达与肥胖病症状表现及发病机制之间的关系尚未被完全阐述,但是现阶段在肥胖病的临床药理学研究中,NPY受体及其多种亚型已经被作为药品开发的主要方向。有研究者通过实验证实Y1R拮抗剂BMS-193885能够透过血脑屏障来发挥抑制摄食行为和降低体重的作用,且无明显的心血管疾病等伴随症状[24]。目前还需开展进一步的研究来阐明其减肥的具体效应机制。
3.3 TNF-α与肥胖病
肿瘤坏死因子(TNF-α)属于单核细胞因子,主要在活化的单核细胞、巨噬细胞合成分泌,此外,血管平滑肌细胞和脂肪细胞中也可以产生[25]。一般在生理条件下,肝、脾、肾及胸腺等组织中均有TNF-αmRNA的表达,TNF-αmRNA在脂多糖(Lipopolysacchcride,LPS)的刺激下,表达显著增强,通常即使血中TNF-α浓度极低,血管内皮细胞、中性粒细胞等也可以被激活[26]。
TNF-α作为一种炎性因子,参与广泛的生物学效应,主要介导免疫应答和炎症反应等病理过程。1993年Forsythe等[27]在肥胖动物研究中发现TNF-αmRNA在脂肪细胞中过度表达的现象,且血清中TNF-α水平明显升高,首次将慢性炎症和肥胖病联系在了一起。近年来又有相关报道TNF-α通过旁分泌和自分泌的方式介导产生,此后作用于脂肪细胞,通过抑制脂肪合成和促进脂肪分解的方式,诱导脂肪细胞和前脂肪细胞凋亡消失或抑制前脂肪细胞分化成熟,TNF-α是体内脂质代谢的重要平衡因子,在不同组织中与多种细胞因子相互作用从而间接或直接地参与调节体内糖脂代谢相关过程[28]。肥胖病常伴随多种并发症如胰岛素抵抗、高血脂等疾病的产生,TNF-α可能是胰岛素抵抗发生过程中的重要作用因子,在TNF-α与肥胖病关系的研究中目前主要集中在血清、脂肪细胞中探讨TNF-α的表达,关于TNF-α介导的肥胖病等一系列生理病理过程的机制还需进一步的研究。
4 述评与展望
针刺治疗肥胖病具有副作用小、疗效较高的特点,一直以来被称为绿色减肥法,但目前其作用机制仍缺乏深入的研究。通过对近10年来的相关国内外文献进行整理,笔者总结了在今后的机制研究中可从如下几个方面进行完善。
4.1 肥胖大鼠模型的选择
目前研究肥胖病的动物模型主要集中在高脂饮食诱导型肥胖动物模型,食物被认为是导致单纯性肥胖病的主要环境因素,因此高脂饮食诱导的肥胖模型是最接近临床上肥胖病发病的普遍情况。造模成功的标准一般是以造模结束后高脂饮食组大鼠的体重至少超出普食组大鼠平均体重的20%,但近年来有些报道提出,判断肥胖动物是否造模成功的结局指标不应单凭体重,应根据肥胖指数(Lee’s指数)、体重共同的改变和皮下脂肪堆积的程度来评判筛选[29]。此外,不同年龄段的幼年动物对高脂饮食的敏感性存在差异,这种差异并非体脂含量的不同,而是集中表现在脂肪在体内分布部位的差异,雄性动物在前肢的脂肪垫比例大于雌性,生殖器官附近和腹部的脂肪垫比例较雌性小[30]。为研究针刺治疗单纯性肥胖病的发病机制,还需要更强有力的证据支持来选择合适的动物模型。
4.2 针刺方法及具体参数的设定
现有针刺治疗肥胖大鼠模型的研究一般选用GT6805或Hans电针仪,疏密波或连续波,频率在2~15 Hz左右,针刺深度多控制在4 mm左右,刺激强度以老鼠身体呈规律性抖动且能耐受的程度为准,单纯手针刺激和电针刺激的留针时间范围为10~40 min,多数选择留针15 min。纳入的51篇文献中有部分文献未详细描述针刺的具体参数。随着针灸诊疗技术的不断规范化以及对实验操作的严谨性要求,期望在此研究的基础上建立更加完善、规范的实验操作和具体参数的设定方法,使得未来相关实验的重复性更高。
4.3 针刺机制研究的方向
目前存在一种“中枢调节定点”理论,该理论对肥胖的形成有一个新的认识,能量以及营养物质的吸收、消耗和储备在体内构成了一个精细复杂的平衡系统,
从信号的传入到传出中枢神经系统各个部分共同作用保持着机体能量和体重之间相对恒定的状态[31]。机体能量储备的情况(成分和含量)以传入信号的方式被中枢神经系统感知,继而刺激垂体发出信号,瘦素、神经肽等物质对信号进行处理,最终对能量的摄取及利用进行调节。
随着肥胖病及其并发症发病率的不断升高以及相关针刺减肥机制研究的不断深入,越来越多潜在的作用靶点被逐渐挖掘出来。目前针刺治疗肥胖病主要关注在针刺对下丘脑和脂肪细胞生物因子上,如促食因子orixin、NPY和抑食因子MC4R、Leptin,今后在开展这方面的工作中可将研究视角逐渐转移到离子信号通路、神经递质及其受体方面上,例如葡萄糖转运蛋白3(Glut-3)、MCP-1(单核细胞趋化蛋白-1)、肉碱棕榈酰转移酶-1(CPT-1)及其相关信号通路等。
综上所述,进一步规范化动物模型造模成功的标准、针刺操作的参数指标等是研究针刺治疗肥胖病作用机制的前提,如何更加深入的从相关基因的表达、神经递质的释放和信号通路的转导来阐明针刺减肥的调控机制将是今后开展这方面研究的方向。
[1] 危北海,贾葆鹏.单纯性肥胖病的诊断及疗效评定标准[J].中国中西医结合杂志,1998,18(5):317-319.
[2] Tam CS,Lecoultre V,Ravussin E.Brown adipose tissue: mechanisms and potential therapeutic targets[J].Circulation,2012,125(22):2782-2791.
[3] 杨春壮,马英,徐永良,等.针刺对单纯性肥胖大鼠血清瘦素含量和下丘脑瘦素受体表达的影响[J].针刺研究,2007,32(6):384-388.
[4] 赵玫,袁锦虹,李嘉,等.针刺对实验性肥胖大鼠下丘脑摄食中枢的影响[J].中国针灸,2001,21(5):305-307.
[5] 王媛.中枢不同部位参与针刺调节大鼠胃功能的观察[D].南京:南京中医药大学,2014.
[6] 刘志诚,孙凤岷,赵东红,等.针刺对肥胖大鼠神经肽Y及其基因表达的影响[J].针刺研究,2003,28(3):192-198.
[7] Darbandi S,Darbandi M,Mokarram P,et al.Effects of body electroacupuncture on plasma leptin concentrations in obese and overweight people in Iran: a randomized controlled trial[J].Altern Ther Health Med,2013,19(2):24-31.
[8] Chen C,Williams PF,Cooney GJ,et al.Diurnal rhythms of glycogen metabolism in the liver and skeletal muscle in gold thioglucose induced-obese mice with developing insulin resistance[J].Int J Obes Relat Metab Disord,1992,16(11):913-921.
[9] 雷君.中枢及外周自主神经系统对内脏功能的调控机制[D].武汉:华中科技大学,2006.
[10] Zhang F,Basinski MB,Beals JM,et al.Crystal structure of the obese protein Ieptin-E100[J].Nature,1997,387(6629):206-209.
[11] Dardeno TA,Chou SH,Moon HS,et al.Leptin in human physiology and therapeutics[J].Frontiers in Neuroendocrinology,2010,31(3):377.
[12] 李淑芬,李希.瘦素在正常生理情况下的作用和瘦素抵抗(英文)简[J].科学通报:英文版,2016,61(19):1480-1488.
[13] Bray N.Reversing resistanceto leptin in obesity[J].Nat Rev Drug Discov,2015,14(7):458-459.
[14] Sahu A.Leptin signaling in the hypothalamus: emphasis on energy homeostasis and leptin resistance[J].Frontiers in Neuroendocrinology,2003,24(4):225.
[15] Bouret SG,Draper SJ,Simerly RB.Trophic action of leptin on hypothalamic neurons that regulate feeding[J].Science,2004,304(5667):108-110.
[16] Banks WA,Kastin AJ,Harrison LM,et al.Perinatal treatment of rats with opiates affects the development of the blood-brain barrier transport system PTS-1[J].Neurotoxicology & Teratology,1996,18(6):711-715.
[17] Wang L,Barachina MD,Martínez V,et al.Synergistic interaction between CCK and leptin to regulate food intake[J].Regul Pept,2000,92(1-3):79-85.
[18] 曾凡新,董志,傅洁民,等.减肥药的作用新靶点及相关新药研发近况[J].药学进展,2006,30(1):23-29.
[19] Bi S,Kim YJ,Zheng F.Dorsomedial hypothalamic NPY and energy balance control[J].Neuropeptides,2012,46(6):309-314.
[20] Clark JT,Kalra PS,Kalra SP.Neuropeptide Y stimulates feeding but inhibits sexual behavior in rats[J].Endocrinology,1985,117(6):2435-2442.
[21] Li AJ,Ritter S.Glucoprivation increases expression of neuropeptide Y mRNA in hindbrain neurons that innervate the hypothalamus[J].European Journal of Neuroscience,2004,19(8):2147.
[22] Macia L,Yulyaningsih E,Pangon L,et al.Neuropeptide Y1 Receptor in Immune Cells Regulates Inflammation and Insulin Resistance Associated With Diet-Induced Obesity[J].Diabetes,2012,61(12):3228-3238.
[23] Bo E,Farinetti A,Marraudino M,et al.Adult exposure to tributyltin affects hypothalamic neuropeptide Y, Y1 receptor distribution, and circulating leptin in mice[J].Andrology,2016,4(4):723-734.
[24] Mercer RE,Chee MJ,Colmers WF.The role of NPY in hypothalamic mediated food intake[J].Frontiers in Neuroendocrinology,2011,32(4):398-415.
[25] Jeppsson S,Srinivasan S,Chandrasekharan B.Neuropeptide Y (NPY) promotes inflammation-induced tumorigenesis by enhancing epithelial cell proliferation[J].American Journal of Physiology Gastrointestinal & Liver Physiology,2016,312(2):G103-G111
[26] 沈佳云.单纯性肥胖儿童TNF-α、IL-6水平的变化[D].大连:大连医科大学,2014.
[27] Forsythe LK,Wallace JM,Livingstone MB.Obesity and inflammation: the effects of weight loss[J].Nutrition Research Reviews,2008,21(2):117-133.
[28] Chen C,Williams PF,Cooney GJ,et al.Diurnal rhythms of glycogen metabolism in the liver and skeletal muscle in gold thioglucose induced-obese mice with developing insulin resistance[J].International Journal of Obesity & Related Metabolic Disorders Journal of the International Association for the Study of Obesity,1992,16(11):913-921.
[29] 申瑞玲,马婧.四种肥胖动物造模方法的比较[J].动物医学进展,2007,28(3):105-108.
[30] Velkoska E,Morris MJ,Burns P,et al.Leptin reduces food intake but does not alter weight regain following food deprivation in the rat[J].International Journal of Obesity,2003,27(1):48-54.
[31] Mrosovsky N,Powley TL.Set point for body weight and fat.Behav Biol[J].Behavioral Biology,1977,20(2):205-223.
