莱菔硫烷对酒精诱发肝脏脂肪代谢异常的 预防作用及机制研究
2018-03-13李宝龙赵瑶洁刘旭李松滨刘永武姜波单毓娟
李宝龙,赵瑶洁,刘旭,李松滨,刘永武,姜波,单毓娟
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.哈尔滨工业大学,黑龙江 哈尔滨 150090)
肝脏作为人体重要的代谢器官,是受酒精毒害的首要器官之一。据统计,全球3.8%的死因是由于摄入酒精所致[1]。酒精性肝损伤或酒精性肝病(alcoholic liver disease,ALD)是由于长期大量饮酒所致,酒精性脂肪肝(alcoholic fatty liver,AFL)为其初期表现,后期可进展成酒精性肝炎、肝纤维化和肝硬化。由于酒精摄入的特殊性,从药食资源中寻找拮抗或者减弱酒精毒害的活性成分是防控酒精危害的重要策略。莱菔子在中国有着悠久的食用、药用历史,其活性成分莱菔硫烷(Sulforaphane,SFN)富含于十字花科植物中,具有代谢解毒、抗氧化、抑制炎症、免疫调节等活性[2-4],被认为是一种极具开发价值的食源性活性成分。本课题组前期研究发现,SFN可通过抗氧化和降低炎症反应来保护同型半胱氨酸引起的肝细胞损伤[5],并对酒精导致肝损伤相关代谢酶的损伤具有效保护[6];由于脂质过氧化和炎症反应也是酒精性肝损伤发生发展的病理学基础,因此推测SFN可能通过脂代谢调控对酒精性肝损伤有保护作用。为验证该假设,本研究对SFN是否在急性酒精性肝损伤中发挥保护作用进行了探讨,并从脂肪代谢和抗氧化角度,对其可能的作用机制进行初步研究。
1 材料和方法
1.1 主要试剂
莱菔硫烷购自LKT laboratories公司(英国);GSH和GST检测试剂盒购自南京建成生物科技有限公司(南京);Bradford 蛋白检测试剂盒购自碧云天生物技术研究所(上海);TG和CHOL检测试剂盒购自中生北控生物科技公司(北京);免疫组化一抗anti-Nrf2,anti-β-actin,anti-SREBP-1c购自Santa Cruz生物科技公司(美国)。
1.2 实验动物及饲养
5周龄SPF级雄性C57BL/6小鼠,体质量18~20 g,购自北京维通利华实验动物技术有限公司,合格证号SCXK(京)2016-0011,在屏障环境内适应性喂养两天之后进行正式分组及实验。在实验期间实验动物自由饮水、摄食。SPF级小鼠维持饲料购自北京科澳协力饲料有限公司,经60Co辐照灭菌,合格证号SCXK(京)2014-0010。动物实验在黑龙江中医药大学实验动物中心进行,许可证号SYXK(黑)2013-004,动物实验室温度22~24℃,相对湿度40%~60%、照明12 h/12 h昼夜交替进行。
1.3 实验动物分组及处理
60只雄性C57BL/6小鼠,按体质量随机分为5组,每组12只,阴性对照组、酒精模型组、SFN处理组(低剂量组10 mg/kg、中剂量组20 mg/kg、高剂量组40 mg/kg)。实验开始时,给处理组动物经口灌胃不同剂量的SFN 10d(1次/d)。参照Carson和Pruett的方法构建急性酒精性肝损伤模型,在末次灌胃SFN后,立即给予酒精模型组和SFN处理组动物酒精(5 g/kg),每12 h 1次,共给予3次,末次给予酒精4 h后,眼球取血制备血清,颈椎脱臼处死动物。阴性对照组给予等热量的葡萄糖。
1.4 肝匀浆制备及氧化还原指标的测定
每只小鼠取肝左叶0.5 g于预冷生理盐水(NS)中漂洗数次后滤纸吸干,加入4.5 mL预冷NS匀浆。用眼科剪尽快剪碎组织块,并于玻璃器中制成10%肝组织混悬液,然后在4℃条件下以10 000 r/min离心20 min,取上清(肝匀浆)分装于EP管中,置于-80℃冰箱中冷冻保存。用酶标仪按照试剂盒说明测定谷胱甘肽(GSH)含量和谷胱甘肽硫转移酶(GST)的活性。
1.5 血清脂肪代谢指标测定
血清中TG、CHOL和HDL水平的测定采用中生北控生物科技公司的试剂盒,用半自动生化分析仪进行测定。
1.6 免疫组化法检测Nrf2蛋白的表达
用二甲苯对肝脏组织切片进行脱蜡,乙醇浓度递减梯度进行复水并灭活内源性过氧化物酶,然后用10%羊血清封闭非特异性信号。随后在4℃下与anti-Nrf2特异性抗体杂交过夜,随后与二抗孵育30 min。用DAB显色2 min,苏木精复染和封片。高倍镜(1 000倍)下观察五个视野共约2 000个细胞中的阳性细胞数,并进行拍照。
1.7 组织蛋白的提取及SREBP蛋白表达的测定
取-80℃保存的肝组织,放入研钵中,加入适量液氮研磨,按1%比例加0.1 mol/L PMSF和磷酸酶抑制剂,使均匀覆盖细胞,4℃放置1 h(期间摇匀3~5次),4℃ 13 000 r/min 离心20 min,上清即为组织总蛋白。总蛋白含量测定采用Bradford方法,蛋白分离采用SDS-聚丙烯酰胺凝胶电泳进行,半干法转膜(PVDF膜),后用特异性一抗和碱性磷酸酶标记的二抗进行杂交,室温下显色。
1.8 统计学处理
2 结果
2.1 莱菔硫烷对酒精引起的高血脂的改善作用
小鼠给予急性酒精刺激后,血清TG、CHOL水平明显升高,相比于阴性对照组,TG升高了82%,CHOL升高了49%,而HDL未有明显变化,见表1,与模型组相比,低、中、高剂量SFN预保护能使TG水平下降45%~56%,(表1,P<0.01);中、高剂量的SFN使CHOL得水平下降28%~30%,并接近了阴性对照组的水平;SFN对HDL的影响不大。
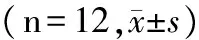
表1 SFN对小鼠血清中TG、CHOL和HDL水平的影响
注:与阴性对照组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01
2.2 莱菔硫烷对GSH水平和GST活性的影响
由表2可知,急性酒精刺激能使肝组织中抗氧化物GSH含量下降约34%(P<0.05),表明肝脏的抗氧化能力下降;GST活性降低34%,表明肝脏的解毒功能下降,提示急性酒精刺激损害了肝脏的正常功能。而在SFN预保护各组中,GSH的含量均明显增加,约提高57%~79%,SFN各剂量组之间GSH水平无显著性差异;SFN各作用组可使GST活性提高43%~80%(P<0.01);SFN对GST能完全逆转急性酒精对GST活性的抑制作用,SFN预保护各组GST的活性仍保持在阴性对照组水平。

表2 SFN对小鼠肝组织中GSH和GST的影响
注:与阴性对照组相比,#P<0.05;与模型组相比,*P<0.05,**P<0.01
2.3 SFN对小鼠肝组织Nrf2蛋白表达的影响

图1 SFN对肝组织中Nrf2表达的影响(×1 000) 注:A:阴性对照组;B:模型组;C:低剂量组;D:中剂量组;E:高剂量组
由图1可见Nrf2被染成棕色颗粒,阴性对照组小鼠仅在肝细胞胞浆有Nrf2的弱阳性表达,呈浅棕色,此时细胞核蓝染,无可见的棕色颗粒,提示细胞核中午Nrf2表达。急性酒精刺激后,肝细胞浆中可见少量Nrf2的表达,细胞核中亦有少量表达。SFN预保护后,可见相应组织中Nrf2表达明显增强,特别是核内Nrf2的表达明显增强,细胞浆和细胞核内均可见大量、深染的棕色颗粒。
2.4 小鼠肝组织中转录因子固醇调节因子合成蛋白的表达
如图2所示,急性酒精刺激后,肝组织中的固醇调节元件合成蛋白(SREBP-1c)表达增加;SFN预保护各组,SREBP-1c的表达与酒精模型组相比,有明显降低,特别是中、高剂量的SFN的抑制作用较明显。
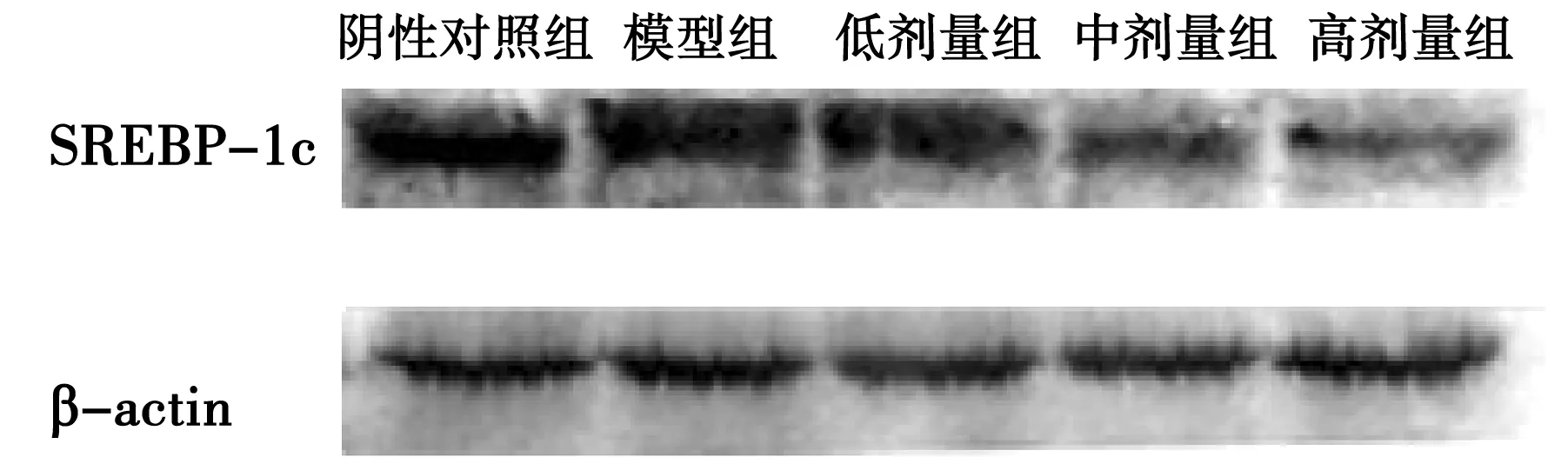
图2 SFN对小鼠肝组织中SREBP-1c蛋白的表达
3 讨论
莱菔硫烷是十字花科植物萝卜成熟的种子中的一种有效成分。《本草纲目》记载莱菔子可 “消食,除胀,利大小便,止气痛”;著名医家张锡纯认为,莱菔子具有“顺气开郁,消胀除满”的功效。可用于脘腹胀满,气滞腹痛的治疗。酒精性肝损伤患者可出现上腹部胀痛、恶心、呕吐、纳差等症状,可归属为中医疾病之腹痛。莱菔子的提取物莱菔硫烷消食除胀痛的作用机制可能与抑制胆固醇及甘油三酯合成有关。
本研究结果表明,SFN能够保护酒精对肝脏脂肪代谢的损伤作用,其作用机制与激活Nrf2的表达以及其下游GSH和GST升高有关;此外SFN可通过抑制胆固醇合成的转录因子SREBP-1c表达,而抑制胆固醇和甘油三酯的合成。
SFN主要是以Nrf2依赖方式诱导抗氧化酶和II相解毒酶的表达。通常情况下Nrf2位于胞浆中,与其抑制剂Keap1相结合而铆钉在胞浆骨架蛋白上。当酒精摄入后,肝脏代谢产生的氧自由基会促使Nrf2与Keap1解偶联,随后Nrf2通过核穿梭机制在胞核中聚集,并与Maf蛋白等形成异二聚体后,与ARE结合介导Ⅱ相代谢解毒酶/抗氧化物酶的转录表达[7]。作者认为,酒精模型组动物在摄入酒精后,由于机体代谢产生的活性氧自由基,会促发Nrf2在小范围内表达增加和核转移,这是机体的一种保护性应激反应,而当大量的活性氧自由基生成后,如果没有其他清除机制激活,将导致肝脏的损伤[8]。本研究发现,SFN预保护后,由于激活了Nrf2的表达和核转位,使其调控的Ⅱ相解毒酶GST活性增加,同时SFN还通过直接增加GSH的含量[9],达到更强的抗氧化能力。
SREBP-1是一种核转录因子,直接参与脂肪酸、甘油三酯合成和葡萄糖代谢相关基因的表达,属于固醇调节元件结合蛋白(SREBPs)中的一种[10-11]。本研究中,急性酒精刺激引起了SREBP-1c的表达,后者将激活其下游的相关靶基因如乙酰CoA羧化酶(ACC)、脂肪酸合成酶(FAS)、甘油-3磷酸脂酰转移酶(GPAT)等的表达和激活,从而导致脂肪酸合成增多[12],肝脏脂质代谢障碍甚至酒精性脂肪肝的发生,这是肝脏病理学表现以及血清中TG和CHOL升高的内在原因。SFN通过抑制SREBP-1c的表达,阻止了上述病理过程的激活,因而达到了保护肝脏损伤的效果。
综上,SFN通过激活转录因子Nrf2增强了抗氧化作用,同时通过抑制转录因子SREBP-1c,改善了酒精所致的肝脏脂肪代谢的异常,二者综合作用最终对急性酒精性肝损伤发挥了保护作用。
[1] Rehm J,Mathers C,Popova S,et al. Global burden of disease and injury and economic cost attributable to alcohol use and alcohol-use disorders[J]. The Lancet,2009,373(9682):2223-2233.
[2] Dinkova-Kostova AT and Kostov RV. Glucosinolates and isothiocyanates in health and disease[J].Trends in Molecular Medicine,2012,18:337-347.
[3] Xue M,Qian Q,Adaikalakoteswari A,et al. Activation of NF-E2-related factor-2 reverses biochemical dysfunction of endothelial cells induced by hyperglycemia linked to vascular disease[J].Diabetes,2008(57): 2809-2817.
[4] Lee JH,Moon MH,Jeong JK,et al. Sulforaphane induced adipolysis via hormone sensitive lipase activation,regulated by AMPK signaling pathway[J].Biochemical and Biophysical Research Communications,2012(426): 492-497.
[5] Canxia He,Baolong Li, Yujuan Shan ,et al. Sulforaphane Attenuates Homocysteine-Induced Endoplasmic Reticulum Stress through Nrf-2-Driven Enzymes in Immortalized Human Hepatocytes[J].Journal of Agricultural and Food Chemistry,2014,62(30): 7477-7485.
[6] 李宝龙,单毓娟,刘旭,等. 莱菔硫烷对C57BL/6小鼠急性酒精性肝损伤的保护作用[J].中医药学报,2017,45(3):13-16.
[7] Deng C,Tao R,Yu S Z,et al.Inhibition of 6-hydroxydopamine-induced endoplasmic reticulum stress by sulforaphane through the activation of Nrf2 nuclear translocation[J]. Mol Med Rep,2012,6(1),215-219.
[8] Gao B,Bataller R.Alcoholic liver disease: pathogenesis and new therapeutic targets[J]. Gastroenterology,141(5):1572-1585.
[9] Fahey JW,Talalay P. Antioxidant functions of sulforaphane: a potent inducer of Phase II detoxication enzymes[J].Food Chem Toxicol,1999,37:973-979.
[10] Jump DB,Botolin D,Wang Y,et al. Fatty acid regulation of hepatic gene transcription[J]. J Nutr,2005, 135:2503-2506.
[11] Ferre P,Foufelle F.SREBP-1c transcription factor and lipid homeostasis: clinical perspective[J].Horm Res,2007(68):72-82.
[12] Sewter C,Berger D,Considine RV,et al. Human obesity and type 2 diabetes are associated with alterations in SREBP1 isoform expression that are reproduced ex vivo by tumor necrosis factor-alpha[J].Diabetes,2002( 51):1035-1041.
