螺旋藻对运动疲劳大鼠海马损伤的保护作用及机制研究*
2018-03-13朱洪竹朱梅菊伍人乐曾志刚
朱洪竹, 张 莹, 朱梅菊, 伍人乐, 曾志刚
(井冈山大学体育学院, 江西 吉安 343009)
脑源性神经营养因子( brain-derived neurotrophic factor,BDNF)是在脑内合成分布于中枢神经系统内(主要表达于海马组织)的一种蛋白质[1],除对神经元的存活、分化、生长发育起重要作用外,还能促进受损神经元修复和再生,对缺血性脑损伤具有较强保护作用[1-3]。酪氨酸激酶B(tyrosine kinase receptor B, TrkB)是BDNF的功能性受体, BDNF发挥神经元保护作用依赖其受体TrkB的激活, BDNF/TrkB在各种脑损伤时神经元修复和挽救退行性病变神经元死亡有重要作用。而大强度的超负荷训练会引起运动员疲劳,也常常会导致脑组织损伤[4], 影响运动员成绩和身心健康。最近研究显示, BDNF在抵抗大强度运动性海马神经元损伤中有重要作用[4]。螺旋藻是一种生活在热带海洋中的藻类植物,其有效成分是螺旋藻多糖,具有多种生物学功能,它可以中和运动后过多的乳酸,提高机体组织抗氧化能力,有利于身体疲劳的恢复等。现有研究发现螺旋藻有一定的神经保护作用[5]。但有关螺旋藻对大强度运动所致海马神经元损伤的保护作用研究较少。而目前尚未阐明螺旋藻能否通过其对BDNF/TrkB神经营养信号的调节表现出抗运动疲劳大鼠海马神经元损伤。本研究采用递增大强度跑台运动疲劳模型[6-7],观察BDNF/TrkB神经营养信号在运动疲劳大鼠海马神经元损伤中的作用及螺旋藻改善运动致脑海马损伤的可能作用机制,为螺旋藻在体育运动实践中的应用提供实验依据。
1 材料与方法
1.1 动物与分组
60只雄性清洁级SD大鼠,4周龄,体质量(140±20)g,由中国科学院上海实验动物中心湖南斯莱克景达实验动物公司提供(SCXK(湘)2011-0003)。清洁级环境适应性喂养3 d后,随机将大鼠分为正常对照组(NC组)、正常+螺旋藻灌胃组(NS组)、运动模型组(EM组)、运动+螺旋藻灌胃组(ES组)、阳性对照组(运动+人参提取物,PC组),共5组,每组12只。分笼饲养,自由饮食饮水, 室温(22± 0.5)℃,湿度40%~60%。
1.2 人参提取物制备
因人参是公认的抗疲劳的中药[8],故选为阳性对照药。将云南产人参40 g,用蒸馏水浸泡30 min,按文献[9]方法制备人参提取物4 g。提取物中每mg相当于0.01 g生药。4℃保存备用。
1.3 药物灌胃处理
NS组和ES组按每天300 mg/kg体重灌胃螺旋藻,临用前螺旋藻用生理盐水稀释。灌胃体积2 ml/只,每周7 d,1次/天,连续3周。NC组和EM组以同等体积生理盐水灌胃。PC组以同等体积的人参提取物(1.92 g/kg)灌胃[9]。以上灌胃均在运动前2 h内进行。
1.4 运动方案
除NC组和NS组外,其余组大鼠采用跑台运动方式,对大鼠进行递增大强度跑台运动训练,主要实验仪器为ZH-PT动物实验跑台(安徽淮北正华)。坡度为零,训练时间3周,7天/周,每天1次,并每天观察并记录大鼠的一般情况。本运动方式参照汶希等[6-7]建立的大鼠跑台运动疲劳模型,具体见表1。NC组和NS组均在同样条件下常规喂养,但不进行跑台运动。
1.5 主要设备与试剂
PM-10AD型光学显微镜,OLYMPUS公司,日本;图像分析系统(用日本JVC公司的3-CCD摄像头与Image-Pro Plus图像处理软件);Quantity One凝胶电泳图像软件分析系统,美国。
兔抗鼠BDNF、TrkB、p-TrkB为多克隆抗体,购于Santa Cruze有限公司。螺旋藻胶囊:深绿色粉末,由云南施普瑞生物公司提供,国药准字:Z53020227。
1.6 实验取材
实验末,分批麻醉(水合氯醛,10%)各组大鼠。打开胸腔,暴露心脏,剪破右心耳,左心室插管灌入冷生理盐水和4%多聚甲醛,灌注完后断头,打开颅腔取出全脑,剥离海马组织,置10%甲醛溶液中固定,待作光镜标本和免疫组化检测。另取新鲜海马组织,置液氮冻存后待作免疫印迹法(Western blot)检测p-TrkB表达。
1.7 海马光镜标本的制作与观察
从固定液中取出海马组织,常规脱水、石蜡包埋、连续切片(厚度度5 μm),进行尼氏染色。显微镜观察海马CA1区神经元形态结构的改变。
1.8 免疫组织化学检测BDNF、TrkB表达
常规方法制作海马石蜡切片(厚度3 μm),用SABC法进行BDNF、TrkB免疫组织化学染色,严格按试剂盒的说明进行规范操作(BDNF、TrkB一抗工作浓度分别为: 1∶100、1∶150)。用显微镜与图像分析系统来检测阳性表达。测定免疫组化阳性染色的光密度(OD)值,取平均值作为测定值,其值越大表示BDNF、TrkB阳性产物表达越强。

Tab.1 The training program of the rat model during the experiment(m/min× min)
1.9 Western blot检测p-TrkB表达
用Quantity One凝胶电泳图像软件系统分析,以所拍胶片的(蛋白条带中的灰度值/内参GAPDH灰度值)的比值大小表示。
1.10 统计学处理
2 结果
2.1 各组大鼠体重等一般情况的变化
正常对照NC组和正常+螺旋藻灌胃NS组体重持续均衡增长,活动正常。运动模型EM组大鼠从第2周起体重增长缓慢,第3周起体重呈负增长,出现形体消瘦,目光呆滞,毛松,活动次数减少等疲劳症状。补充螺旋藻的ES组和阳性对照PC组要好于EM组,体重虽增长较慢,但未出现负增长,少见毛发稀少、嗜睡等现象(表2)。

Tab.2 Changes of body weight of rats in the groups during the experirnent(g)
NC: Normal control group; NS: Normal plus spirulina group; EM: Exercise model group; ES: Exercise plus spirulina group; PC: Positive control group(PC)
Before the experirnentn=12, the second weekend of experirnentn=11, the third weekend of experirnent,n=10
*P<0.05,**P<0.01vsthe same time of NC group;##P<0.01vsthe corresponding time point of EM group
2.2 各组大鼠海马CA1区形态学观察
光镜下NC组和NS组大鼠海马CA1区神经元排列整齐,结构完整,多数细胞呈圆形或椭园形,细胞尼氏小体明显,着色清晰。EM组神经元细胞形态异常明显,神经元分布少且紊乱,细胞层次不清,胞体和胞核缩小,细胞尼氏小体消失或不见。ES组海马神经元细胞排列渐趋整齐,层次较明显,细胞形态渐趋正常,尼氏小体增多,着色较明显,其受损神经元的改善效果明显要好于EM组,与PC组渐趋接近(图1)。
2.3 各组大鼠海马区BDNF/TrkB免疫组化检测结果
如图2~图3(箭头所指为阳性细胞表达)和图4所示,正常对照NC和NS组海马区BDNF、TrkB蛋白有基础表达,阳性细胞少且染色浅。运动模型EM组大鼠海马区BDNF、TrkB蛋白表达逐渐增加,其阳性染色平均光密度值较NC组有明显差别(P<0.01)。螺旋藻干预的ES组海马区BDNF、TrkB表达量明显增多,染色加强,与EM组相比,有显著差异(P<0.05或P<0.01);且显著高于NS组(P< 0.01),与阳性对照PC组相比,已无明显差别(P> 0.05)。
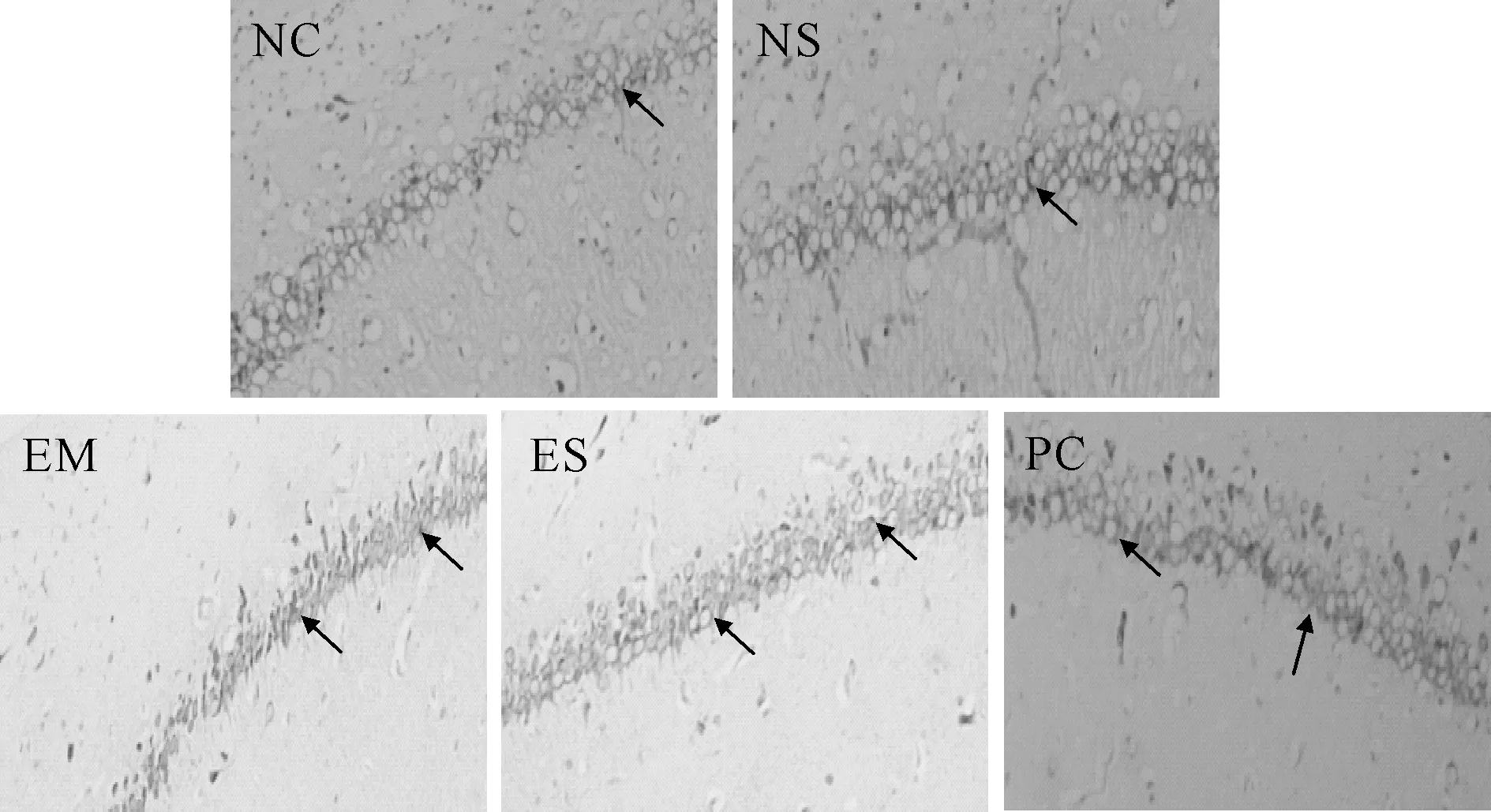
Fig.1Pathological changes of hippocampal CA1 among each group(Nissl staining ×200)
The arrows in NC group and NS group of Fig. 1 indicated that the hippocampal neuron cells were complete, and the obvious Nissl bodies were clearly colored.The arrows in EM group indicated that the cells morphology were abnormal and unclear cell layer, and some Nissl bodies disappear.The arrows in ES group indicated that the injuried neurons improved and were better than that of EM group and closer to PC group

Fig.2Changes of BDNF expression in hippocampal among each group(Immunohistochemistry slice ×400)

Fig.3Changes of TrkB expression in hippocampal among each group(Immunohistochemistry slice ×400)
The arrows in the group of Fig. 2 and Fig. 3 indicated that the granules were positive expression in hippocampal neurons

Fig.4Changes of BDNF/TrkB mean optical density in hippocampal of the groups(n=6)
**P<0.01vsNC group;#P<0.05,# #P<0.01vsEM group;▲P<0.01vsES group
2.4 各组大鼠海马组织p-TrkB Western blot检测结果
由图5可见,与NC组和NS组比较,其余各组大鼠海马p-TrkB蛋白表达均明显升高(P均< 0.01)。螺旋藻补充3周后,ES组的p-TrkB蛋白表达显著高于EM组和NS组(P均<0.01),其蛋白表达水平稍低于PC组(P>0.05)。

Fig.5Changes of the relative p-TrkB protein expression of the hippocampal of rats in five groups(n=3)
**P<0.01vsNC group;# #P<0.01vsEM group;▲P<0.01vsES group
3 讨论
3.1 螺旋藻补充对运动大鼠体重等一般情况和海马形态结构的影响
本实验结果显示,运动模型组(EM组)大鼠出现活动次数减少,体重下降,食欲减退,毛发欠光泽稀疏等疲劳症状,与前期报道相似[9]。本课题组在前期实验过程中还发现,与正常对照大鼠相比,运动模型EM组大鼠血清尿素氮含量显著增加,乳酸脱氢酶活性明显降低,而这两指标常被作为反映运动量和评价机体疲劳程度的敏感指标[10]。说明大鼠对本实验训练负荷不适应,产生疲劳的某些特征[4]。这与黄诚胤的研究相似。其研究表明,4周递增运动至疲劳小鼠的血清乳酸脱氢酶活性明显降低,尿素氮含量呈增高趋势。以上说明本实验3周递增大强度跑台运动致大鼠疲劳模型制备成功。海马是介导应激的重要中枢, 而CA1区对缺血、缺氧等各种损伤性刺激敏感,是海马的易损区。结果发现,递增大强度运动可引起海马神经元的形态改变。光镜下可见到EM组CA1区神经元明显消失,细胞层次模糊不清,胞质尼氏小体数量减少甚至消失不见等异常现象,与前人研究相一致[4],表明本实验运动方式会造成海马神经元细胞的损害,引起脑损伤。螺旋藻补充后,运动疲劳大鼠海马CA1区病理损伤有所减轻,表现为细胞层次较清晰,胞核较清楚和尼氏小体数量逐渐增加等改善现象。结合表2的实验数据,说明螺旋藻有改善运动所引起的体重下降、降低血尿素氮和增加乳酸脱氢酶活性等的抗疲劳效果及减少海马CA1区病理损伤的神经保护作用。
3.2 螺旋藻补充对运动大鼠海马组织BDNF/TrkB神经营养信号的影响
脑源性神经营养因子(BDNF)是在脑内合成主要表达于海马神经元内的一种蛋白质,它不但对神经元的发育、分化、存活、神经元功能的维持、学习记忆等[11]有重要的调节作用,还能通过活化其特异性受体TrkB为受损神经元提供营养修复和保护神经元免受缺血性损伤[12]。BDNF与TrkB结合后,受体TrkB发生二聚体化,引起受体内在的酪氨酸自磷酸化,从而将胞外信号转导至胞内,发挥多种生物学功能。已有研究证实,6周的力竭运动可引起海马BDNF表达增加,以对抗力竭运动性脑损伤,对神经元起保护作用[13]。本研究结果表明,运动后EM组大鼠海马组织BDNF和TrkB的表达均出现明显上调,与文献报道相似[13]。本实验中Western blot定量检测结果也显示,运动后EM组TrkB磷酸化蛋白(p-TrkB)表达的趋势与BDNF、TrkB的表达趋势相似,均明显高于正常对照组,提示3周递增大强度运动可上调海马BDNF/TrkB信号通路。以往的研究已揭示出递增大负荷运动引起的中枢神经系统BDNF表达水平的提高可能是对运动所致中枢神经系统损伤的保护作用[14]。研究已知,运动应激、缺血、缺氧、神经损伤等多种因素均可引起BDNF表达增加。由此推测本实验递增负荷运动导致的脑相对缺血缺氧损伤海马神经元后,可能应激性的引起内源性神经保护因子BDNF的表达增多,而表达增加的BDNF再进一步通过活化其受体TrkB,激活BDNF/TrkB神经营养信号,在细胞内阻断损伤因子的作用[15],并参与运动致海马神经元损伤的修复和保护过程[14]。这可能是运动疲劳引起的海马神经元损伤后机体启动的一种内源性保护调节机制。递增运动所致海马损伤的同时,BDNF、TrkB、p-TrkB的表达也随着开始大量增多,这可能是运动时海马的相对缺血、缺氧诱导发生的两个相反级联过程,一方面可能由基因表达调控的海马神经元细胞发生的主动性死亡过程,另一方面在受损神经元细胞内通过损伤因子诱导BDNF等神经营养因子表达增加产生的一种平行的主动细胞修复和保护过程,以对抗递增负荷性海马神经元损伤。具体原因有待进一步探讨。至于这种应激性表达能维持多长时间,尚有待进一步作运动后不同时相点的研究。
作为“21世纪人类蛋白质的来源”的螺旋藻具有抗肿瘤、防辐射、抗衰老、降糖调脂、免疫调节等功效。螺旋藻神经保护作用研究不多。螺旋藻对运动疲劳所致海马神经元损伤的保护作用研究甚少。螺旋藻能否通过其对BDNF/TrkB神经营养信号的调节表现出抗运动疲劳大鼠海马神经元损伤?目前尚不明确。本研究进一步发现,补充螺旋藻后,ES组大鼠海马组织BDNF、TrkB和p-TrkB的表达比EM组均出现增高,且与阳性对照组比较无明显差异,预示螺旋藻可以进一步提高运动疲劳大鼠海马BDNF、TrkB和p-TrkB的表达水平。目前有关BDNF/TrkB神经营养信号与螺旋藻抗运动大鼠海马神经元损伤方面的报道很少见。此实验结果与吴春燕等[14]报道的中药八珍加肉桂补骨脂汤干预的运动疲劳大鼠海马组织中BDNF、TrkB蛋白表达值的变化趋势相似。虽然实验对象、实验方法、运动方式和干预手段等不同,但螺旋藻与中药八珍加肉桂补骨脂汤均有上调运动大鼠海马BDNF/TrkB通路蛋白表达的神经保护作用。有研究发现[16],BDNF与其表面受体TrkB结合后,可以调控神经元的发育分化、功能维持和突触可塑性;如果再增加BDNF和TrkB的表达强度,进而可再增加其神经的营养作用。结合前面研究已显示的螺旋藻补充后,运动大鼠的体重下降等疲劳相关症状和海马CA1区病理损伤的改善现象,由此可说明螺旋藻对海马神经元损伤的保护作用可能与其上调BDNF/TrkB信号通路有关。Prakashetal[17]研究报道,BDNF信号对损伤神经元的保护可能与其抵抗炎症介质诱导的损伤,调整自由基代谢,减少自由基积累,从而保护自由基攻击的神经元有关。也有研究表明,在损伤状态下, BDNF通过与其受体TrkB结合, 启动细胞内信号传导途径, 从而产生相应的效应分子对神经元起保护作用[18-19]。至于BDNF/TrkB神经营养信号介导螺旋藻抗运动性海马神经元损伤的具体分子机制,尚有待进一步探讨。
在本实验结果中我们还发现,NS组的BDNF、TrkB和p-TrkB蛋白表达虽然稍高于正常对照NC组,但两者不具有显著性差异;而ES组的BDNF等蛋白表达则明显高于NS组,两者有明显差别。说明单独补充螺旋藻并不能明显引起正常组BDNF/TrkB信号上调,而由于运动应激的作用螺旋藻则能明显上调该信号,说明BDNF/TrkB信号可能介导螺旋藻改善运动疲劳鼠海马损伤。这也间接佐证本实验中的BDNF这种内源性应激保护蛋白在海马损伤中的保护和修复作用,同时也提示运动员在进行递增强度运动至中枢疲劳时膳食中可适当补充螺旋藻。
本实验3周的递增负荷运动引起大鼠海马BDNF与其受体TrkB及受体磷酸化蛋白(p-TrkB)表达上调,BDNF/TrkB信号可能参与运动疲劳引起的海马神经元损伤的修复过程。螺旋藻对运动所致海马神经元损伤有一定的保护作用,其机制可能与其提高BDNF/TrkB神经营养信号通路蛋白表达水平有关。建议运动员在进行递增强度运动至疲劳时注意饮食中螺旋藻的补充。
