酒精对丙酸睾酮诱导的小鼠前列腺增生的作用*
2018-03-13芦春斌仇平乐孔绮君朱倍倍李春梦
芦春斌, 仇平乐, 孔绮君, 朱倍倍, 李春梦, 刘 标
(1. 暨南大学 生命科学技术学院 生殖免疫研究所, 广东 广州 510632; 2. 环境保护部 南京环境科学研究院, 江苏 南京 210042)
良性前列腺增生(benign prostate hyperplasia,BPH)是中老年男性中最常见的退行性疾病,40岁以上男性患病率为50%左右,60岁以上男性几乎全部患有不同程度的前列腺增生[1]。良性前列腺增生会增加患下尿路综合征和膀胱出口梗阻的风险[2],而且会导致生殖功能障碍[3],影响患者生育力,对前列腺增生的研究是男性学研究的重要内容。前列腺增生的发病原因较复杂,其具体机制尚不完全清楚,目前已知雄激素在BPH发病过程中起着重要作用[4]。类固醇激素睾酮(testosterone)在男性的睾丸中合成,其与雄激素受体共同影响着雄性的精子发生和功能[5],血液中过多的睾酮会抑制睾丸间质细胞内睾酮的生成,从而影响精子发生和睾丸生长,使精子数量降低[6]。前列腺的生长发育主要利用血液中的睾酮,在前列腺中5-α还原酶能将睾酮转化为双氢睾酮。双氢睾酮的活性是睾酮的2~3倍[7]。 双氢睾酮在前列腺增生中起主要作用,其可通过结合雄激素受体(androgen receptor ,AR)促进碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、血管内皮生长因子(vascularendothelial growth factor,VEGF)和表皮细胞生长因子(epidermal growth factor,EGF)的表达,从而使前列腺上皮细胞增殖[8],形成前列腺增生。所以睾丸是否正常也决定前列腺的正常发育与功能。
除了睾酮外,包括酒精摄入等多种因素可能影响睾丸的生理功能和前列腺的发育。一些研究表明,酒精会诱发机体的氧化应激,其可能使睾丸组织受损,对生精细胞造成杀伤,使精子数量和质量下降[9]。临床上,在BPH治疗期间饮酒会影响前列腺增生组织中睾酮的清除[10]。有调查研究发现[11],饮酒与良性前列腺增生的发病率呈正相关。这些研究提示饮酒对前列腺增生的发生和发展可能有促进的作用,同时还有可能对睾丸生精功能产生影响,然而目前酒精摄入对前列腺增生组织发展作用的研究还不多。
本研究通过皮下注射丙酸睾酮或同时酒精灌胃来诱导小鼠BPH,研究饮酒对小鼠前列腺增生的作用及睾丸的生理变化,并检测前列腺和睾丸中的脂质过氧化物及抗氧化酶的变化,为进一步研究前列腺增生的发病机制,以及饮酒对男性生殖健康的影响提供依据,并为前列腺增生病或生殖损伤的临床治疗提供依据。
1 材料与方法
1.1 实验动物
雄性昆明系小鼠70只,5~6周龄,SPF级,体重25±2 g,购于广东省动物实验中心,适应饲养1周后开始实验。小鼠按照国家实验动物饲养标准进行饲养,室温22~24℃,室内湿度40%~70%,光照时间为12 h/d。动物的饲养、实验处理、处死符合动物实验伦理学规范。
1.2 仪器及材料
紫外可见分光光度计(UV7500,上海天美科学仪器有限公司),酶标仪(Elx800,美国Bio Tek公司),光学显微镜(日本Nikon公司,EX200);丙酸睾酮注射液(25 g/L)购自宁波第二激素厂(批号110251054),白酒为市售的红星二锅头酒(乙醇含量50%),HE染色试剂盒(上海碧云天生物技术有限公司),其余试剂均为分析纯(广州化学试剂厂)。
1.3 动物分组及模型建立
70只实验小鼠随机分为空白对照组(CON,21 d无处理)、阴性对照组( NC, sc,大豆油25 mg/(kg·d),ig,蒸馏水7.5 ml/(kg·d),连续处理21 d)、酒精7 d和酒精21 d组(AL7和AL21,ig 50°白酒 7.5 ml/(kg·d),连续处理7 d和21 d),丙酸睾酮7 d和丙酸睾酮21 d组(TP7和TP21,sc,丙酸睾酮注射液 25 mg/(kg·d),连续处理7 d和21 d),丙酸睾酮+酒精7 d组(TP+AL7,sc 丙酸睾酮注射液 25 mg/(kg·d)、oral 50°食用白酒 7.5 ml/(kg·d),连续处理7 d)7组,每组10只。(预实验中用相同剂量的TP+AL共同连续处理21 d后,生殖检测的部分指标,如精子数量畸形率低于检测线,小鼠死亡率超过50%,故没有设置TP+AL21 d组)丙酸睾酮注射液用大豆油稀释的,所灌胃的酒精剂量根据2007年《中国居民膳食指南》的定义,相当于成人每日适度饮酒量的8倍,即为过度饮酒剂量。在末次给药24 h后,称重,脱颈处死小鼠,分离前列腺、睾丸组织称其湿重,计算前列腺和睾丸脏器系数(脏器指数=脏器湿重mg /小鼠体重g),并将前列腺组织置于Bouins固定液中。
1.4 前列腺组织光镜标本制备
处死小鼠取前列腺,Bouins固定液固定24 h后,经梯度酒精脱水,二甲苯透明,浸蜡包埋。切片厚度5 mm,HE染色并中性树胶封片。在100倍光学显微镜下观察并拍照记录。
1.5 精子数量检测
各组小鼠在末次给药24 h后,采用脱颈处死,迅速用75%酒精进行体表消毒,小心分离两侧附睾尾,放置在盛有1 ml HTF的35 mm培养皿中,于解剖镜下用细针扎破附睾尾中的曲细精管,将精子挤压流出,用3层擦镜纸过滤,制备成精子混悬液。将盛有精子悬液的培养皿放入37℃、5%CO2培养箱中孵育5 min,取7 ml精子悬液加入在血球计数板上在倒置显微镜下观察(20×物镜)并进行精子计数。
1.6 精子畸形率检测
将80 μl所制备的精子混悬液加入EP管中,再加入20l 1%伊红溶液充分混匀。静置染色15 min左右,取染色的精子悬液50 μl于洁净载玻片上均匀推片,自然干燥后,中性树胶封片:于光学显微镜下(40×物镜)随机观察200个着色精子的形态,计算200个精子中畸形精子:头部无钩、香蕉头、胖头、尾折叠及双尾的百分比。
1.7 各组小鼠前列腺及睾丸SOD、GPx活性和MDA含量检测
前列腺与睾丸在预冷的生理盐水中漂洗后,用滤纸吸干多余水分,分别称重。将前列腺或睾丸放入预冷的玻璃匀浆器中,然后加入9倍体积预冷的生理盐水,冰上研磨,制备组织匀浆。充分研磨后,将组织匀浆转移到离心管中,于4℃冷冻离心机中 4 000 r/min离心10 min,取上清,即得10%组织匀浆,根据不同实验的需求,可再稀释成5%和1%的组织匀浆,用于SOD、GSH-Px活性和MDA含量检测。
1.7.1 超氧化物歧化酶(SOD) 采用SOD检测试剂盒(NO.19160,Sigma-Aldrich,Japan)进行SOD活性检测,操作方法按照试剂盒说明书进行。
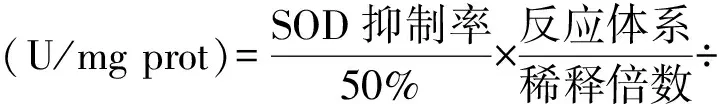
1.7.2 谷胱甘肽过氧化物酶(GSH-Px) GSH-Px可催化以GSH(谷胱甘肽)为还原剂的过氧化物还原反应,而GSH可与5,5’-二硫代双(2-硝基苯甲酸)(DTNB)反应生成黄色的5-硫代,2-硝基苯甲酸阴离子,通过计算该离子的浓度即可计算出GSH的减少量,接着求得GSH-Px活力。实验步骤依照文献方法进行[12]。
1.7.3 丙二醛(MDA)含量测定 过氧化脂质降解产物中的MDA在高温下可与硫代巴比妥酸(TBA)反应生成粉红色物质,该物质在532 nm处有最大吸收峰,可用分光光度法进行定量检测。依据文献方法进行实验[12]。
1.8 统计学处理
2 结果
2.1 各组小鼠前列腺及睾丸脏器系数比较
酒精处理7 d或21 d后,小鼠的前列腺系数与阴性对照相比没有显著差异(P>0.05),同样TP 7 d处理的小鼠前列腺系数也无显著性差异(P>0.05),而21 d TP处理后,发生典型的BPH、前列腺系数显著增高(P<0.05)。AL7/21 d组虽然没有引起前列腺增生,但是其睾丸系数与阴性对照组相比分别降低了10%和24%(P<0.05);TP7 d组的睾丸系数与阴性对照组相比降低了4%(P>0.05),而TP21处理21 d后睾丸系数降低了23%(P<0.05),说明TP或AL处理都会对睾丸造成一定程度的损伤且存在时间依赖性。与阴性对照组、TP7 d组和AL7 d组相比,21 d TP处理后,不仅小鼠的前列腺系数明显增高,其睾丸系数也明显降低(P<0.05),而TP+AL共同处理7 d的小鼠前列腺系数可达到TP处理21 d所致的前列腺增生状态(表1),酒精灌胃处理可以明显促进前列腺增生的发生和进程,并对睾丸造成一定程度的损伤。

Tab. 1 Mice prostate and testis n=10)
CON: Control; NC: Negative control; TP7 and TP21: Testosterone propionate for 7 and 21 days; AL7 and AL21: Alcohol for 7 and 21 days; TP+AL7: Testosterone propionate+alcohol for 7 days
*P<0.05vsnegative control group;#P<0.05vsTP7 group;▲P<0.05vsTP21 group;△P<0.05vsAL7 group;●P<0.05vsAL21 group
2.2 不同处理方式对小鼠前列腺组织病理学改变的影响
阴性对照组小鼠前列腺上皮大多以单层立方或柱状细胞构成,腺腔规则,大小比较一致,腔内有少量的酸性分泌物(图1A)。本实验中TP7 d组、AL7/21 d组小鼠的前列腺病理状况与空白对照组小鼠的没有明显变化,其前列腺增生病理特征不明显,表明单独TP处理7 d,或AL处理7/21 d不能建立小鼠BPH模型。而TP处理21 d后,可以看到前列腺腔上皮细胞表现出明显的结节状增生,锯齿样扩张明显,大部分腺体乳头向腔内突出,腺上皮部分呈高柱状(图1,F),同样TP+AL7d组前列腺增生病理变化也达到TP处理21 d相似的良性前列腺增生状态,TP+AL共同处理建立前列腺增生模型耗时较短、前列腺增生典型,此建模方法成功可靠。
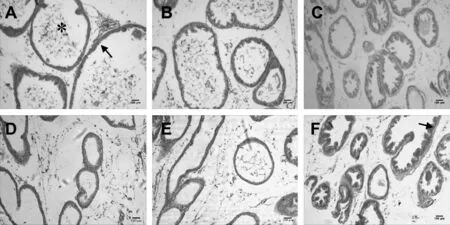
Fig.1HE staining of different modeling methods of BPH mouse prostate tissue pathological analysis (×100, bar=100 μm)
A: NC(Negative control); B: TP7(Testosterone propionate for 7 days); C: TP21(Testosterone propionate for 21 days); D: AL7(Alcohol for 7 days); E: AL21(Alcohol for 21 days); F: TP+AL7(Testosterone propionate+alcohol for 7 days); * : Acid secretion;↑: Glandular epithelial cells
2.3 各组小鼠精子数量、畸形率检测
精子数量和畸形率是评价男性生育力的两个重要参数。TP7/21 d组小鼠的精子数量较阴性对照组有所降低(P<0.05),而其精子畸形率却没有显著性差异,即其处理不会对精子质量造成明显影响。AL7 d组小鼠精子数量较TP7 d组的低,并且精子畸形率比TP7 d组明显高(P<0.05),同时,AL21 d组小鼠精子数量比TP21 d组的低,精子畸形率也要比TP21 d组的高(P<0.05),表明AL的处理比TP处理对精子数量和畸形率的影响更严重。TP+AL7 d后不仅精子数量低于其他各组(P<0.05),精子畸形率除与AL21 d组小鼠相近外,也都明显高于其它组小鼠(P<0.05, 表2),表明TP+AL共同处理7 d也对精子数量和质量都有显著的损伤作用。

GroupSperm count(×107/ml)Sperm abnormality(%)CON 1.105±0.0764.2±0.1NC1.060±0.0815.0±0.3TP7 0.870±0.056∗5.6±1.3TP210.550±0.032∗#5.4±1.1AL70.670±0.032∗#14.0±1.3∗#▲AL210.360±0.022∗#▲△24.0±1.5∗#▲△TP+AL70.240±0.083∗#▲△●22.0±2.1∗#▲△
*P<0.05vsnegative control group;#P<0.05vsTP7 group;▲P<0.05vsTP21 group;△P<0.05vsAL7 group;●P<0.05vsAL21 group
2.4 各组小鼠睾丸及前列腺MDA、SOD、GPx含量的检测
经过不同的处理方式和不同处理时间,AL7 d组小鼠睾丸和前列腺的MDA含量比TP7 d组高,其SOD和GPx含量却明显低于TP7 d组(P<0.05)。随着酒精处理时间延长,AL21 d组的氧化损伤程度较AL7 d组更加严重,即处理相同时间酒精造成的氧化损伤要比TP更明显。TP7 d组的睾丸和前列腺MDA含量比TP21 d组的低,其SOD和GPx含量比TP21 d组低(P<0.05),AL7 d组和AL21组相比也有相似的结果,说明随着处理时间增加单独使用TP或AL造成的氧化损伤程度也明显加重。然而,TP+AL7 d组与TP7/21 d组和AL7/21 d组相比,其睾丸及前列腺增生组织的MDA增高(P<0.05),同时,SOD和GPx含量降低(P<0.05),说明前列腺增生的加重和睾丸精子损伤与酒精摄入后机体ROS升高,造成氧化应激有关(表3、4)。

GroupMDA(nmol/mg pro)SOD(U/mg pro)GPx(U/mg pro)CON1.23±0.1144.8±3.90.022±0.004NC1.28±0.2143.1±4.10.020±0.007TP72.03±0.30∗39.5±1.4∗0.015±0.002∗TP212.83±0.35∗#35.4±2.0∗#0.011±0.006∗#AL72.40±0.41∗34.5±2.1∗#0.012±0.004∗AL213.18±0.70∗#30.5±3.6∗#△0.008±0.003∗TP+AL74.51±0.53∗#▲△●25.0±1.0∗#▲△●0.005±0.002#▲△●
*P<0.05vsnegative control group;#P<0.05vsTP7 group;▲P<0.05vsTP21 group;△P<0.05vsAL7 group;●P<0.05vsAL21 group

GroupMDA(nmol/mg pro)SOD(U/mg pro)GPx(U/mg pro)CON1.41±0.1438.5±2.70.19±0.02NC1.42±0.1236.9±3.30.21±0.03TP72.13±0.61∗32.6±5.1∗0.17±0.02∗TP212.72±0.82∗#27.5±2.0∗#0.12±0.01∗#AL72.90±0.50∗#26.0±2.1∗#0.15±0.05∗AL213.79±0.18∗△23.0±1.5∗△0.04±0.07∗△TP+AL75.10±1.02∗#▲△●21.0±3.2∗#▲△●0.02±0.00∗#▲△●
*P<0.05vsnegative control group;#P<0.05vsTP7 group;▲P<0.05vsTP21 group;△P<0.05vsAL7 group;●P<0.05vsAL21 group
3 讨论
前列腺是生殖系统重要组成器官,其分泌液是精液的主要成分,对正常的生殖功能必不可少。前列腺增生是男性退行性疾病,在中年男性中,年龄与发病率呈正相关。雄性激素变化与前列腺增生(BPH)密切相关,其增生不但影响排尿、射精,前列腺病理性增生,对睾丸中精子发生与质量的影响也不容忽视,其可直接影响前列腺增生患者的生殖功能和生育力。前列腺增生病已成为现代社会中的一种常见病,并有很多前列腺增生潜在病患在日常生活中存在饮酒或酗酒的情况。酒精对生殖系统中睾丸的损伤已被证实,而目前酒精对BPH发生及生殖功能损伤的作用研究还很少。故本研究以TP与AL联合建模,探讨AL对TP建立的BPH模型小鼠前列腺增生和睾丸的影响。
构建BPH动物模型是研究BPH的发生、发展和防治必不可少的手段。现有的建立BPH模型的方式是在啮齿动物皮下注射丙酸睾酮来诱发前列腺增生,处理3~4周达到良性前列腺增生状态[12]。然而在本研究中发现,AL单独处理或TP 7 d短期处理都不能造成明显的前列腺组织增生,而TP与AL共同处理7 d即可发生典型的BPH,与TP单独处理所引发的前列腺增生模型小鼠相比,TP+AL7 d组的精子质量和组织抗氧化能力显著下降,提示雄激素紊乱引发的良性前列腺增生对雄性睾丸功能的影响不显著,同时也说明AL对TP引起的小鼠前列腺增生有明显的促进作用,这与饮酒会降低睾丸生殖生理功能也有一定的联系,加速雄激素在机体内的紊乱,在实验中也显示AL降低前列腺增生模型小鼠的精子质量和功能。
实验发现AL和TP单独处理小鼠都能对前列腺和睾丸造成氧化应激损伤,这些氧化应激与前列腺增生和精子功能损伤存在一些关联。已有研究报导,前列腺中睾酮或双氢睾酮的过度积累会造成氧化应激反应,其能诱导亚胺/精胺N1-乙酰转移酶的过表达,其中精胺N1-乙酰转移酶是多胺代谢途径中的限速酶,多胺氧化的过程中产生的H2O2可能是前列腺上皮细胞中高ROS水平及氧化应激反应的主要原因[13,14],同时酒精在人体中代谢成乙醛的过程中也会产生过多的ROS[15],ROS会与多不饱和脂肪酸反应产生脂质过氧化物MDA,因此MDA 的含量反映机体氧化应激损伤的程度,SOD和GPx是细胞内清除超氧产物的关键还原酶[16],而机体氧化应激的增强会破坏这一平衡,造成MDA的不断累积,对细胞造成损害。本研究中,TP7 d组小鼠的精子数量与质量、前列腺及睾丸组织的脏器系数及前列腺病理学观察与正常组相比均没有显著变化,但是可以从抗氧化能力的变化看出,其组织内细胞已经发生氧化应激,这就说明单独使用TP建立的小鼠BPH模型,时间因素很重要,短期内还不能表现出病理状态,然而灌胃AL却起到了促进作用,使模型在短期内完成,从表3和表4中各项氧化应激指标可以看出,其原因是AL加剧前列腺和睾丸组织的氧化应激,促使组织的病理结构发生明显变化。有研究表明,ROS的增加可能会导致前列腺组织细胞中DNA突变,引起细胞的恶性转化,即癌细胞[17,18],因此AL在BPH病患体内产生的ROS会加剧前列腺的增生并对睾丸造成损伤。本研究提示,饮酒会破坏良性前列腺增生小鼠的睾丸生理功能,导致性腺轴的调控紊乱,并且加剧机体的氧化应激反应,促进BPH发展,提示过量摄入酒精会增加患前列腺癌的风险,但其发生机制还有待进一步研究。
