茶多酚对慢性酒精中毒大鼠肝损伤的保护作用*
2018-03-13李苗苗华田苗孙庆艳
张 勇, 李苗苗, 华田苗, 孙庆艳
(安徽师范大学生命科学学院, 芜湖 241000)
肝脏是一种重要的器官,参与调节机体的糖代谢、蛋白质代谢和脂肪代谢,其损伤会对机体产生严重的影响。酒精滥用会改变自身免疫调节并导致免疫缺陷,长期大量饮酒会引起全身各脏器的代谢和功能异常,更可能引起一系列的肝损伤,其中包括肝脏脂肪变性、肝纤维化、肝硬化和再生功能减弱等一系列的酒精性肝病(alcoholic liver disease, ALD)[1, 2]。茶多酚是一种复合物,具有多种有益的作用。有研究发现茶多酚对大鼠酒精性肝病有抗氧化与抗纤维化的作用[3],但是关于茶多酚对慢性酒精中毒肝损伤的具体保护机制尚不明确。本研究建立了慢性酒精诱导的成年大鼠肝损伤动物模型,并进行茶多酚的干预,以脂体比衡量内脏脂肪含量,以肝指数和油红O染色结果衡量肝脏的脂质沉积,以超氧化物歧化酶 (superoxide dismutase, SOD)活力与丙二醛(malondialdehyde, MDA)含量的比值、总抗氧化能力(total antioxidant capacity assay, T-AOC)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)活力等氧化应激指标来衡量肝脏的氧化应激状态,检测大鼠肝组织中脂肪酸转位酶(fatty acid translocase, FAT/CD36)蛋白表达情况,观察茶多酚的干预对慢性酒精诱导的肝损伤大鼠的防护作用及其可能的机制。
1 材料与方法
1.1 实验动物
清洁级健康7周龄 SD 雄性大鼠36 只,体重180~220 g,由浙江省实验动物中心提供[scxk[浙]2014-0001]。动物自由进食饮水,环境相对湿度(55.4±3.0)%,温度(24±2)C,明暗周期12 h:12 h。
1.2 慢性酒精中毒大鼠模型的建立及茶多酚干预
适应性饲养一周后,将大鼠随机分为对照组(Control, CON)、酒精损伤组(Ethanol, ETH)和茶多酚干预组(Tea polyphenols intervention, TPI),每组 12 只,分笼饲养,均在相同环境下自由摄食和饮水。对照组用0.9%生理盐水按 7 g/kg 灌胃;酒精组用体积分数56%的红星牌酒精(北京红星)同剂量灌胃;茶多酚组在酒精灌胃同时按照0.25 g/kg剂量灌胃给予茶多酚(上海伊卡)[4]。每天上午 9:00定时进行灌胃,1 次/天,持续 8 周。
1.3 样本采集
实验结束后,所有动物禁食12 h, 保持自由饮水。大鼠称重后,以10%的水合氯醛按0.3 ml/100 g剂量麻醉大鼠,每组随机选取5只,直接打开腹腔,取肾周脂肪垫和附睾脂肪垫,称脂肪湿重,将两者重量之和作为内脏脂肪重量,并计算肾周脂肪和附睾脂肪重量占体重的百分比即脂体比。取肝脏,称肝脏湿重,计算肝脏重量占体重的百分比即肝指数。将肝脏液氮速冻, -80℃存储备用。
每组其它剩余大鼠(CON,n=7; ETH,n=5; TPI,n=6)打开胸腔,找到心脏,剪开心包膜,剪开左心室,将灌流针插入至主动脉,用止血钳结扎住剪开口,打开生理盐水灌注,剪开右心耳,灌注8 min,至肝脏发白后灌注 4% 多聚甲醛进行预固定,灌注至大鼠身体僵硬后取肝脏,并移入 4% 多聚甲醛固定液中固定至组织沉底,4℃储存待制作组织切片。
1.4 指标检测
取固定肝脏组织做冰冻切片,进行油红O染色。染色后的切片在OlympusBX-51显微镜下观察,用Image-Pro Express6.0图像分析软件进行图像采集,对油红O染色的肝脏脂质沉积进行积分光密度分析。取大鼠肝脏组织制备匀浆液,测定蛋白质含量,采用超氧化物歧化酶 (superoxide dismutase, SOD),丙二醛(malondialdehyde, MDA),总抗氧化能力(total antioxidant capacity assay, T-AOC)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)试剂盒(南京建成)分别测定肝脏中SOD活力,MDA含量,T-AOC能力和GSH-Px活力;采用FAT/CD39免疫组化试剂盒(北京博奥森)和ELISA试剂盒(武汉博士德)对FAT/CD36在肝组织中表达情况进行定位和定量检测。
1.5 统计学处理
2 结果
2.1 动物一般状况
8 周的干预结束后,酒精组死亡 2 只,茶多酚组死亡 1 只,对照组全部存活。死亡大鼠解剖结果显示肺出血,气管分泌物增多,分析主要原因由于灌胃时酒精误呛入肺导致。其它存活大鼠每天灌胃结束后观察活动状态和生命特征,发现对照组大鼠灌胃后活动能力良好,意识清楚,正常摄食,酒精组和茶多酚组大鼠每次灌胃后逐渐昏迷,呈昏睡状态,摄食和运动减少。2 h持续观察发现,酒精组和茶多酚组大鼠逐渐恢复正常活动和摄食,并且茶多酚组大鼠恢复清醒时间较酒精组短。
2.2 茶多酚干预后大鼠体重,脂体比,大鼠肝指数和脂质沉积变化
8 周喂养后,三组大鼠体重差异无统计学意义。酒精组脂体比显著低于对照组(P<0.05),茶多酚组脂体比显著高于酒精组(P<0.05, 表1)。
酒精组肝指数显著高于对照组(P<0.01),茶多酚组肝指数显著低于酒精组(P<0.01)。肝脏油红O染色结果可见,肝脏细胞的细胞核被染成蓝紫色,肝脏细胞中的脂滴被染成红色。对照组肝脏细胞染色浅淡,酒精组与对照组相比,肝细胞内含大量染成红色的脂滴沉积。茶多酚组与酒精组相比,肝细胞内脂滴沉积减少 (图1,表1)。
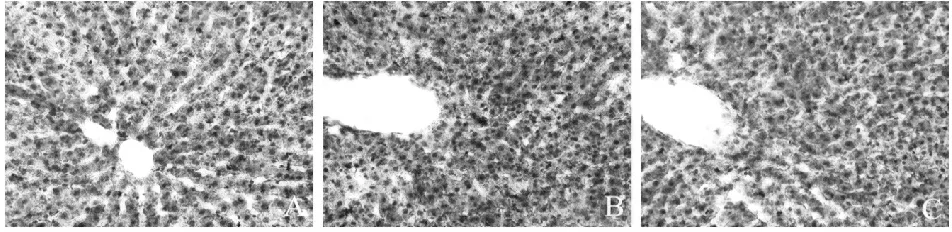
Fig.1Results of Oil Red O staining (×400)
A: Control group; B: Ethanol group; C: Tea polyphenols intervention group

Tab. 1 Effects of tea polyphenols intervention(TPI)on body weight, visceral fat weight/body weight ratio, liver index, hepatic lipid deposition and FAT/C36
*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsethanol group
2.3 茶多酚干预后大鼠肝脏中SOD/MDA、T-AOC和GSH-Px活性变化
酒精组中SOD/MDA、T-AOC和GSH-Px活性均显著低于对照组(P<0.01)。茶多酚组SOD/MDA显著高于酒精组(P<0.01)。茶多酚组T-AOC和GSH-Px活性显著高于酒精组(P<0.05,表2)。

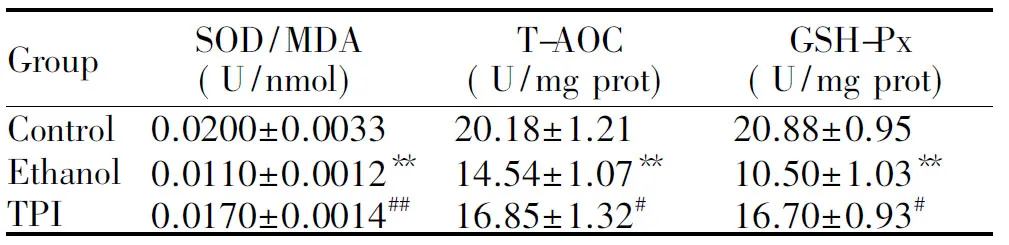
GroupSOD/MDA(U/nmol)T-AOC(U/mg prot)GSH-Px(U/mg prot)Control0.0200±0.003320.18±1.2120.88±0.95Ethanol0.0110±0.0012∗∗ 14.54±1.07∗∗10.50±1.03∗∗TPI0.0170±0.0014##16.85±1.32#16.70±0.93#
**P<0.01vscontrol group;#P<0.05,##P<0.01vsethanol group
2.4 茶多酚干预后大鼠肝脏中FAT/CD36免疫组织化学染色及ELISA分析结果
免疫组织化学染色结果可见,三组肝脏切片中均有FAT/CD36免疫阳性细胞分布,免疫阳性物质集中在细胞膜上,呈棕黄色或者棕褐色。酒精组FAT/CD36免疫阳性细胞积分光密度显著高于对照组(P<0.01),茶多酚干预组显著低于酒精组(P<0.05,图2,表1)。
ELISA测定结果显示酒精组大鼠肝脏中FAT/CD36蛋白水平显著高于对照组(P<0.01),茶多酚组显著低于酒精组(P<0.01,图3)。
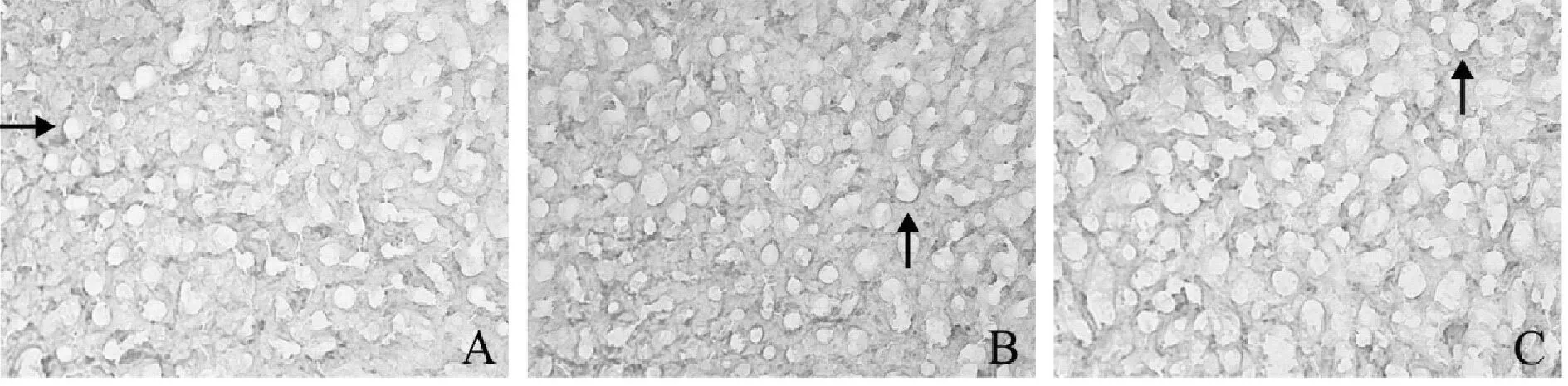
Fig.2The results of FAT/CD36 immunohistochemistry
A: Control group; B: Ethanol group; C: Tea polyphenols intervention group;: Fos-like immunoreactivity


**P<0.01vscontrol group;##P<0.01vsethanol group
3 讨论
肝脏作为机体以代谢功能为主的重要器官,在机体内起到去氧化,储存肝糖原和分泌蛋白等主要作用。已有研究发现长期大量摄入酒精会导致机体内氧化-抗氧化系统失衡,氧自由基增加,肝脏脂质异常积累,从而引起肝细胞损伤,肝细胞坏死,肝硬化等一系列病理反应[5]。研究表明,茶多酚是一种多组分复合物,能够清除机体氧自由基[6],对大鼠酒精性肝病有抗纤维化的作用[7, 8]。
动物和临床研究发现酒精摄入会减少啮齿动物的内脏脂肪含量,同时也会提高肝脏摄入的脂肪量[9-11],表明白色脂肪组织(white adipose tissue, WAT)脂质的稳态在肝脏脂质沉积中起重要作用[12]。当白色脂肪组织的脂质贮存出现紊乱,会导致过多的游离脂肪酸流入肝脏,引起肝脏脂质沉积。本研究结果发现 8 周的茶多酚干预结束时,酒精组脂体比显著小于对照组,茶多酚干预组显著高于酒精组;酒精组肝指数显著大于对照组,茶多酚干预组显著低于酒精组,同时油红 O 染色结果显示酒精组肝脏细胞中脂滴较对照组增加,茶多酚干预组较酒精组减少。这些结果说明 8 周的酒精摄入引起大鼠内脏脂肪减少,肝脏脂质沉积增加,这与过去的研究一致,而茶多酚干预引起内脏脂肪含量增加,同时伴随着肝脏脂质沉积减少。这可能是由于茶多酚干预减弱脂肪组织中脂肪水解酶对脂肪的分解作用,从而减少流入肝脏的脂肪酸。
FAT/CD36是一种跨膜糖蛋白,在体内分布广泛,能够参与脂质的代谢,是肝脏摄取游离脂肪酸的重要转运体[13, 14]。过去的研究发现,减弱 FAT/CD36 介导的脂肪酸摄取,将可以避免肝细胞脂毒性的发生[15]。通过药理学手段或 cDNA 转导技术诱导肝脏 FAT/CD36 的过量表达,将会引起脂肪肝的发生,进一步会导致机体出现代谢紊乱[16]。Zhong W 等发现 8 周的酒精摄入会引起小鼠肝脏中甘油三酯和胆固醇积累增加,并检测到 FAT/CD36 在 mRNA 和蛋白水平表达的增加[17]。本研究通过免疫组织化学和酶联免疫吸附试验发现酒精组大鼠肝脏 FAT/CD36 蛋白表达量显著大于对照组,茶多酚干预组显著小于酒精组。说明 8 周的茶多酚干预能引起肝细胞膜上 FAT/CD36 蛋白表达量减少,从而减少肝脏对游离脂肪酸的摄入量。
发生肝脏脂质沉积时,大量脂滴占据细胞质的空间,将会影响肝细胞的正常功能,使其容易受到毒性物质和应激因素的作用。超氧化物歧化酶(SOD)是一种在生物体内广泛表达的活性物质,能够清除机体氧自由基,组织内丙二醛(MDA)含量直接反应脂质过氧化的速率和强度。总抗氧化能力(T-AOC)是整体衡量机体抗氧化能力的指标。谷胱甘肽过氧化物酶(GHS-Px)是一种重要的分解过氧化物的催化酶。本研究以 SOD/MDA、T-AOC 和 GSH-Px 来较全面地衡量机体的氧化应激状态。本研究发现 8 周的酒精摄入使酒精组肝脏中 SOD/MDA、T-AOC 和 GSH-Px活性均显著小于对照组,说明酒精使大鼠肝脏出现氧化应激状态,这一结果与过去的研究发现一致[18]。茶多酚干预使大鼠肝脏 SOD/MDA,T-AOC 和 GSH-Px 活性显著大于酒精组,说明茶多酚干预能够缓解酒精摄入引起的大鼠肝脏中的氧化应激状态。
综上所述,茶多酚干预能够减少慢性酒精中毒大鼠内脏脂肪的分解,从而减少随血液循环系统流向肝脏的脂肪酸,同时肝细胞膜上负责脂肪酸摄入的 FAT/CD36 含量降低,减少肝细胞对脂肪酸的摄取,从而减少脂质在肝脏的积累。同时,茶多酚干预还能够缓解肝脏的氧化应激状态,从而减轻肝损伤。
肝细胞除了通过 FAT/CD36 摄取游离脂肪酸以外,还可以通过脂肪酸转运蛋白-1 (fatty acid transport protein-1, FATP-1)和肝脏脂肪酸结合蛋白 (fatty acid binding protein, L-FABP) 等转运体来进行游离脂肪酸的摄取[19]。茶多酚对 FAT/CD36的表达有干预效应,是否对 FATP-1 和 L-FABP 同样具有干预效应有待进一步研究。
