383例参麦注射液医院集中监测临床应用分析
2018-03-13张云玲阚晓宏贺思勋洪健程秀琴史清明
张云玲,阚晓宏,贺思勋,洪健,程秀琴,史清明
(安徽省胸科医院a.药剂科,b.科教科,c.肿瘤科,安徽 合肥 230022)
医院集中监测是指在一定时间内、范围内对某一医院、地区所发生的药物不良反应(ADR)及药品使用情况进行详细记录,以探讨ADR的发生规律。此方法不干预临床用药,真实反映临床用药情况,资料详尽、准确可靠,根据收集到的临床资料可准确计算ADR发生率并探讨其发生机制,是我国开展中药注射剂安全性评价中主动监测的主要模式[1-3]。参麦注射液具有益气固脱、养阴生津、生脉等功能,临床上主要用于治疗气阴两虚型之休克、冠心病、病毒性心肌炎、慢性肺心病、粒细胞减少症;同时能提高肿瘤患者的免疫机能,与化疗药物合用时,有一定的增效作用,并能减少化疗药物所引起的毒副反应[4],临床应用广泛。然而,伴随着中药注射剂安全事故频频发生[5],参麦注射液的安全性问题也受到了重视,国家食品药品监督管理局(SFDA)自2009年以来发布了一系列文件,并全面启动中药注射剂安全性再评价工作。安徽省胸科医院于2013年参与参麦注射液上市后临床安全性医院集中监测试验的研究,主动监测院内使用参麦注射液患者的用药信息和ADR发生情况,综合评价参麦注射液的安全性,为临床规范、合理用药提供参考。
1 资料与方法
1.1 研究对象 选取2013年7月—2014年12月安徽省胸科医院所有使用参麦注射液(正大青春宝药业有限公司)的住院患者为研究对象,共计383例。
1.2 方法
1.2.1 确定调查员和调查科室 使用参麦注射液患者的主管医师为调查员,所有使用参麦注射液的科室为调查科室,要求各病区护师在患者用药过程中加强巡视,协助医师填写监测表。并确定一名临床药师为此研究的临床协调员,负责监测研究的质量。
1.2.2 院内培训 由临床协调员对药学人员和调查科室的医生、护士和进行统一的院内监测方案培训。内容包括:监测方案、ADR/不良事件判断及处理、质量控制措施和监测表的填写方法等。
1.2.3 调查流程 医生确认入选患者,使用参麦注射液并填写“患者一般信息表”(A表),经医生和护士的观察,判断ADR的发生情况。若未发生ADR,此观察完成;若有ADR发生,则加填“药品ADR信息表”(B表)。
1.2.4 监测指标 采集383例患者参麦注射液的使用情况,填写监测表。A表内容包括患者人口学信息、中西医疾病诊断信息以及用药信息,药物的用法用量、溶媒的选用、使用参麦注射液具体操作、用药期间是否与其他药物联合使用等。B表内容包括患者的ADR相关信息,包括ADR表现、发生过程、处理及结果等。
1.2.5 ADR的监测方法 从首次用药起开始监测,直至患者静滴结束后密切观察30 min,监测有无ADR发生,30 min 后采取医护人员定期检查或由患者主动汇报的方法观察,加以记录。如出现严重ADR立即上报ADR监测中心。
1.3 伦理学问题 医院集中监测是一项临床观察性研究,不干预临床医师对患者的诊断及用药情况,医师根据所患疾病的病情制定诊疗方案,并对患者的隐私进行保密,本研究获医院伦理委员会批准。
2 结果
2.1 一般资料分析 2013年7月—2014年12月使用参麦注射液的住院患者共计有383例,其中男性248例,女性135例;年龄19~96岁,其中60岁以上的患者居多,占72.32%,70岁以上的患者占44.91%,患者的年龄与性别详细分布见表1。
2.2 科室分布情况 383例使用参麦注射剂的患者科室分布情况见表2。
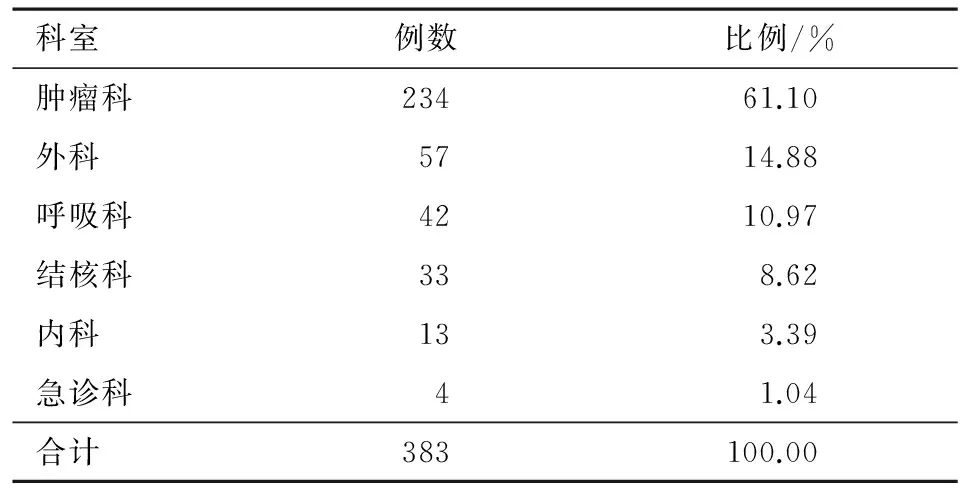
表2 各科室参麦注射液用药频数及分布情况
2.3 疾病诊断分布情况 本研究对使用参麦注射液患者的诊断进行分析,结果见表3,与说明书不相符的适应证占比8.18%。
注:患者并发多种疾病重复统计。
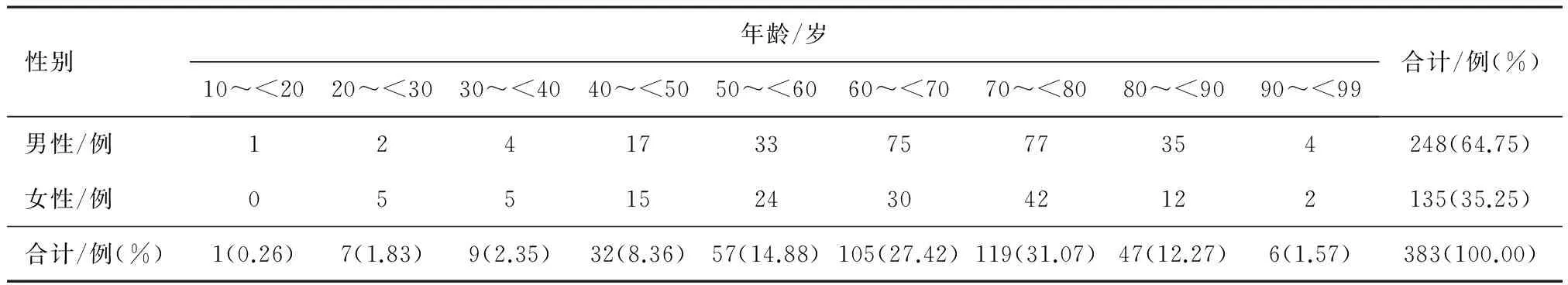
表1 参麦注射液患者的年龄与性别分布情况
2.4 具体用药情况 本研究所用的参麦注射液规格为每瓶50 mL。383例患者中有4例患者单次剂量为100 mL,其余患者单次剂量均为50 mL。溶媒有5%葡萄糖(GS)、0.9%生理盐水(NS),也有50 mL参麦注射液直接静脉滴注,溶媒及溶媒剂量的使用情况见表4。疗程最长的为48 d,最短为1 d;其中<7 d的有159例(41.51%),7~14 d的有142例(37.08%),>14 d的有82例(21.41%)。
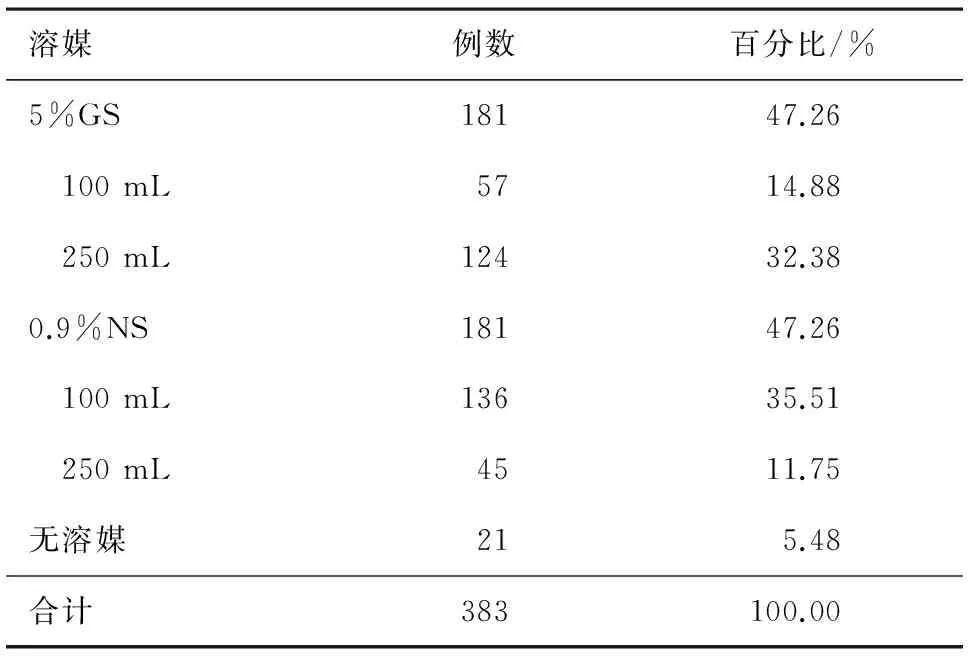
表4 参麦注射液的溶媒及其剂量选用及分布情况
2.5 配伍用药、合并用药以及辅助措施情况 本研究 383例患者均无配伍用药。2.35%(9/383)患者无合并用药(合并用药指静滴参麦注射液前后2 h内使用的其它用药),97.65%(374/383)合并用药,其中87.17%(326/374)有冲管措施,12.83%(48/374)未有冲管记录。
2.6 ADR观察结果及具体表现 本研究有2例(0.52%)发生ADR,无新/严重ADR发生。ADR的具体情况为:A患者,女,60岁,原发疾病为肿瘤,否认药物过敏史,使用参麦注射液(正大青春宝药业有限公司,批号1304308)50 mL直接静脉滴注,静滴3 min后出现呼吸困难症状,立即停药,给予加强龙40 mg静推、地塞米松5 mg静推,并予以吸氧,后症状缓解,其不良反应关联性评价为“可能”;B患者,男,60岁,原发疾病为支气管扩张伴感染,合并房间隔缺损,否认药物过敏史,使用参麦注射液(正大青春宝药业有限公司,批号1306208)50 mL加入100 mL的5%GS溶媒中静滴,静滴结束2 h后患者诉头晕、胸闷伴恶心呕吐,给予泮托拉唑40 mg静脉滴注,后好转,第2天再次使用参麦2 h后又发生类似症状,考虑参麦注射液ADR,其不良反应关联性评价为“肯定”。
3 讨论
3.1 参麦注射液ADR发生率 医院集中监测可以在真实事件情况下了解临床用药,并在此基础上监测药物的安全性[6]。本研究监测的383例使用参麦注射液的患者中有2例发生ADR,发生率为0.52%,为偶见ADR;2例ADR的表现与说明书均相符,未有新/严重的ADR发生;表明参麦注射液在我院临床使用期间,安全性相对较高,与鲁薇等[7-8]报道基本相同,但是较其安全性监测大数据相比,ADR发生率相对较高[6]。影响参麦注射液安全性的因素是多方面的,包括药品质量、患者的个体化因素以及药物不合理使用等[9-10]。
3.2 药物因素与参麦注射液ADR的发生 参麦注射液是由红参、麦冬经现代化科技手段加工提炼精制而成的中药复方注射剂,有效成分为人参皂苷和麦冬皂苷,对人体的作用表现为多环节、多层次、多通道、多靶点、多效应的整体作用。然而由于制药工艺的限制,酶、蛋白质等大分子物质的彻底提取非常困难,导致注射液成分复杂,易引发变态反应[11]。
3.3 患者个体因素与参麦注射液ADR的发生 不同个体,在种族、性别、年龄、生理病理状态,尤其在遗传、新陈代谢、酶系统等方面存在着差异,对药物的敏感性也是不同的。婴幼儿、老年人是ADR的易发人群,本研究使用参麦注射液的患者中,72.32%的患者为60岁以上老人,且2例ADR患者的年龄都是60岁,与大多数文献报道相似[12-13]。
3.4 不合理用药与参麦注射液ADR的发生 不合理用药是导致ADR 的重要原因之一[14-15],中药注射液上市后的临床用药过程中不合理用药的现象时有发生。参麦注射液不合理用药的表现主要有:用药指征不明确、违反禁忌证、疗程过长或过短、给药途径不适合、溶媒选择不当、操作不规范等[10]。本研究在用药剂量、药物浓度、配伍用药、给药途径等方面符合说明书要求,但是在适应证、溶媒选择、联合用药方面有待改进。
参麦注射液是中药注射液,属于中药范畴,临床使用必须遵循辨证施治的原则,而大多数西医师在临床诊治过程中做不到辨证施治,而是辨病用药,甚至有些医师简单的辨“症”用药,给患者的用药安全带来了一定的风险。本研究用药人群主要集中在肿瘤科、外科、呼吸科,疾病以肿瘤和慢性肺心病为主,与说明书的疾病相符,但是均无中医诊断,是否辨证施治病历中也未见记载;除此,仍有8.16%的患者疾病与参麦注射液适应证不相符,比如高血压、肺部感染、结核、直肠炎等,究其原因为:(1)少数医师根据个人经验或者文献推荐用于治疗某些说明书规定之外的疾病;(2)少数的医师和患者对参麦注射液等中药注射液存在误解,以为中药注射液药性平和,无毒副作用可以放心使用,这都给患者的临床用药带来了一定的安全风险,2例ADR患者的适应证是否合理值得深究。
参麦注射液成分复杂,文献报道其与泮托拉唑、帕米磷酸二钠、维生素C、痰热清注射液等药物配伍时不稳定,不溶性微粒增多,甚至有浑浊产生[16-17],不仅影响药物疗效,且易导致ADR。因此用药时应充分结合患者病情,严格按照药物说明书和《中药注射剂临床使用基本原则》[18]的规定,避免与其它药物配伍使用;与其它药物序贯使用时必须规范操作避免药物间的不良相互作用。研究中超过14 d用药的患者有21.41%,然而说明书关于用药疗程方面的资料并未加以注明,临床用药是否合适有待考究。
3.5 2例ADR的发生原因分析 2例ADR患者药物序贯使用其它药物时有冲管或更换输液器措施,溶媒使用合适,ADR表现与说明书相符,考虑其不良反应的发生可能与药物本身和患者个体因素等有关。本研究样本量相对较少,ADR发生例数少,ADR发生机制尚需进一步整合多中心医院的监测数据全面评价。
综上所述,参麦注射液ADR发生率低,临床用药相对安全,但仍需进一步采取干预措施,保证药品严格按说明书或《中药注射剂临床使用基本原则》[19]合理用药、规范临床操作、关注特殊人群,尽可能的避免或减少参麦注射液ADR的发生,保证中药注射剂的安全使用。此外,国家药监部门要深入开展ADR的监测工作,加强参麦注射液等中药注射剂的生产监管保证质量;制药企业也要增加科研投入,深入药物的相关研究,完善说明书,为临床规范使用中药注射剂提供理论依据;让中药注射剂更好的为人类健康服务,保证中药产业健康快速发展。
[1] 杨薇,谢雁鸣,王永炎.中医药临床实效研究——中药注射剂注册登记式医院集中监测方案解读[J].中国中药杂志,2012,37(18):2683-2685.
[2] 张庆丽,王忠,荆志伟,等.清开灵注射液上市后安全性医院集中监测5800例[J].中国药物警戒,2015,12(7):417-419,423.
[3] 姜俊杰,谢雁鸣,张寅,等.32546例疏血通注射液医院集中监测研究[J].中国中药杂志,2016,41(20):3852-3858.
[4] 国家药典委员会.中华人民共和国药典临床用药须知中药成方制剂卷(2010版)[M].北京:中国医药出版社,2011:469.
[5] 吴曼,马建丽.CFDA通报中药制剂不良反应及修订说明书的现状分析[J].中国药房,2015,26(5):648-650.
[6] 王连心,谢雁鸣,艾青华,等.参麦注射液上市后临床安全性主动监测与被动监测大数据综合评估[J].中国中药杂志,2015,40(24):4752-4756.
[7] 鲁薇,姜鹏,张少华.参麦注射液上市后安全性再评价[J].中国医院药学杂志,2013,33(6):491-492.
[8] 高宁,罗志琴,谢广茹,等.参麦注射液上市后安全性再评价研究[J].医药导报,2011,30(7):961-962.
[9] 潘飞,唐全红,和芳,等.参麦注射液安全性文献分析[J].中国医药导报,2011,8(6):106-108.
[10] 王连心,谢雁鸣.基于文献计量分析的参麦注射液临床安全性评估[J].中国中药杂志,2012,37(18):2779-2781.
[11] 崔宏玉,梁爱华.从中药注射剂质量标准分析其不良反应成因[J].中国中药杂志,2014,39(5):934-940.
[12] 李冬春.参麦注射液安全性评估及其相关影响因素的文献分析[J].广东医学院学报,2015,33(6):705-707.
[13] 王连心,谢雁鸣,艾青华,等.参麦注射液上市后再评价系列研究[J].世界中医药,2014,9(9):1137-1140,1144.
[14] 王志飞,赵维,张寅,等.基于大型前瞻性安全性监测的参附注射液不良反应影响因素分析[J].中国中药杂志,2015,40(24):4746-4751.
[15] 时琳,郭桂明.我院209例中药注射剂致不良反应回顾性分析[J].中国药房,2014,25(31):2949-2951.
[16] 李香玉,许丽.参麦注射液与韦迪存在配伍禁忌[J].山东医药,2010,50(25):46.
[17] 许建芬.注射用帕米膦酸二钠与参麦注射液存在配伍禁忌[J].中国实用护理杂志,2011,27(35):40.
[18] 卫生部,国家食品药品监督管理局,国家中医药管理局.中药注射剂临床使用基本原则[S].卫医政发[2008]71号,2008.
