自发荧光电子气管镜肺活检对孤立性肺结节的诊断价值
2018-03-11胡新春李昌波孙杰邓超英刘翱
胡新春 李昌波 孙杰 邓超英 刘翱
孤立性肺结节(solitary pulmonary nodule, SPN)是指肺组织中单一、边界清楚、影像不透明、结节直径≤30 mm、周围完全由含气肺组织所包绕,且无肺不张、肺门增大或胸腔积液等表现的肺部结节[1]。SPN在临床上较为常见,有研究发现正常人群普查发现孤立性肺结节的发病率为0.2%,发病率较高。目前相关文献报道SPN的恶性比率不尽相同,从5%~69%不等,也有文献报道,SPN大部分为良性病变,小部分为恶性肿瘤,其中以腺癌为主[2],恶性程度高,绝大部分为早期肿瘤。肺癌是目前全球范围内发病率及病死率最高的肿瘤性疾病[3]。早期肺癌手术切除后5年生存率可达70%;而晚期肺癌的5年生存率仅为2%[4]。因此肺癌的早期诊断、早期治疗对预后起着关键性作用。国内相关文献报道,SPN术后病检SPN位于肺组织深部,难以取得病理活检,是临床诊治的难题之一。SPN依靠影像学诊断准确性差,病检是确定SPN性质的金标准;CT引导下经皮SPN穿刺病检是目前临床运用最多的技术,但因费用高、创伤大、风险大、放射性损伤等因素限制了SPN的进一步诊断[5];经电子支气管镜非直视下肺活检(transbronchial lung biopsy, TBLB)对SPN的诊断具有费用低、创伤小、无放射性损伤等优势[6],但因阳性率低限制了TBLB在SPN诊断中的广泛运用。普通白光支气管镜(white Light bronchoscopy, WLB)不能发现支气管黏膜的早期病变及SPN的浸润定病变,降低了SPN的正确诊断率。自发性荧光支气管镜检查(autofluorescence bronchoscopy, AFB)是利用细胞自发性荧光和电脑图像分析技术开发的一种新型电子气管镜,可对支气管黏膜的早期病变诊断,对肿瘤病变具有特异性[7]。AFB的原理是利用肿瘤组织中还原性物质较多,组织增厚,且局部血管增生、血运丰富,使局部血红蛋白含量增多,使绿色荧光减弱或者缺失,表现为紫红色或者品红色,而正常支气管黏膜表现为绿色荧光,从而与正常支气管组织相鉴别[8]。本研究旨在探讨AFB联合TBLB等技术对SPN的诊断价值。
资料与方法
一、一般资料
收集我科自2012年1月至2015年12月住院患者中,胸部CT发现SPN,不愿行经皮肺穿刺检查的患者116例,其中男性85例,女性31例,年龄45~71岁,平均年龄(54.2±12.3)岁。SPN平均直径为(18.1±2.4)mm。所有检查对象均签署知情同意书。
二、实验仪器
奥林巴斯电子气管镜T290(自发荧光);一次性电子气管镜活检钳;西门子64排/128层螺旋CT;利多卡因注射液10 ml;注射用丁卡因100 mg;生理盐水200 ml;肾上腺素注射液2 ml。
三、实验方法
根据胸部CT定位SPN所在支气管亚段, 所有入组患者行电子气管镜检查前先评估患者生命体征、心电图、肺功能、凝血功能、输血前检查等。排除标准: ①有电子气管镜检查禁忌证(如麻醉药物过敏、心功能不全、严重衰竭、凝血功能障碍等);②新近肺部手术后患者;拒绝电子气管镜检查患者。所有入选患者于局部麻醉或者全麻下行电子气管检查。检查方法如下:依次检查健侧支气管,患侧健康各段支气管;最后再检查SPN所在段支气管,先行白光电子气管镜检查,于同一段支气管行自发荧光支气管镜检查。若段支气管内发现浸润性病灶行活检送病检及刷片;若段支气管内未发现浸润性病情,则行自发荧光支气管镜检查,区分相应支气管所发荧光颜色。于SPN病灶所在段支气管行盲目肺活检送检及相应支气管刷片。收集肺泡灌洗液查抗酸杆菌、细菌、真菌、肺泡支气管液痰培养。
镜下肉眼观察:白光电子气管镜下肉眼观查指标: ①新生物:在段支气管内可见新生物,管腔部分或者完全阻塞,伴新生物表面分泌物;②浸润:SPN相应段支气管镜下浸润灶,黏膜粗糙、隆起,管腔部分狭窄、出血或者分泌物;③间接:黏膜充血、水肿,散在出血点;④镜下分泌物增多;⑤黏膜呈纵行皱襞改变;⑥未见明显异常。白光电子气管镜可把①②③④⑤判断为白光电子气管镜肉眼阳性病变。WLB肉眼阳性行刷片及直视下活检。
荧光染色:自发荧光电子气管镜病变分级[10]:AFBⅠ级:正常支气管组织黏膜或者先天解剖异常黏膜组织呈绿色;AFBⅡ级:黏膜色泽轻度改变,呈粉红色或棕色;AFBⅢ级:支气管黏膜呈典型的品红色或者紫红色改变;将AFBⅡ、Ⅲ级定义为AFB阳性病变。
四、结果判定
荧光支气管镜下图像显示亮绿色为正常组织,图像为边界不清的暗绿色、暗红色或近暗红色为荧光减弱或消失[9]。电子气管镜下支气管刷片结果以病理科报告为准,肺泡灌洗液结果以检验科结果为准。
五、统计学方法
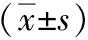
结 果
一、支气管黏膜病变白光与自发荧光支气管镜对比
两种电子支气管镜下行肺活检,肉眼直观比较,见图1。

①
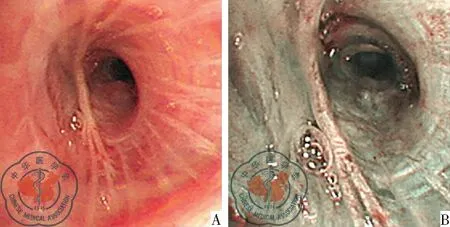
②
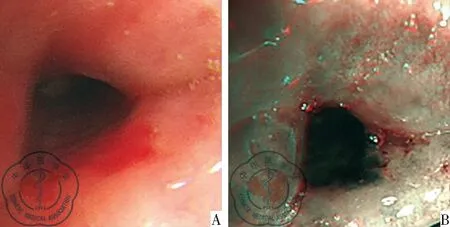
③
二、白光及自发荧光支气管镜检查镜下结果比较
两种支气管镜检查结果比较, 白光电子支气管镜阳性检出率为10.34%, 而自发荧光支气管镜阳性检出率为54.31%,两组差异比较P<0.05,差异具有统计学意义,见表1。
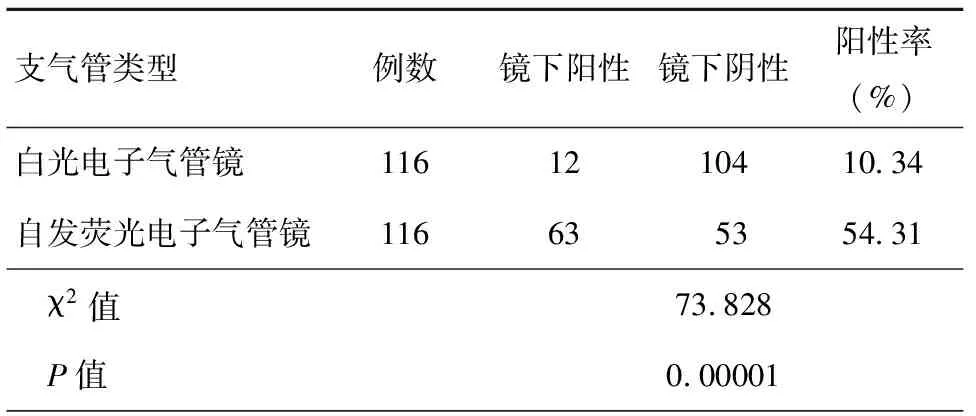
表1 白光及自发荧光支气管镜检查镜下结果比较
三、自发荧光支气管镜SPN刷片、肺泡灌洗液、肺活检结果
荧光电子气管镜引导下气管刷片阳性结果率33.63%,阴性结果率:66.37%;肺泡灌洗液阳性结果率:18.2%,阴性结果率:81.8%;肺活检阳性结果率:59.49%,阴性结果率:40.51%, 见表2。
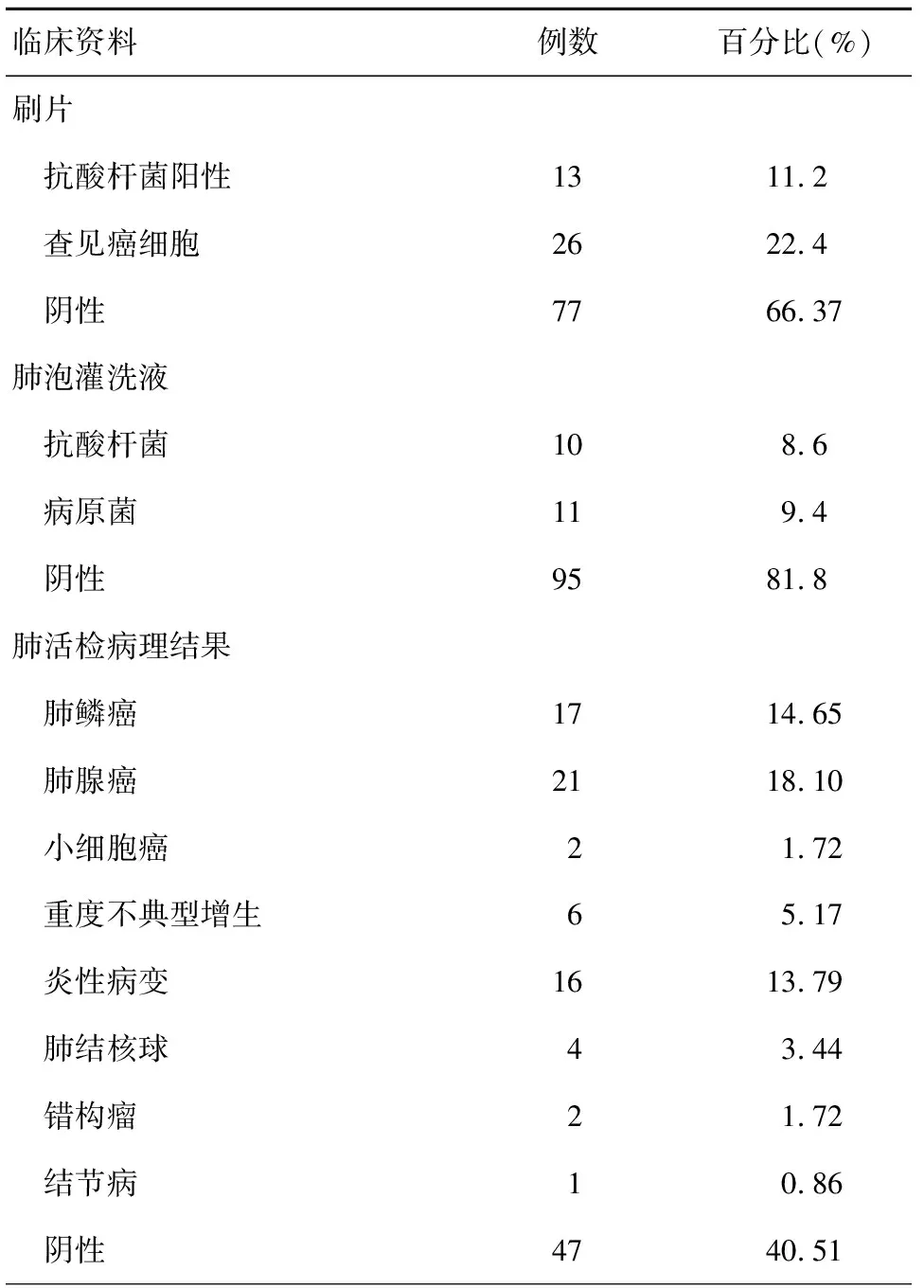
表2 自发荧光支气管镜SPN刷片、肺泡灌洗液、肺活检结果
四、荧光支气管镜肺活检并发症
荧光电子气管镜肺活检并发症主要以气胸、血气胸、咯血、痰中带血、镜下大出血为主,严重者出现死亡。本组发生镜下大出血2例(1.72%),痰中带血12例(10.34%),气胸4例(3.44%),血气胸1例(0.86%),未出现死亡病例。
讨 论
TBLB联合肺活检是明确SPN病理性质的重要的微创方法,其优点是[6]: ①定位准确,阳性率高;②相比经皮肺穿刺、开胸肺活检等方法,创伤小,气胸、血气胸、出血风险小;③对原发性支气管肺癌的诊断率高;④避免后患者及医护人员遭受X线辐射;⑤手术痛苦小,患者配合度高,可重复检查。
目前组织活检是确诊SPN良恶性的唯一方式,获取SPN组织难度大,受SPN的大小、位置、周围血管等因素影响。目前临床上主要采取电子气管镜下肺活检、经皮肺穿刺、开胸肺活检等方式,各有优缺点[11-13]:在取材阳性率、病理诊断符合率、诊断恶性病变敏感度方面,经皮肺穿刺较TBLB高。对靠近胸壁的SPN进行经皮肺穿刺操作,取材容易,气胸发生率很低,较TBLB有优势;但对肩胛间区SPN建议选择TBLB;在并发症方面,TBLB较PNLB更容易出现气胸、出血、感染、血气胸、死亡等风险。因此PNLB与TBLB不能相互替代,应根据实际情况选择最佳活检方式。
荧光电子支气管镜的优势在于可以发现段支气管的微小病变,在病变相应段支气管行肺活检,提高SPN的诊断率,减少并发症。本研究通过对116例SPN患者同时行白光电子气管镜及自发荧光电子气管镜检查;其中荧光电子气管镜下63例,阴性53例,阳性率54.31%,而相同患者白光电子气管镜下阳性率为10.34%。在SPN患者的电子气管镜检查中,自发荧光电子气管镜下阳性率明显高于白光电子气管镜。支气管刷片查见抗酸杆菌13例,查见癌细胞26例,阳性率33.6%;肺泡灌洗液查见抗酸杆菌10例,查见病原菌11例,阳性率18%;荧光电子气管镜下肺活检结果成功率59.49%,其中诊断为恶性肿瘤38例,阳性率34.97%。有相关文献报道,SPN的恶性率不尽相同,从5%到69%不等[14],不同研究机构报道的SPN恶性率不同,可能受限于诊疗条件及操作者水平。本研究通过荧光电子气管镜下细胞刷片、肺泡灌洗液、肺活检等检查方法,发现SPN的恶性率为62.93%,与相关文献报道的恶性率范围相一致。国内相关研究发现,普通白光电子气管镜下肺活检SPN的恶性率可达56.5%[13]。
电子气管镜下肺活检容易出现气胸、出血等并发症,本组镜下大出血2例,发生率1.72%,经镜下止血后未再出血;气胸4例,发生率3.4%;血气胸1例,发生率0.8%,经胸腔闭式引流术后1~3 d内痊愈;痰中带血12例,发生率10.34%,无死亡病例;支气管镜检查后痰中带血较常见,但多见于术后1~2 d自行缓解,无需特殊处理,若痰中带血明显,可适当给予止血药物。有文献报道,经皮肺穿刺气胸发生率37%,咯血发生率15%[15],本研究在并发症方面较经皮肺穿刺明显降低,与白光电子气管镜肺活检并发症发生率相近。
本文通过运用自发荧光电子气管镜对SPN的病变性质诊断,发现自发荧光电子气管镜下病变阳性率明显提高;肺组织活检取材成功率、恶性病变率均较白光荧光电子气管镜提高;并发症明显低于镜皮肺穿刺,与白光电子气管镜相近。因此,在有条件的医疗机构,针对SPN的诊断建议开展荧光电子气管镜检查,以提高诊断率。
