基于生存分析的三疣梭子蟹无水保活技术研究
2018-03-10尚海涛俞静芬林旭东凌建刚
尚海涛,俞静芬,朱 麟,崔 燕,林旭东,凌建刚
( 1.宁波市农业科学研究院,农产品加工研究所,浙江 宁波 315040;2.宁波市农产品保鲜工程重点实验室,浙江 宁波 315040 )
梭子蟹(Portunus)(俗称白蟹、枪蟹、飞蟹)是我国大型海洋经济蟹类,是沿海重要的渔业资源[1]。三疣梭子蟹(P.trituberculatus)肉质细嫩、脂膏肥满、味道鲜美、营养丰富,是海中珍品,可蒸、煎、炒,亦可葱油、汤类,还可鲜食、腌食等。传统的梭子蟹运输方法有有水保活法(活水运输)、冰鲜法(加冰运输)、冷冻法等。无水保活,又称离水保活,或称干法运输,是对传统运输方法的一次革新,具有低成本、低污染、方便实用等优点。研究较多的有鲫鱼(Carassiusauratus)[2]、罗非鱼(Oreochromissp.)[3]、泥鳅(Misgurnusanguillicaudatus)[4]等鱼类,还有日本囊对虾(Marsupenaeusjaponicus)[5]、日本沼虾(Macrobrachiumnipponense)[6]等虾类,及海湾扇贝(Argopectenirradians)[7]、厚壳贻贝(Mytiluscrassitesta)[8]等贝类保活方法。
生存分析是将事件的结果(终点事件)和出现这一结果所经历的时间结合起来分析的一种统计分析方法。由于它考虑了每个观测出现某一结局的时间长短,可以更好地描述终点事件发生规律。在医学科学研究中具有广泛而重要的应用价值。近年来许多研究者更是将其应用到生态学[9]、工程学[10]、社会学[11]、经济学[12]、计算机科学[13]等领域。
笔者将梭子蟹死亡作为终点事件,研究有水充气、有水未充气、高氧、高氧低二氧化碳等处理对三疣梭子蟹生存状况的影响,应用生存分析揭示三疣梭子蟹死亡规律,探析致死原因,以期为三疣梭子蟹的无水保活技术的应用提供一定的数据参考。
1 材料与方法
1.1 材料与设备
试验用三疣梭子蟹购于宁波象山中国水产城。海水晶(上海保嘉工贸有限公司);钠石灰(上海纳辉干燥试剂厂);高纯氧气、氮气、二氧化碳(宁波市方辛气体公司)。
S-80B型增氧机(宁波横溪赛尔电器厂);LQP-B-4制冰机(上海安亭科学仪器厂);CheckPoint型O2/CO2气体分析仪(丹麦PBI Dansensor公司);FG4型便携式溶解氧测定仪[梅特勒—托利多仪器(上海)有限公司];MAP-H360型盒式包装机(苏州森瑞保鲜设备有限公司)。
1.2 方法
1.2.1 原料预处理
试验蟹为海捕野生三疣梭子蟹雄蟹,捆绑螯足,规格一致(150~200 g),活泼健康。采用有水充气的方法5 h内运回宁波市农业科学研究院农产品加工研究所实验室,再次挑选出活力强的蟹用于试验。
1.2.2 离水干露试验
将50只梭子蟹,随机分成5组,每组10只,无水干露于塑料箱中,置于8~10 ℃冷库中,每2 h观察一次,评价梭子蟹活力,记录死亡蟹个数和死亡时间。
1.2.3 有水充气试验
将50只梭子蟹,随机分成5组,每组10只,放置在8~10 ℃冷库中的有水塑料箱中(按海水晶使用方法配制),充气增氧。每12 h观察一次,评价梭子蟹活力,并记录死亡蟹个数和死亡时间。同时,测定水体溶解氧含量,并更换水体一次。
1.2.4 有水未充气试验
处理同1.2.3,但未充气,放置在8~10 ℃冷库中,每2 h观察一次,评价梭子蟹活力,并记录死亡蟹个数和死亡时间。同时测定水体溶解氧含量。
1.2.5 加冰试验
将50只梭子蟹,随机分成5组,每组10只,无水状态下置于塑料箱中,加入碎冰(蟹冰量约为1∶1.5),放置在8~10 ℃冷库中,每1 h观察一次,评价梭子蟹活力,记录死亡蟹个数和死亡时间。
1.2.6 高氧试验
将50只梭子蟹,以1层湿毛巾、2只蟹的方式置于包装盒内,采用盒式包装机充入80%氧气,自动热压封口。然后放置在8~10 ℃冷库中,每8 h测定包装盒内氧气和二氧化碳含量,拆封观察一次,评价梭子蟹活力,并记录死亡蟹个数和死亡时间,观察后活蟹按拆口前测定的氧气和二氧化碳含量再次充气继续试验。
1.2.7 高氧低二氧化碳试验
处理同1.2.6,只是预先在每个包装盒内放入20 g钠石灰。
1.3 测试项目与方法
1.3.1 活力评价与死亡判断标准
5人评分小组按表1对梭子蟹活力进行评价,并以0级活力作为蟹死亡判断标准。
1.3.2 溶解氧含量与氧气/二氧化碳含量测定
采用溶解氧测定仪测定水体中溶解氧含量。采用气体分析仪测定包装盒内的氧气/二氧化碳含量。
1.4 统计方法
试验结果采用SPSS 18.0软件,进行乘积极限法生存分析和Log-Rank检验,差异显著性水平为0.05。
2 结果与分析
2.1 三疣梭子蟹的生存曲线
捕捞后生存环境的变化使梭子蟹陆续死亡,其生存曲线见图1。生存分析结果表明,不同保活处理间平均生存时间存着显著性差异(P<0.05)(表2)。各处理下梭子蟹平均生存时间由长到短依次为有水充气保活(68.4 h)>高氧低二氧化碳保活(53.1 h)>高氧保活(38.4 h)>离水干露(7.6 h)>有水未充气保活(2.6 h)>加冰保活(1.8 h)。
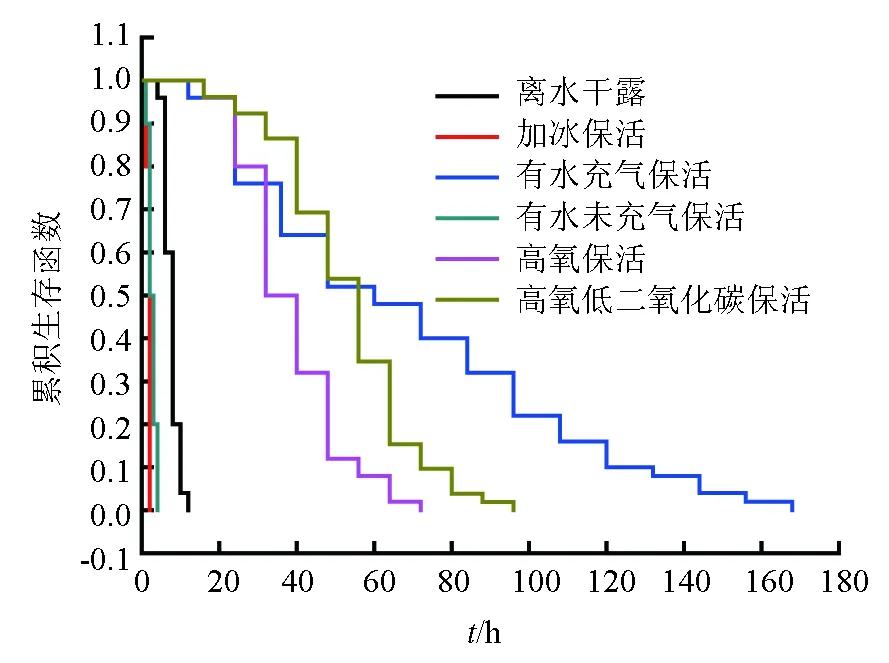
图1 不同处理下三疣梭子蟹的生存曲线
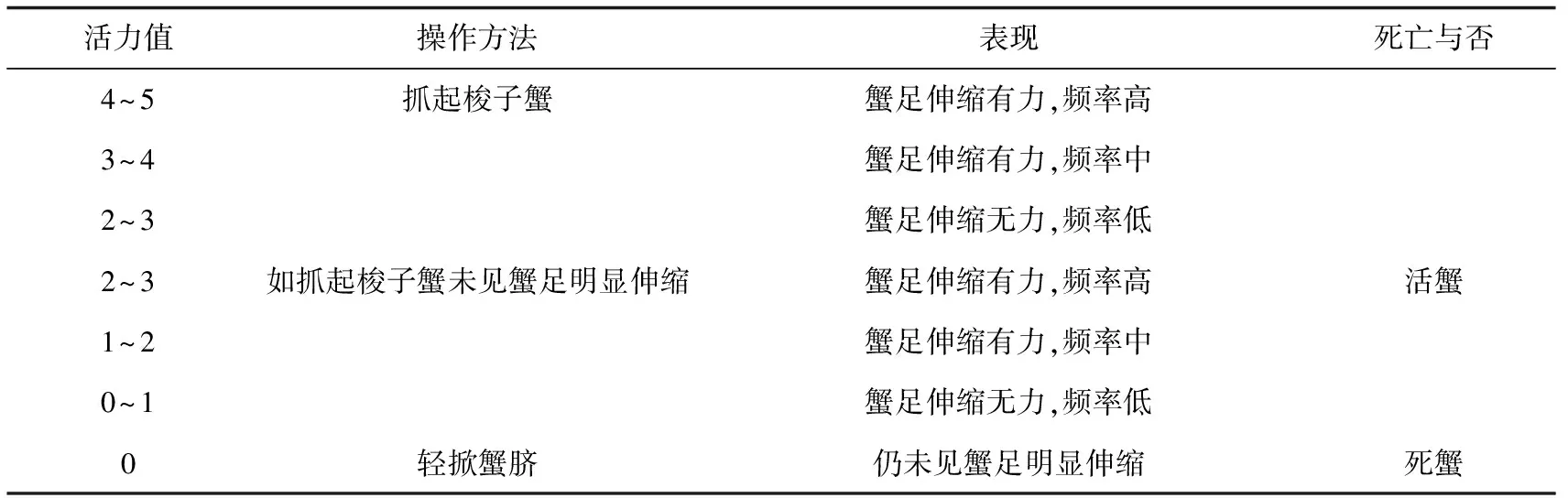
活力值操作方法表现死亡与否4~53~42~32~31~20~10抓起梭子蟹如抓起梭子蟹未见蟹足明显伸缩轻掀蟹脐蟹足伸缩有力,频率高蟹足伸缩有力,频率中蟹足伸缩无力,频率低蟹足伸缩有力,频率高蟹足伸缩有力,频率中蟹足伸缩无力,频率低仍未见蟹足明显伸缩活蟹死蟹
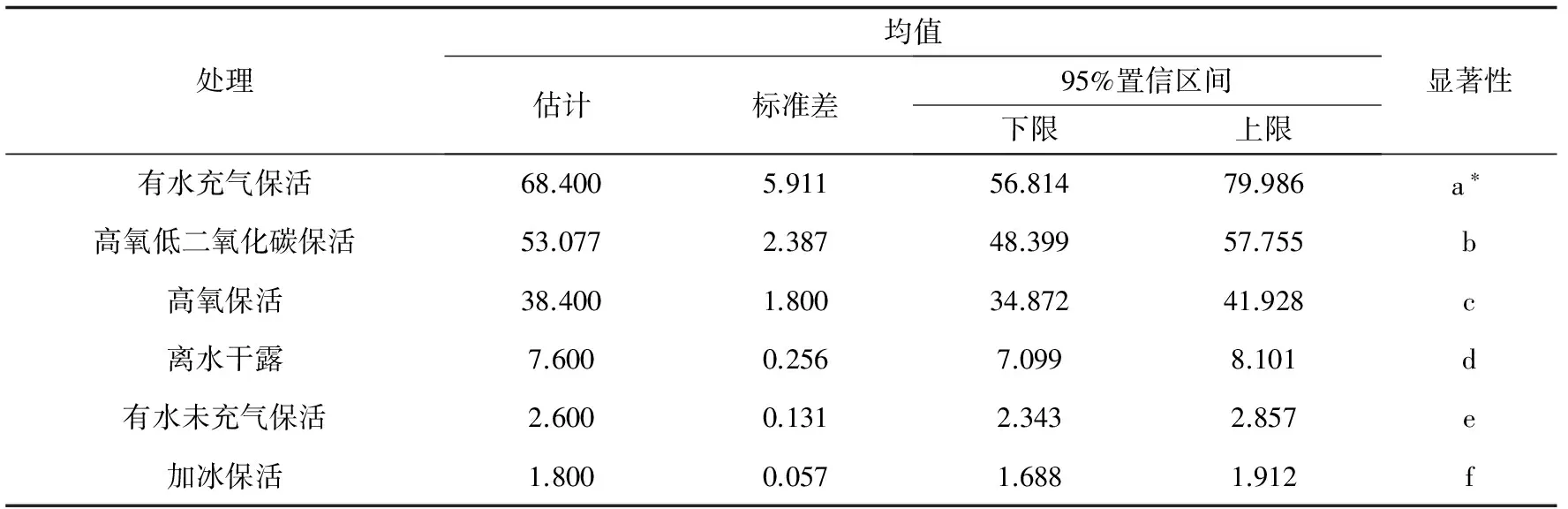
表2 不同处理下三疣梭子蟹生存表的平均生存时间
注:不同字母表示差异显著,相同字母表示差异不显著,差异显著性水平为0.05.
加冰是目前市场上常用的梭子蟹运输方法之一,但由图1可见,其死亡速度最快,表明加冰运输“只保鲜不保活”。这一点主要与温度低有关。谢佳彦等[14]研究表明,梭子蟹较适宜于5 ℃干法运输。林国雄等[15]认为,温度过低、温差太大,蟹体适应不了突然的环境而产生严重断足,甚至死亡,降低成活率,建议采用梯度降温冷却麻醉处理。
2.2 有水充气和有水未充气保活
死亡是一个终点事件,只表示活力为0时的生存状态。而活力是一个过程变量,可以更好的动态描述梭子蟹生存状况和分析致死原因。有水充气保活和有水未充气保活梭子蟹活力变化上差异巨大,前者活力保持较好,后者却极差。有水充气保活可以持续保持着高活力,而有水未充气保活活力从一开始就急速下降,其下降起始时间早于平均生存时间2.6 h(图2),说明梭子蟹活力下降继而死亡。有水充气保活却未发现类似的现象,未出现普遍活力快速下降的现象。
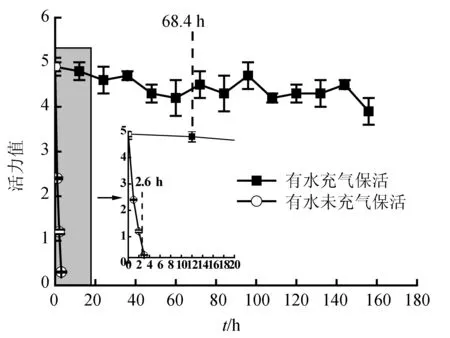
图2 有水保活过程中三疣梭子蟹活力变化
有水保活是目前市场上最常用的梭子蟹保活方式,但有水保活必须充气,以提供充足的溶解氧。刘重斌等[16]研究认为三疣梭子蟹有水保活生存关键的溶解氧水平为2~4 mg/L。0、10、20 ℃的水中饱和溶解氧分别为14.64、11.26、9.08 mg/L,实际天然水中氧气含量达不到上述饱和量。有水未充气起始点溶解氧仅8 mg/L。随着梭子蟹呼吸消耗氧气,溶解氧会迅速下降。有水充气保活溶解氧含量一直保持在9~11 mg/L(图3),充足的氧气避免了低氧胁迫和活力下降。可见,溶解氧在有水保活中起着至关重要的作用。
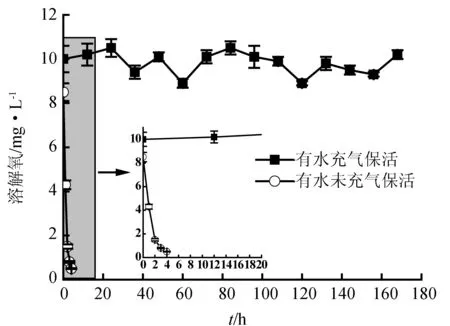
图3 有水保活过程中水体溶解氧含量的变化
2.3 离水干露
梭子蟹离水后前4 h活力变化较为平稳,仅略微下降,类似于有水充气保活,但4 h后,活力快速下降,活力变化又类似于有水未充气保活。离水干露平均生存时间7.6 h,活力下降之后陆续死亡(图4)。
梭子蟹靠鳃呼吸,虽然空气中的氧气含量21%(合300 mg/L),远高于水中的溶解氧含量,但梭子蟹无法直接利用空气中的氧气。氧气必须先溶解于水中(或鳃体水中),再由蟹鳃呼吸利用。离水后蟹鳃中仍保留一定的水分,一定时间内仍可提供氧气,确保梭子蟹呼吸顺畅。但鳃体中水分与有水保活量上的巨大差异,使得有水保活空气(氧)溶于水中的效率远不及直接溶于鳃体水中,这或许可解释为什么有水未充气保活效果不及离水干露。但随着离水干露时间的延长,蟹鳃中的水分排出,以及黏液、有机物等的附着,致使鳃丝黏着,有效氧气的交换面积下降,对氧气的有效利用减少,逐渐窒息死亡。如同有水未充气保活,离水干露后期导致低氧胁迫阻碍机体代谢能力,呼吸受阻,最终窒息死亡[17]。
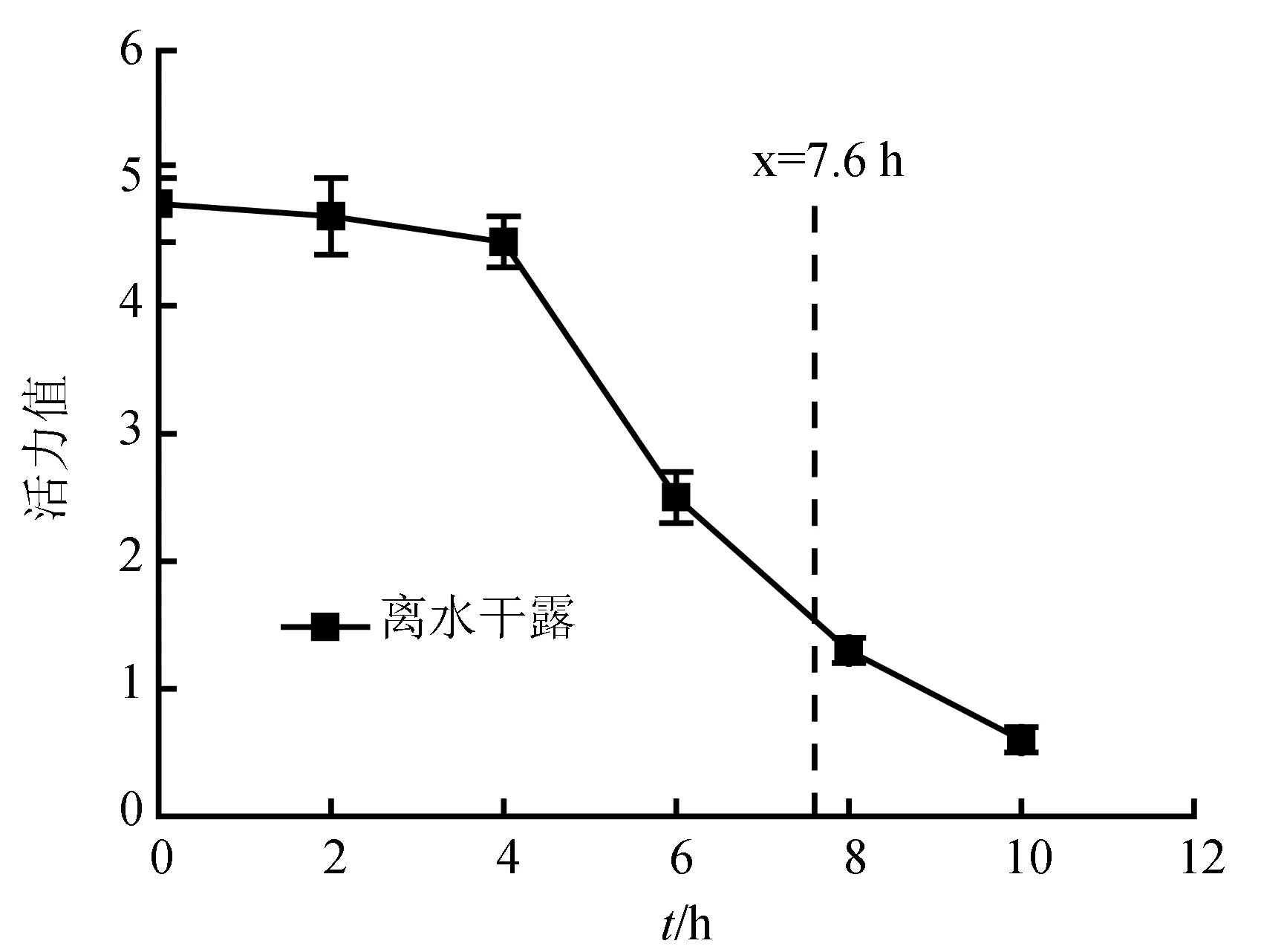
图4 离水干露过程中三疣梭子蟹活力变化
2.4 高氧保活
由图1、表2可见,高氧保活平均生存时间(38.4 h)显著高于离水干露(7.6 h),活力快速下降的起始点(16 h)也远晚于离水干露(4 h),表明高含量氧气有利于梭子蟹的保活。这一点与何蓉等[18]的研究结果相一致,他们认为充足的氧气供应是保活运输的前提。高氧有利于保持梭子蟹较高的活力和存活率,也从另一方面反映出梭子蟹离水后死亡与低氧胁迫有关。根据亨利定律高氧增加了氧分压,意味着蟹鳃中可以溶解更多的氧气。空气中氧气含量为21%,高氧保活为80%,如离水干露的梭子蟹鳃中溶解氧为8 mg/L,高氧环境理论上溶解氧应为30 mg/L,很大程度上可抵消低氧胁迫。
但是高氧保活后期还是发生了活力快速下降和死亡的现象(图5)。由包装盒内气体成分分析可知(图6),随着保活时间的延长,包装盒内的二氧化碳含量会持续上升。16 h后,二氧化碳含量达到3.5%时,活力开始快速下降。推测梭子蟹无水保活过程中不仅存在低氧胁迫,还存在高二氧化碳胁迫。
2.5 高氧低二氧化碳保活
高氧低二氧化碳保活56 h后活力快速下降,比高氧保活又延长了40 h(图7)。相对于平均生存时间53.1 h,也要晚2.9 h,表明死亡前未发生活力普遍下降的现象。其活力表现类似于有水充气保活,而不同于离水干露、有水未充气保活和高氧保活。相对于高氧保活,高氧低二氧化碳保活过程中CO2含量一直维持在极低的水平(图8),避免了高二氧化碳胁迫,提高了保活效果。
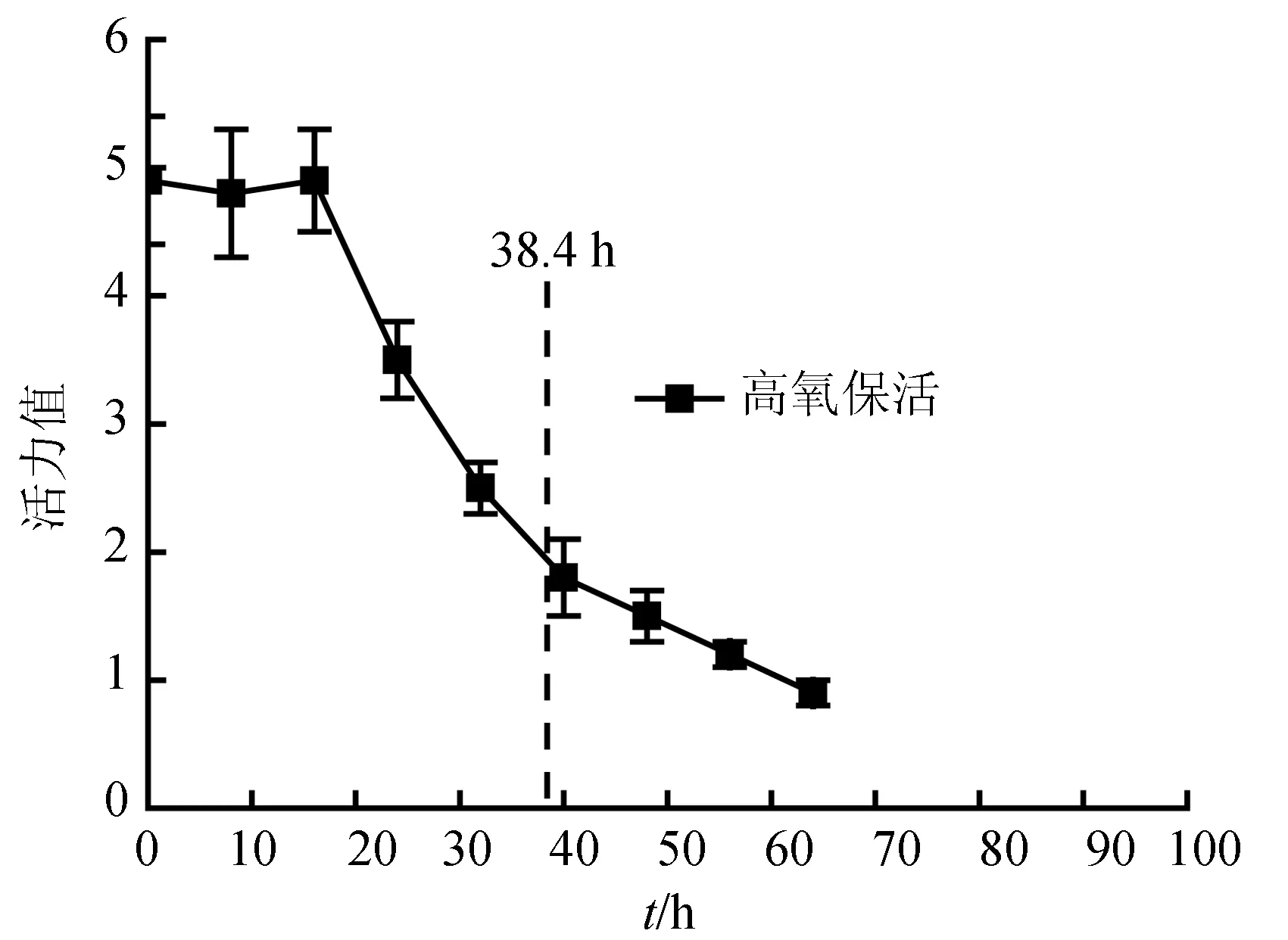
图5 高氧保活过程中三疣梭子蟹活力变化
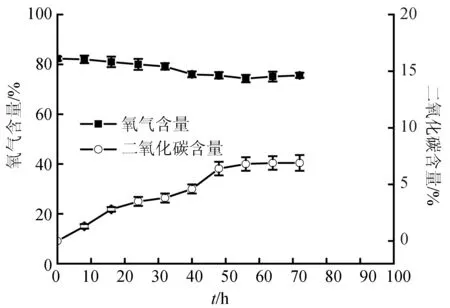
图6 高氧保活过程中氧气/二氧化碳含量变化
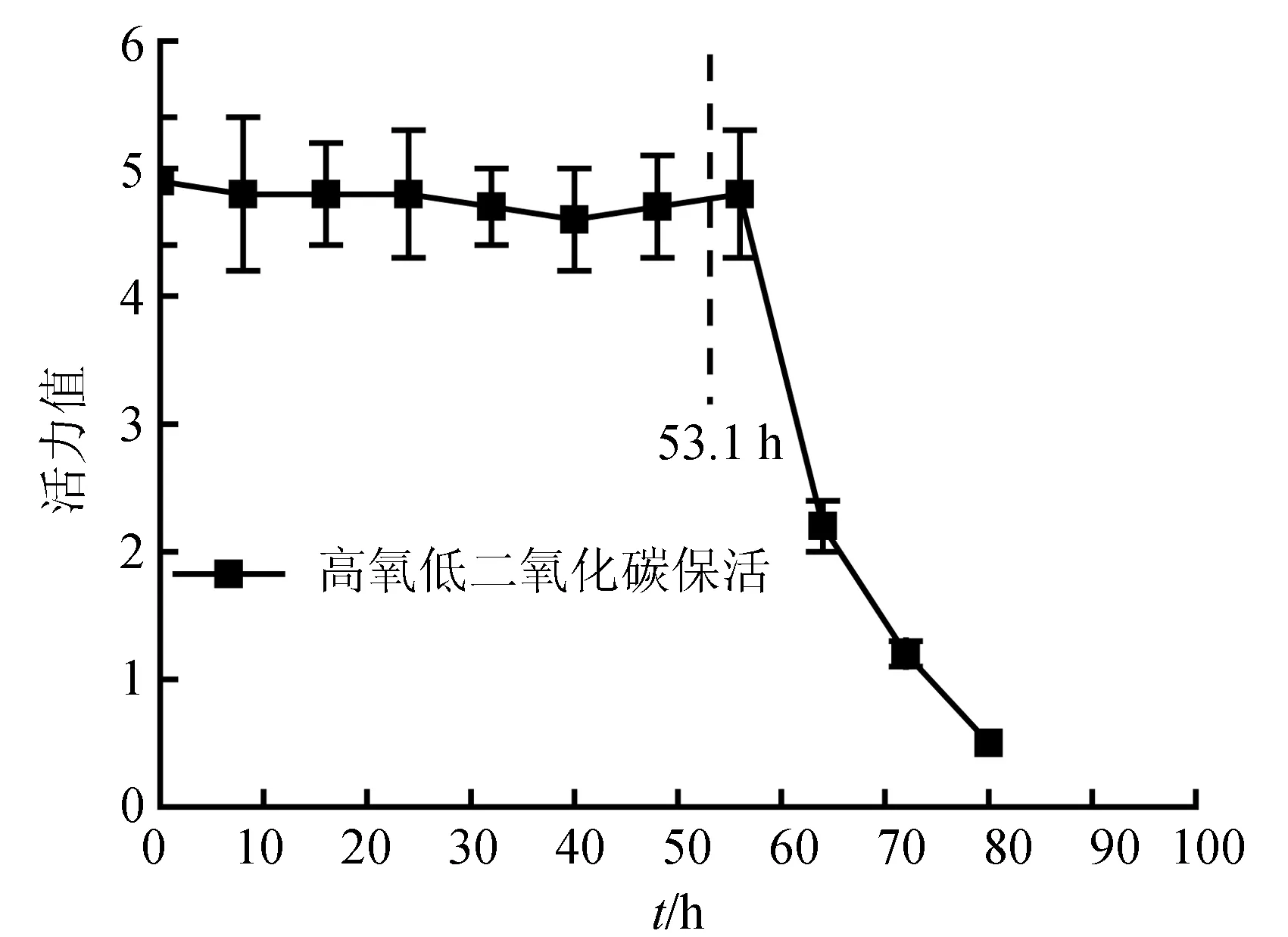
图7 高氧低二氧化碳保活过程中三疣梭子蟹活力变化
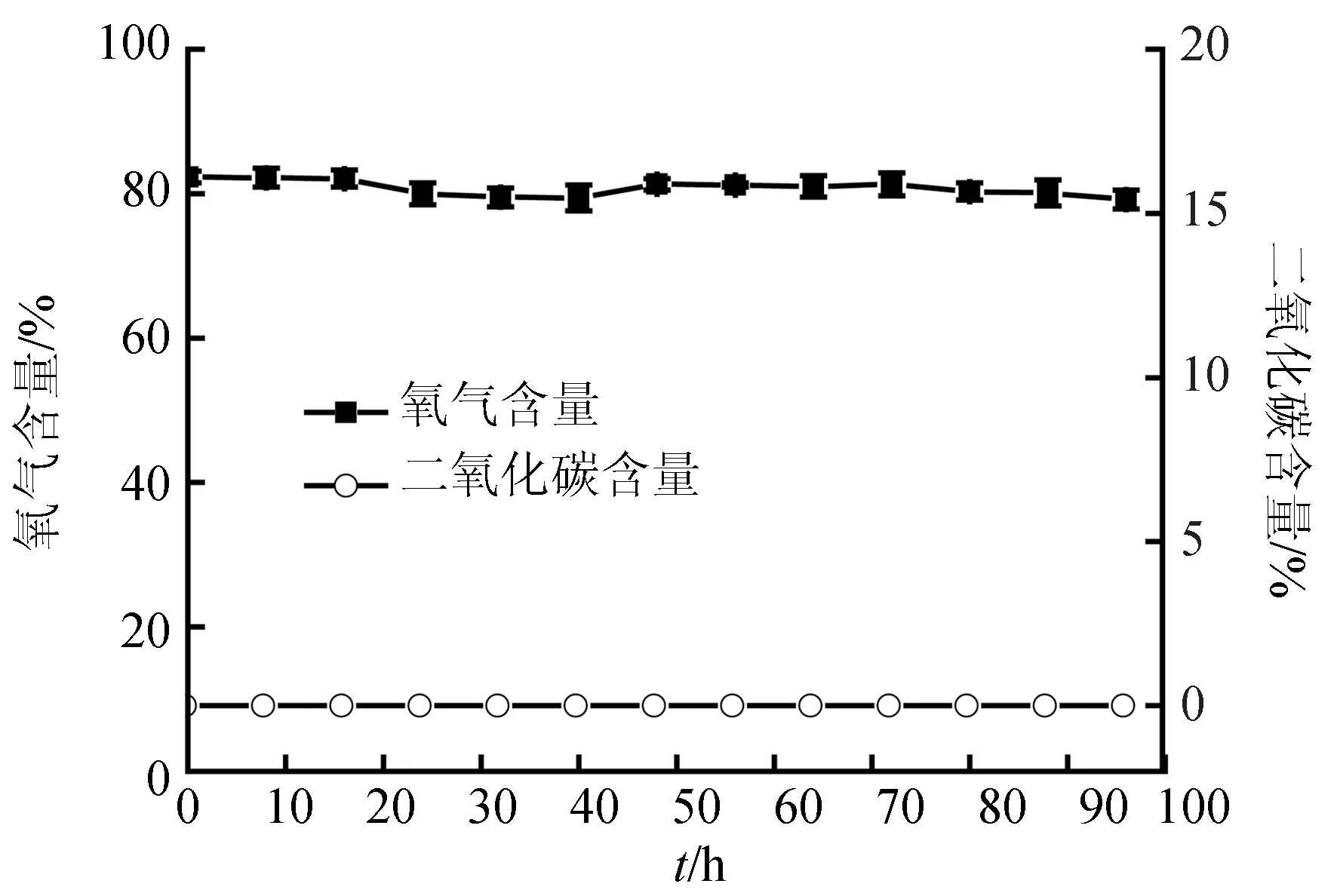
图8 高氧低二氧化碳保活过程中氧气/二氧化碳含量变化
3 讨 论
3.1 低氧胁迫致死
梭子蟹靠鳃呼吸,离水后鳃间仍保留一定的水分,短时间内可提供充足的溶解氧供其正常呼吸,保持高活力和高存活率。但随着离水时间的延长,一方面,伴随着梭子蟹呼吸会不断往体外排出水分,可利用的总溶解氧含量下降,另一方面由于黏液和有机物附着鳃丝致使有效氧交换面积下降,使梭子蟹呼吸窒息点逐渐上升而活力下降继而死亡。这一现象被称为低氧胁迫、或低氧窒息、或干露胁迫等。而低氧胁迫会导致内脏损伤,如程民杰等[19]研究表明离水操作可能损伤了红鳍东方鲀(Takifugurubripes)的肝脏和肾脏,打破了体内的平衡机制,代谢紊乱。姜娜等[17]发现,干露胁迫导致三疣梭子蟹肝胰腺总抗氧化能力水平显著下降。高氧保活可以延长梭子蟹无水保活时间,主要是通过提高梭子蟹鳃中溶解氧含量,抵消离水干露窒息点上升而产生的低氧胁迫,以达到保活的效果。
3.2 高二氧化碳胁迫致死
高氧环境采用的密封包装下还存在高二氧化碳胁迫,高含量二氧化碳加速梭子蟹活力下降继而死亡。这一研究发现与King等[20]的有水保活研究结果相类似,他们认为鱼在有水保活运输中,需要特别关注二氧化碳含量,高于80 mg/L就会导致高碳酸血症,呼吸障碍,昏迷,最终死亡。正常代谢活动所允许的最高二氧化碳含量为20~30 mg/L。高二氧化碳含量时,不论含氧量是否充足,鱼体基本上仍处于昏迷死亡状态[21]。目前还未见梭子蟹无水状态二氧化碳胁迫阈值的报道。当水面二氧化碳分压力为0.098 MPa时,0、10、20 ℃的水中二氧化碳饱和溶解量分别为3350、2310、1690 mg/L,由于空气中二氧化碳含量仅约0.03% (260 mg/L),与大气二氧化碳相平衡,10 ℃时,水中二氧化碳仅为0.693 mg/L(2310×0.03%)。以80 mg/L计算,对应的空气中的二氧化碳含量为3.5%(80/2310),而此含量时高氧保活梭子蟹活力开始快速下降,继而死亡(图6)。采用高氧低二氧化碳保活避免了低氧和高二氧化碳胁迫,是一种有效的无水保活方法。
低二氧化碳含量对梭子蟹活力无影响,超过伤害阈值的高二氧化碳含量会致死。而介于两者之间的二氧化碳含量使梭子蟹休眠。目前有关鱼类二氧化碳麻醉休眠正是利用这一特性,如二氧化碳麻醉休眠罗非鱼[22]、鲫鱼[23]、白斑狗鱼[24](Esoxlucius)等,可以延长保活时间。
3.3 其他致死因素
适宜低温有利于梭子蟹无水保活,但过低温度或温度骤降(如加冰)会产生低温胁迫导致梭子蟹死亡。这一结果与彭婷等[25]认为低温胁迫致罗非鱼昏迷及死亡的结果相类似。梭子蟹在低氧、高二氧化碳、低温胁迫下死亡,其致死前活力普遍下降。而有水充气保活和高氧低二氧化碳保活,避免了胁迫因素,保活时间相对较长,但仍然有限。随着时间延长仍然会陆续死亡,其平均生存时间在活力快速下降之前,甚至不会出现活力快速下降的现象。因此,可推测梭子蟹还存在着其他致死因素,有待进一步研究。
[1] 董志国, 李晓英, 阎斌伦, 等. 中国海五种群三疣梭子蟹的形态差异分析[J]. 海洋通报, 2010, 29(4):421-426.
[2] 曾鹏, 陈天及, 申江. 鲫鱼冰温离水保活及氨基酸分析[J]. 广东农业科学, 2015, 42(2):108-113.
[3] 范兴, 陆玉芹, 陈名帅, 等. 三卡因甲磺酸盐麻醉对罗非鱼离水保活的影响[J]. 食品科技, 2014, 39(9):174-179.
[4] 聂小宝, 刘淇, 张长峰, 等. 泥鳅低温无水保活技术研究[J]. 湖南农业科学, 2013(5):80-83.
[5] 齐静涛. 日本对虾活体干法运输技术研究[J]. 齐鲁渔业, 1996, 13(5):47-48.
[6] 任红梅, 万玉芳, 李雪梅. 青虾无水低温保活运输初探[J]. 科学养鱼, 2015, 31(5):50-51.
[7] 申淑琦, 万玉美, 申亮, 等. 温度、湿度和氧气对海湾扇贝无水保活的影响[J]. 大连海洋大学学报, 2014, 29(5):492-497.
[8] 曹井志, 徐若, 包建强. 厚壳贻贝低温无水保活技术[J]. 安徽农业科学, 2008, 36(10):4248-4249.
[9] 黄云鹏, 苏松锦, 范繁荣, 等. 蓝果树种群径级结构与生命表分析[J]. 林业资源管理,2015(3):85-88.
[10] 王辉, 富宇平. 基于两种生存分析方法的部件可靠性研究[J]. 航空维修与工程, 2014(6):82-85.
[11] 叶初升, 赵锐. 中国农村的动态贫困:状态转化与持续——基于中国健康与营养调查微观数据的生存分析[J]. 华中农业大学学报:社会科学版, 2013(3):42-52.
[12] 贺筱君, 陈俊男, 吴佳懋. 生存分析在股市期市涨跌预测中的应用[J]. 数量经济技术经济研究, 2014, (12):116-126.
[13] 刘江涛. 无线传感器网络的三层结构生存分析[J]. 计算机与数字工程, 2015(9):1644-1646.
[14] 谢佳彦, 朱爱意. 几种重要水产品活体运输技术研究[J]. 水产科学, 2010, 29(9):532-536.
[15] 林国雄, 李复雪. 三疣梭子蟹低温保活的初步研究[J]. 海洋渔业, 1984(2):61-62.
[16] 刘重斌, 肖敏, 冯彦红, 等. 水溶氧对三疣梭子蟹(Portunustrituberculatus,Miers,1876)生理应答的影响[J]. 动物营养学报, 2011, 23(3):506-513.
[17] 姜娜, 王芳, 路允良, 等. 干露对三疣梭子蟹抗氧化和应激能力的影响[J]. 水产学报, 2014, 38(12):1996-2004.
[18] 何蓉, 谢晶. 水产品保活技术研究现状和进展[J]. 食品与机械, 2012, 28(5):243-246.
[19] 程民杰, 黄亚东, 徐文敏, 等. 离水操作胁迫对红鳍东方鲀血清生化指标的影响[J]. 水产科学, 2015, 34(4):227-231.
[20] King H R, Jones B, Tensen M C. Fish transport in the aquaculture sector: an overview of the road transport of Atlantic salmon in Tasmania[J]. Journal of Veterinary Behavior Clinical Applications & Research, 2009, 4(4):163-168.
[21] 汪之和, 张饮江, 李勇军. 水产品保活运输技术[J]. 渔业现代化, 2001, 28(2):31-34.
[22] 周翠平, 白洋, 秦小明, 等. 二氧化碳麻醉技术在罗非鱼无水保活运输中的应用研究[J]. 渔业现代化, 2014, 41(4):21-25.
[23] 张恒, 汪玉祥, 冒森莉, 等. 淡水鱼碳酸休眠法无水保活运输技术[J]. 水产科技情报, 2008, 35(5):236-240.
[24] 金一春, 胡萍华, 曲学伟, 等. 二氧化碳麻醉对白斑狗鱼的影响[J]. 湖南农业科学, 2009(12):138-140.
[25] 彭婷, 胡庭俊, 林勇, 等. 低温胁迫对罗非鱼血液生化、免疫及抗氧化指标的影响[J]. 水产科学, 2012, 31(5):259-263.
