不同基因型烟草腺毛主要分泌物差异分析
2018-03-09屈亚芳许明录曹建敏孙惠青尤祥伟王国平蒋彩虹王元英常爱霞
屈亚芳,许明录,曹建敏,孙惠青,尤祥伟,王国平,蒋彩虹,王元英,常爱霞
1 中国农业科学院烟草研究所,青岛 266101;
2 中国农业科学院研究生院,北京 100081;
3 河南科技学院,新乡 453000
烟草表面分泌物约占鲜叶重的0.5%~10%,是烟草化学的重要组成部分[1]。腺毛是产生表面分泌物最重要的组织类型,其分泌物主要包括二萜,糖酯、表面蜡等三大类成分[2-3]。其中,含量最丰富的是西柏三烯二醇和糖酯(普通烟草中主要是蔗糖酯)。以上两种成分不但对烟草品质具有重要作用[4-11],而且还具有抗虫、抗菌、抗氧化及防止老化等多种功能,在烟用香精香料、天然杀虫剂、食品添加剂、化妆品抗氧化剂等方面也具有广阔的商业开发前景[9,12-17]。在番茄上,糖酯已经成为重要的抗虫性育种目标之一[18-23]。近年来,国内多个烟草育种单位也开始以腺毛分泌物含量为育种目标开展相关育种研究。然而,由于国内对不同基因型烟草腺毛分泌物的含量及定性差异研究较少,所以烤烟育种中可有效利用的高腺毛分泌物种质资源仍然较少。
鉴于此,本研究拟对不同基因型烟草中西柏三烯二醇、糖酯等腺毛最主要分泌物进行鉴定比较,以期明确我国不同基因型烟草腺毛主要分泌物的定性和定量差异,为以烟叶腺毛分泌物为主攻目标的烤烟香气品质和抗性改良提供相应的理论基础,同时也为腺毛分泌物在烟用香精香料、抗虫剂、食品及化妆品抗氧化剂等商业用途中的开发利用提供参考。
1 材料与方法
1.1 试验材料及种植条件
供试种质材料见表1,试验用种由国家农作物种质资源平台烟草种质资源子平台提供。试验材料种植于中国农业科学院烟草研究所即墨试验基地,土壤类型为棕壤,碱解氮含量51.55mg/kg,有效磷21.60mg/kg,速效钾131.74mg/kg,氯离子12.40mg/kg,有机质0.81%,pH值5.84。试验采取小区试验(小区长12.5m,行距1m,株距0.5m),每个品种(系)种植2行区。

表1 供试种质材料Tab.1 Tested vatieties
1.2 试验方法
1.2.1 样品制备
对出苗的各品种在旺长后期(现蕾前)取样进行表面分泌物检测分析,每个品种选取9株长势正常一致的烟株,每3株作为1个重复,共设3次重复。每个重复中的每株烟,从顶端向下数第4~6叶位(叶长15~20cm)各取1片烟叶,每片烟叶在主脉一侧靠近叶基、叶中和叶尖处用直径16mm的打孔器各打一叶盘放入20mL提取小瓶。
1.2.2 气相色谱-质谱联用仪样品前处理方法
向取好叶盘的小瓶中加入7.5mL二氯甲烷(色谱纯),共萃取2次,合并2次萃取液于20mL提取瓶中,并向萃取液中加入无水Na2SO4静置过夜,用0.5μm的有机系滤器过滤至提取小瓶中。向提取小瓶中加入25μg·mL-1的十七烷与十七烷醇为1:1的二氯甲烷溶解的内标溶液50μL。40℃水浴加热,以氮吹法蒸发至干。添加100μL BSTFA:DMF=1:1的硅化试剂,再施以氮吹,排出氧气。包裹试管,75℃水浴锅中水浴30min后,冷却至室温。再加入100μL BSA:吡啶=1:1的试剂,用微孔滤膜过滤到进样小瓶(内有衬管)中,通过气相色谱-质谱联用仪检测(利用正十七烷和正十七烷醇作为内标)。
1.2.3 气相色谱-质谱联用仪检测方法
色谱柱:TR-1MS(30.0m·0.25μm·0.25μm);进样口温度:265℃;柱头压:100kPa;传输线温度:280℃;升温程序:从165℃起,以4℃/min升至280℃,保持20min;进样量:1.0μL;分流比:15.0。GCMS-QP2010plus:离子源温度:280.00℃;接口温度:280.00℃;扫描速度:1666。检索谱库:NIST8S。
1.2.4 定性定量的分析
本研究重点对栽培烟草腺毛分泌物中二萜类以及蔗糖酯类物质进行定性定量分析。其中西柏三烯二醇参照行业标准《烟草及烟草制品西柏烷二萜醇测定》定性,蔗糖酯的定性参照参考文献[24-25]中不同类型蔗糖酯的特征离子(如表2)。各物质利用内标正十七烷进行相对定量。相对定量的公式为:
物质含量(μg·cm-2)=(目标物的峰面积/内标正十七烷峰面积)×N内标/S叶片总面积
1.2.5 数据处理分析
本实验中的表型数据通过SPASS 19.0软件进行显著性分析。通过单因素方差分析,利用Duncan法,在0.05水平下进行显著性差异分析。
2 结果与分析
2.1 不同类型烟草腺毛分泌物中西柏三烯二醇比较分析
本研究重点对烟草腺毛分泌物中含量最丰富的二萜即西柏三烯二醇(CBT-diols)进行了定性和相对定量分析。如图1所示,保留时间16.963min、17.969min分别是α-CBT-diols、β-CBT-diols的峰位置。
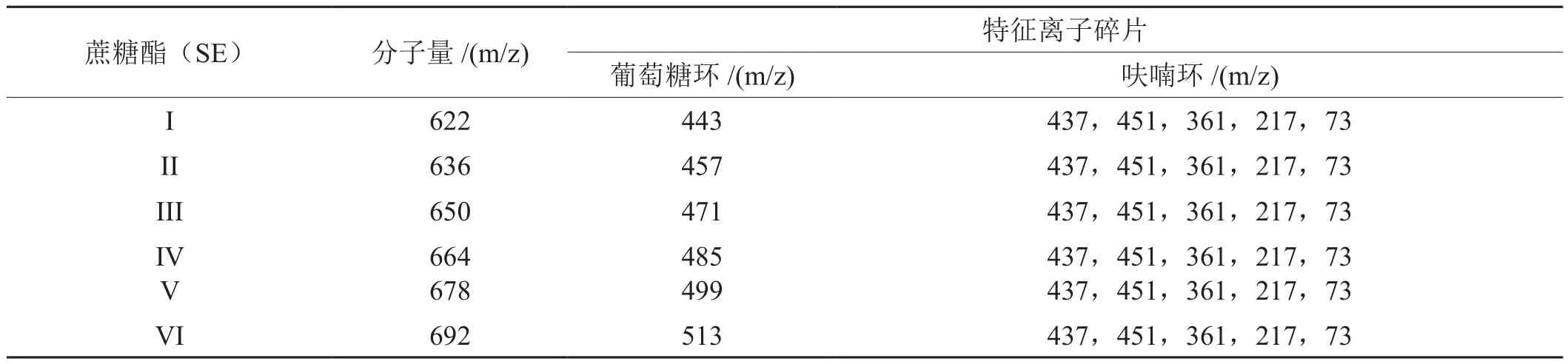
表2 不同类型蔗糖酯的特征离子Tab.2 Characteristics of different types of sucrose ester ions
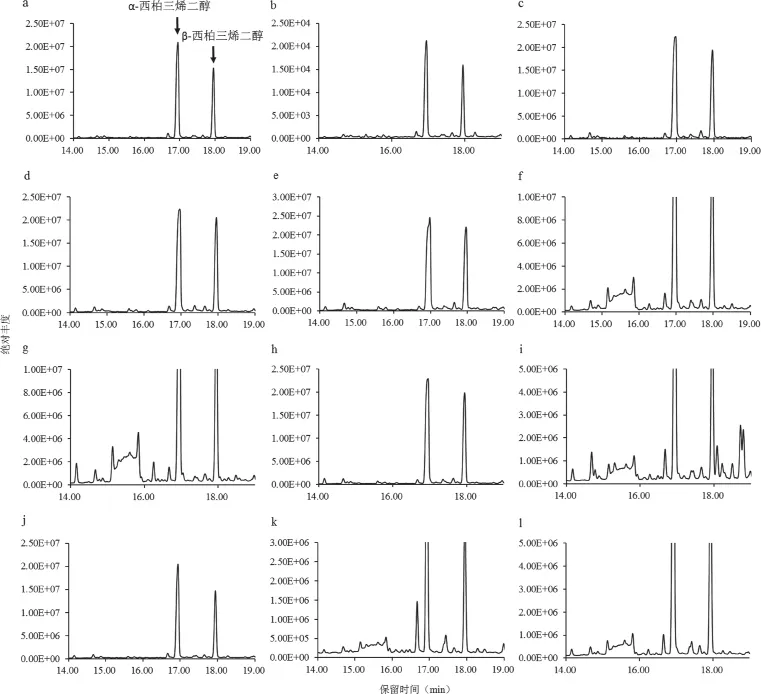
图1 不同品种中西柏三烯二醇的TIC图Fig.1 CBT-diols TIC charts for different varieties
由表3可知,供试的12份不同基因型烟草品种均含有α-CBT-diols和β-CBT-diols,且α-CBT-diols含量与β-CBT-diols的含量呈正相关。供试品种中α-CBT-diols和β-CBT-diols含量的比值在 1.58~2.32。
从CBT-diols总含量上看,烤烟腺毛分泌物中CBT-diols总含量在不同基因型烟草品种间总体表现较高。香料烟Basma和雪茄烟Beinhart1000-1的CBT-diols含量与烤烟接近,其它种质明显低于烤烟,白肋烟KY14在所测的12份种质中含量较低。不同基因型烟草西柏三烯二醇含量总体趋势为:烤烟>香料烟、雪茄>晒烟、白肋烟。各种质之间的CBT-diols的总量以及α-CBT-diols和β-CBT-diols的含量均呈现显著差异。

表3 供试品种中二萜类物质的含量及差异显著性分析Tab.3 Quantity and difference significance analysis of diterpenoids of tested varieties
2.2 不同类型烟草腺毛分泌物中糖酯比较分析
普通烟草中的糖酯类型主要是蔗糖四酯,这些蔗糖四酯主要分6个型(Ⅰ-Ⅵ)[26],蔗糖酯I-II型不含酯化的3-甲基戊酸基团,而蔗糖酯Ⅲ-Ⅵ型至少含有1个酯化了的3-甲基戊酸基团[26-27]。
结合图2和表4可知,供试的12个基因型品种中蔗糖酯共检测出5个型,不同品种间蔗糖酯类型差异较大。根据蔗糖酯类型和含量的差异,12份供试品种可分两类:一类为Ⅰ-Ⅱ型蔗糖酯丰富的品种类型,包括普通烤烟翠碧1号、K326、红花大金元、BX2、NC2326,白肋烟KY14、T11406,这7种烟草仅含痕量的Ⅲ-V型蔗糖酯(微量)。另一类是Ⅲ-Ⅵ型蔗糖酯丰富的品种类型,包括香料烟 Basma、Samsun,雪茄烟 Beinhart1000-1,烤烟BX1,晒烟青梗这5个品种。蔗糖酯含量的显著性分析结果显示,BX2含有的I-II型蔗糖酯含量显著高于其他品种,其次是红大,最低的是Samsun。此外,经分析发现,烤烟中Ⅱ型的糖酯含量远高于Ⅰ型糖酯。各种质之间的蔗糖酯总量以及各型蔗糖酯含量均呈现显著差异。总体结果显示,Basma、BX1、Beinhart1000-1及BX2等4个品种蔗糖酯总量相对较高。

图2 不同品种糖酯的TIC图Fig.2 TIC of sucrose ester charts for different varieties

表4 不同品种中蔗糖酯含量及差异显著性分析Tab.4 Quantity and difference significance analysis of sucrose esters of tested varieties
2.3 不同类型烟草主要腺毛分泌物总量分析
如图3所示,香料烟Basma、BX1、BX2和烤烟红花大金元腺毛分泌物中二萜和蔗糖酯总含量较高,其次是雪茄烟Beinhart1000-1,NC2326均高于各品种的平均值12.11μg·cm-2,其他品种均低于平均值,其中最低的是TI1406。

图3 不同品种二萜和蔗糖酯的总量Fig.3 Total content of diterpenoids and sucrose esters of tested varieties
3 讨论
不同类型的烟草品种,实际生产种植条件会有所不同。本研究在同一种植条件下,对各类型烟草的表面分泌物进行分析,目的是环境和栽培条件的影响,探索基因型差异对烟叶腺毛主要分泌物的影响,从而筛选可供育种或分泌物提取所需要的种质。研究结果表明,西柏三烯二醇是烟草类西柏烷二萜的主要物质形式,不同类型烟草品种中均含有α-CBT和β-CBT,且α-CBT含量是β-CBT的1.58~2.32倍,不同烟草类型间西柏烷二萜的含量存在差异,这与以往研究结果基本一致[28]。长期以来,科研工作者从西柏烷二萜醇的定性,合成代谢机理[29]以及纯化方法[30]等方面开展了大量研究,目前也取得了较好的进展。但是针对该类物质的整个代谢调控途径还需进一步的深入研究。本研究中不同烟草类型、品种主要腺毛分泌物的鉴定结果,也为后续该类物质代谢调控关键基因的挖掘提供了参考。
本研究中Basma、红花大金元、BX1、BX2、Beinhart1000-1等这5个品种西柏三烯二醇和蔗糖酯总含量较高,烤烟以BX2西柏三烯二醇含量相对较高,远高于供试品种的平均水平,这些品种可在烤烟腺毛分泌物改良育种中作为亲本利用。特别是含有Ⅲ-Ⅵ型蔗糖酯的BX1等烤烟品种与晒烟青梗的鉴定获得,可有效解决以往利用香料烟和雪茄烟向烤烟中导入这些特异成分时,因农艺、烤性等不利性状连锁难以打破致使育种改良进程缓慢的问题。同时,筛选的高腺毛分泌物品种,也可在烟用香精香料的提取以及腺毛分泌物生物活性研究中利用。本研究中香料烟Samsun,各类表面分泌物含量相对较低,这与以往报道不符[31-32],原因可能与栽培措施和土壤类型有关。据前人研究报道,香料烟适于种植在有机质少,肥力不高,土层薄的沙土地上种植,而本研究所用品种均种植于棕壤土。此外,也可能是Samsun植株叶片密集且较小,取样时其顶部4~6叶位叶片过小,难以取样,取样部位下移至10~12叶位(从顶端数)所致。本研究中TI1406腺毛分泌二萜和糖酯总量较低,与以往报道结果一致,原因可能是非分泌型腺毛内物质的合成积累较少。
本研究及国内其它相关研究均表明[28],K326的表面分泌物中致香前体物相对较低。而K326是国内公认的香气质较好,香气量较高的品种,原因可能是表面分泌物的致香前体物仅是品种总体香气物质的一小部分。据作者课题组对60份烤烟种质的烤后烟叶八大类致香物质的检测结果,K326的总致香物质含量比较高(内部资料,待发表),这些可能是其香气品质较好的物质基础。本试验由于无腺型品种TI1112未出苗,所以本研究未能验证无腺型腺毛是否有二萜和糖酯合成,后续可继续就该种质开展相关验证,验证结果将对二萜和糖酯的合成部位研究具有重要指导意义。本研究取材时以鲜烟叶为研究对象,避免了后续调制、分级取样等环节可能对物质含量造成的影响,从而尽可能的保障了检测结果的准确性。此外,本研究所用的各类型烟草品种资源数量还比较有限,还需加大烤烟及各类优异种质资源的表面分泌物鉴定力度,为腺毛分泌物的烤烟品种改良提供可用种质。
4 结论
不同类型烟草腺毛主要分泌物比较分析表明,在12份检测品种中,西柏三烯二醇(CBT-diols)是西柏烷二萜的主要物质形式,且其在烤烟品种中含量相对较高;所有检测品种中均含有α-CBT-diols和β-CBT-diols,两者的比值变化范围为1.58~2.32;所有检测品种中共检测出5个蔗糖酯类型,可依据蔗糖酯类型的有无和含量的多少将检测种质分为Ⅰ-Ⅱ型蔗糖酯较多和Ⅲ-V型蔗糖酯较多2个大类。普通烤烟翠碧1号、K326、红花大金元、BX2、NC2326,白肋烟KY14、T11406为Ⅰ-Ⅱ型糖酯较多类,香料烟Basma、Samsun,雪茄烟Beinhart1000-1,烤烟BX1,晒烟青梗这5个品种为Ⅲ-V型蔗糖酯较多类。总体上看,Basma、Beinhart1000-1、红花大金元、BX1、BX2这5个品种腺毛主要分泌物含量较高,可提供烟草香气品质改良育种或表面活性物质提取利用。
[1] 李霞,蔡恒,杨超,等.烟叶腺毛研究进展[J].中国农学通报,2008,24(4):261-264.LI Xia,CAI Heng,YANG Chao,et al.Advances in research on tobacco glandular hair[J].Chinese Agricultural Science Bulletin,2008,4(4):261-264
[2] 戴维斯,尼尔森编.烟草-生产,化学和技术[M].化学工业出版社,2003.DAVIS D L,NIELSEN M.Tobacco-Production,Chemistry and Technology[M].Chemical Industry Press,2003.
[3] LIN Y,WAGNER G J.Surface disposition and stability of pestinteractive,trichome-exuded diterpenes and sucrose esters of tobacco[J].J Chem Ecol,1994,20(8):1907-1921.
[4] Severson R F,Johnson A W,Jackson D M.Cuticular constituents of tobacco:Factors aff ecting their production and their role in insect and disease resistance and smoke quality[C]// Tobacco Chemists'Research Conference.1985.
[5] ROBERTS D L.Natural tobacco flavor[J].Recent CBT-diolsobsci,1988.
[6] 向章敏,周淑平,耿召良.烟叶表面化学成分的分析研究进展[J].西南农业学报,2015,28(3):1395-1398.XIANG Zhangmin,ZHOU Shuping,GENG Shaoliang.Research progress of chemical compositions on tobacco leaves[J].Southwest China Journal of Agricultural Sciences,2015,28(3):1395-1398.
[7] Lange B M,Croteau R.Isoprenoid biosynthesis via a mevalonateindependent pathway in plants:cloning and heterologous expression of 1-deoxy-D-xylulose-5- phosphate reductoisomerase from peppermint[J].Archives of Biochemistry &Biophysics,1999,365(1):170-174.
[8] 李伟.烟草叶面腺毛密度和分泌物量的变异与遗传特性[D];郑州:河南农业大学,2004.LI Wei.Variation and genetic characteristics of leaf gland density and secretion in tobacco leaves[D].Henan Agricultural University,2004.
[9] 刘兴祥.解析我国烟草香精香料的研究与应用[J].中国农业信息,2014,(7):247.LIU Xingxiang.Research and application of tobacco flavors and fragrances in China[J].China Agricultural Information,2014,(7):247.
[10] 叶荣飞,赵瑞峰.我国烟草香精香料的研究现状[J].清远职业技术学院学报,2011,04(3):34-37.YE Rongfei,ZHAO Ruifeng.Research status of tobacco flavors and fragrances in China[J].Journal of Qingyuan Vocational and Technical College,2011,04(3):34-37.
[11] 余金恒.许明忠,黄锋林,等.烟用香精香料物质研究进展[J].河南农业科学,2011,40(2):16-18,24.YU Jinheng,XU Mingzhong,HUANG Fenglin,et al.Advances in materials research of tobacco flavors and fragrances[J],Journal of Henan Agricultural Sciences,2011,40(2):16-18,24.
[12] HAWTHORNE D J,SHAPIRO J A,TINGEY W M,et al.Trichome-borne and artificially applied acylsugars of wild tomato deter feeding and oviposition of the leafminer Liriomyza trifolii[J].Entomologia Experimentalis Et Applicata,1992,65(1):65-73.
[13] RODRIGUEZ AE,TINGEY WM,MUTSCHLER MA.Acylsugars of lycopersicon pennellii deter settling and feeding of the green peach aphid(Homoptera:Aphididae)[J].Journal of Economic Entomology,1993,86(86):34-39.
[14] LIEDL B E,LAWSON D M,WHITE K K,et al.Acylsugars of wild tomato lycopersicon pennellii alters settling and reduces oviposition of bemisia argentifolii(Homoptera:Aleyrodidae)[J].Journal of Economic Entomology,1995,88(3):742-748.
[15] ALBA J M,MONTSERRAT M,FERN NDEZMU OZ R.Resistance to the two-spotted spider mite(Tetranychus urticae)by acylsucroses of wild tomato(Solanum pimpinellifolium)trichomes studied in a recombinant inbred line population[J].Experimental and Applied Acarology,2009,47(1):35-47.
[16] HILL K,RHODE O.Sugar-based surfactants for consumer products and technical applications[J].Fett/lipid,1999,101(1):25-33.
[17] 冯琦.烟草腺毛发育及类萜代谢研究[D].河南农业大学,2013.FENG Qi,Study on Glandular Hair Growth and Terpene Metabolism of Tobacco[D].Henan Agricultural University,2013.
[18] SCHILMILLER A L,MOGHE GD,FAN P,et al.Functionally divergent alleles and duplicated Loci encoding an acyltransferase contribute to acylsugar metabolite diversity in Solanum trichomes[J].The Plant cell,2015,27(4):1002-1007.
[19] SCHILMILLER A L,LAST R L,PICHERSKYE.Harnessing plant trichome biochemistry for the production of useful compounds[J].Plant Journal,2008,54(4):702-711.
[20] SCHILMILLER A L,CHARBONNEAU A L,LAST R L.Identification of a BAHD acetyltransferase that produces protective acyl sugars in tomato trichomes[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(40):16377 -16382.
[21] SCHILMILLER AL,MINER DP,LARSON M,et al.Studies of a biochemical factory:tomato trichome deep expressed sequence tag sequencing and proteomics[J].Plant physiology,2010,153(3):1212-1223.
[22] 任夏,燕志强,金辉,β-西柏三烯二醇对拟南芥的化感效应及其作用机理研究[J].西北植物学报,2017,37(4):713-718.REN Xia,YAN Zhiqiang,JIN Hui,Study on the allelopathic eff ect of β - cyproterone on Arabidopsis thaliana and its mechanism[J].Journal of Northwest Botanical Sciences,2017,37(4):713-718.
[23] 段苏珍,杜咏梅,侯小东,等.烟草提取物对十一种植物病原真菌的抑制作用[J].天然产物研究与开发,2015,27(3):470-474,484.DUAN Suzhen,DU Yongmei,HOU Xiaodong,et al.Inhibitory effects of tobacco extract on eleven phytopathogenic fungi[J].Research and Development of Natural Products,2015,27(3):470-474,484.
[24] 蔡莉莉,谢复炜,刘克建,等.香料烟中蔗糖酯的气相色谱/质谱分析[J].烟草科技,2009,(3):40-44.CAI Lili,XIE Fuwei,LIU Kejian,et al.Analysis of sucrose ester in oriental tobacco by gas chromatography/mass spectrometry[J].Tobacco Science&Technology,2009,(3):40-44.
[25] Severson R F,Arrendale R F,Chortyk O T,et al.Isolation and characterization of the sucrose esters of the cuticular waxes of green tobacco leaf.[J].Journal of Agricultural &Food Chemistry,1985,33(5):870-875.
[26] VONTIMITTA V,DANEHOWER DA,STEEDE T,et al.Analysis of a Nicotiana tabacum L.genomic region controlling two leaf surface chemistry traits[J].Journal of Agricultural &Food Chemistry,2010,58(1):294-300.
[27] WANG E,WANG R,DEPARASIS J,et al.Suppression of a P450 hydroxylase gene in plant trichome glands enhances naturalproduct-based aphid resistance[J].Nature biotechnology,2001,19(4):371-374.
[28] 吴云平,潘文杰,李章海,等.不同品种烤烟鲜叶表面提取物主要成分比较[J].中国农学通报,2011,27(2):353-359.WU Yunping,PAN Wenjie,LI Zhanghai,et al.Comparison of Major Cuticular Components from Cured Leaves of Diff erent Fluecured Tobacco Varieties [J].Chinese Agricultural Science Bulletin,2011,27(2):353-359.
[29] 王冬,张小全,杨铁钊,等.类西柏烷二萜代谢机理及调控研究进展[J].中国烟草学报,2014,20(3):113-118.WANG Dong,ZHANG Xiaoquan,YANG Tiezhao,et al.Advances in metabolic mechanism and regulation of cetyl - like diterpenoids[J].Chinese Journal of Tobacco,2014,20(3):113-118.
[30] 何峰,西柏三烯-4,6-二醇的分离纯化及热裂解和烟草中HPLC分析方法研究[D].郑州轻工业学院,2015.HE Feng,Separation,Purification and Pyrolysis of Ciprotermine - 4,6 - Diol and HPLC Analytical Methods in Tobacco[D].Zhengzhou Institute of Light Industry,2015.
[31] SALLAUD C,GIACALONE C,TPFER R,et al.Characterization of two genes for the biosynthesis of the labdane diterpene Z-abienol in tobacco(Nicotiana tabacum)glandular trichomes[J].Plant Journal,2013,74(4):1-17.
[32] 王伟,孔光辉,李佛琳,等.烤烟烟叶腺毛及其分泌物研究进展[J].中国农学通报,2007,23(2):251-254.WANG Wei,KONG Guanghui,LI Folin,et al.Research progress on glandular hair and its secretions in flue-cured tobacco leaves[J].Chinese Agricultural Science Bulletin,2007,23(2):251-254.
