草鱼呼肠孤病毒生长特性研究
2018-03-09袁雪梅姚嘉赟郝贵杰蔺凌云潘晓艺尹文林沈锦玉
袁雪梅,姚嘉赟,郝贵杰,蔺凌云,徐 洋,潘晓艺,尹文林,沈锦玉
(农业部淡水渔业健康养殖重点实验室,浙江省鱼类健康与营养重点实验室,浙江省淡水水产研究所,浙江湖州 313001)
草鱼(Ctenopharyngodon idella)是我国的主要淡水养殖品种。然而各种疾病的暴发严重阻碍了草鱼养殖业的发展,如出血性疾病、细菌性肠炎和细菌性败血症,给草鱼养殖户造成了巨大经济损失[1-2]。草鱼呼肠孤病毒(Grass carp reovirus,GCRV)是我国第1株分离鉴定的鱼类病毒,也是水生呼肠孤病毒属中致病力最强的毒株[3-4]。由其引起的草鱼出血病是草鱼养殖过程中的最大病害,死亡率高达60% 以上,严重影响了草鱼养殖业的健康发展[5]。因其危害性大、流行范围广、发病季节长,使该病一直为我国鱼类病毒病的研究重点[4,6]。学者们就该病毒的流行病学、生物化学及分子生物学等进行了研究[7-8]。然而国际上对GCRV的研究与哺乳动物及禽呼肠孤病毒相比还有很大差距。研究病毒在体内的复制增殖规律可进一步揭示GCRV分子致病机理,从而为该病防治奠定基础。目前对于该病尚无有效治疗方法,主要依靠疫苗预防。我国从20世纪70年代开始研究草鱼出血病疫苗,研制出的组织疫苗和细胞疫苗在生产上收到了较好效果[9]。目前在疫苗生产过程中多使用细胞来增殖病毒。GCRV在细胞上繁殖速度较快,一般培养2~3 d即可观察到细胞病变(Cytopathological effect,CPE)[10]。当前多使用CIK细胞来制备细胞疫苗,在病毒培养过程中多通过观察细胞病变来收获病毒。但这种方式并不能准确反映病毒在细胞中的增殖规律,往往错过最佳收获病毒时期,致使疫苗免疫效果不理想而造成经济损失。Real-time PCR技术具有灵敏度高、操作简单、结果直观、重复性好、特异性强等优点,能够精确分析病毒在细胞中的增殖规律,从而为生产细胞苗提供依据[11]。为此,本研究利用建立的Real-time PCR方法,对GCRV在CIK细胞及草鱼体内的增殖复制进行动态监测,从而为GCRV致病机理研究和细胞灭活疫苗制备奠定基础。
1 材料与方法
1.1 试剂材料
M199培养基、胰酶:Gibco公司产品;胎牛血清:购自四季青公司;M-MLV反转录试剂盒、Taq DNA聚合酶、dNTPs、T载体:购自TAKARA公司;Trizol Reagent:购于Invitrogen公司;DNA Marker:购自鼎国生物公司;SYBR Green荧光染料:购自TOYOBO公司;质粒抽提试剂盒、凝胶回收试剂盒:购自爱思进公司;其他试剂均为国产分析纯。
1.2 细胞、毒株及试验鱼
草鱼肾细胞系CIK、GCRV873由本实验室保存。用于本研究的草鱼购自浙江省淡水水产研究所苗种基地,体重为10~15 g,分别置于4个体积约300 L自动充气水循环系统圆柱形水缸中饲养,每缸放40尾,饲养2周,水温保持(26±1)℃;试验期间每天投喂颗粒性饵料2次,投饵之前先吸污换水。
1.3 Real-time PCR检测方法的建立
1.3.1引物设计 根据GenBank中GCRV 873毒株 VP6蛋白编码基因序列,应用Primer 5软件设计特异性荧光定量引物VP6-U及VP6-L,同时针对草鱼内参基因β-actin序列设计特异性引物。引物序列(表1)由南京金斯瑞生物科技有限公司合成。

表1 GCRV荧光定量PCR引物序列
1.3.2标准品制备 收集 GCRV 873毒株CIK细胞培养物,按照Trizol说明书抽提RNA;用随机引物反转录获得cDNA后,分别用引物VP6-U/VP6-L和β-actin-U/β-actin-L扩增病毒VP6基因及内参基因β-actin。反应程序为:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸20 s,30个循环;最后72 ℃延伸10 min。扩增产物经回收纯化后,克隆于pMD-18T载体,并将阳性克隆送南京金斯瑞公司测序确认。对测序正确的阳性克隆抽提质粒,测定浓度,按公式[11]计算质粒标准品的拷贝数:拷贝数=(质量/分子量)×6.02×1023。
1.3.3灵敏性试验及标准曲线绘制 对重组质粒10倍梯度稀释后,进行荧光定量PCR扩增。参照SYBR Green荧光定量试剂盒说明书,分别取稀释好的重组质粒1 μL为模板进行PCR扩增。反应体系为:2×SYBR GreenⅠPCR反应混合液10 μL,10 pmol/L的上、下游引物各1 μL,加ddH2O补足20 μL。反应采用三温循环,程序为:95 ℃预变性 10 s;95 ℃变性 5 s,56 ℃退火 30 s;72 ℃延伸15 s,40个循环,并收集荧光信号。
1.3.4特异性试验 分别取GCRV 873毒株、传染性造血器官坏死症病毒(IHNV)、鲤鱼春季病毒血症病毒(SVCV)核酸,以其为模板进行Realtime PCR扩增,20 μL体系加模板1 μL,并设立阴性对照。
1.4 病毒培养与滴度测定
将保存于液氮中的GCRV 873毒株接种于长成致密单层的CIK细胞,28 ℃吸附1 h;吸弃病毒液,加入与培养液等量的维持液(含2%FBS的M199),28 ℃恒温培养。每日观察细胞形态,直至出现80%细胞病变,收取病毒液进行滴度测定。GCRV873的细胞培养液经反复冻融后作连续10倍梯度稀释,取10-3~10-108个稀释度,每个稀释度取100 µL的病毒液接种于96孔板上的单层CIK细胞;每稀释度接种8孔,28 ℃孵育 1 h 后弃去,加入维持液继续培养,并设正常细胞为对照,连续观察7 d。根据病变情况,按Karber氏法计算半数组织培养感染剂量(TCID50)。lgTCID50=L+ d(s−0.5)。式中:L为病毒最低稀释度的对数,d为组距(稀释系数),s为各组病变数与接种数比值之和[12]。
1.5 GCRV 873株在CIK细胞上的生长特性研究
CIK细胞培养于24孔细胞板,待细胞长至致密单层时,弃去培养液,用1×104TCID50/mL,每孔100 μL的GCRV 873毒株感染细胞。感染后分别 于 0、2、4、8、10、12、24、36、48、72 h 收取病毒细胞培养液,应用建立的Real-time PCR方法检测定各时间点的病毒RNA增殖情况,并通过对各个时间点病毒滴度的测定,检测病毒拷贝数,同时分别显微镜观察0、12、24、36、48、72 h 的CIK病变情况。
1.6 GCRV 873株在草鱼体内的生长特性研究
试验鱼用MS222溶液(1 mg/L)麻醉,每尾草鱼腹腔注射TCID50为1×106的GCRV 0.1 mL,对照组每尾注射同等剂量的灭菌生理盐水。于注射后1、2、3、5、7 d取样,每组随机选取4尾试验鱼,用MS222(1 mg/L)麻醉后,取其肝脏、脾脏、肾脏,用Trizol提取各组织RNA后反转录为cDNA,应用Real-time PCR方法测定肝脏、脾脏、肾脏中的病毒含量。
1.7 数据分析
荧光定量PCR反应结束后,查看扩增曲线和Ct值等;通过标准曲线换算得到样品中内参基因β-actin和病毒基因组的绝对拷贝数,再经β-actin校正得到相应的相对拷贝数。
2 结果
2.1 Real-time PCR检测方法的建立
用特异性荧光定量引物VP6-U/VP6-L对病毒核酸进行PCR扩增,将得到的产物进行琼脂糖凝胶电泳分析,发现扩增片段与预期大小(102 bp)一致,且特异性好(图1)。将扩增片段克隆到pMD-18T后送测序,发现序列与Genebank上公布的序列一致。从不同稀释度的标准品Real-time PCR扩增反应(图2)可以看出,从1×101~1×106个拷贝数的质粒扩增曲线均呈“S”型,且与指数增长期的扩增曲线平行,反映出PCR的扩增效率相近,检测灵敏度为1×101个病毒粒子。以质粒拷贝数的对数为X轴,以Ct值为Y轴,根据两者的相关性得到标准曲线Y=3.237×log(X)+39.63,其相关系数R2为0.999,扩增效率为103.7%。特异性试验结果显示(图3),GCRV病毒核酸扩增曲线呈“S”型,而IHNV、SVCV及阴性对照均没有扩增曲线,说明所建立的检测方法特异性好。

图1 引物VP6-U、VP6-L PCR扩增结果
2.2 GCRV 873株在CIK细胞中的生长特性
GCRV 873株吸附CIK细胞1 h后,分别在0、2、4、8、10、12、24、36、48、72 h 收取细胞病毒液。对各个时间点病毒滴度及RNA水平进行检测(图3),并通过显微镜观察不同时间点细胞病变情况(图4)。由图3可以看出病毒在感染CIK细胞0~12 h期间,病毒RNA水平很低,上升不明显,病毒滴度处于较低水平,上升趋势也不明显;12~24 h期间,病毒RNA和病毒滴度开始明显上升;24~72 h期间,病毒RNA急剧上升,而病毒滴度在24~48 h期间明显上升,48 h后趋于平稳,72 h时病毒滴度达到最高,为106.75TCID50/mL。GCRV 873株感染CIK后12 h时出现少量细胞聚集;24 h时,细胞聚集增多,出现空斑现象;36 h时,空斑变大;48 h时,细胞大量脱落;72 h时,细胞基本已脱落,只有零星细胞附着于板上(图5)。

图2 GCRV重组质粒荧光定量PCR扩增反应

图3 GCRV荧光定量PCR特异性检测的扩增反应
2.3 GCRV 873株在草鱼体内的复制情况
GCRV 873株感染草鱼后,其肝、脾、肾中的病毒RNA拷贝数变化如图6所示。3个组织中的病毒RNA均呈先升后降趋势,其中肝脏中的病毒RNA峰值位于感染后3 d,脾脏和肾脏峰值位于感染后2 d。3种组织中,病毒RNA峰值最高的为肾脏,肝脏次之,脾脏最低;肝脏、肾脏和脾脏中的病毒RNA分别在至感染后7、6、4 d时下降到趋近于零的水平。

图4 GCRV 873株感染CIK细胞后病毒滴度与RNA复制水平变化规律
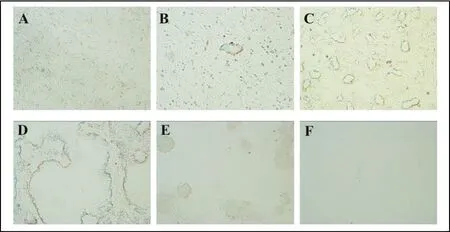
图5 GCRV 873株感染CIK细胞后细胞病变情况
3 讨论
本研究从病毒RNA拷贝数、子代病毒含量及细胞病变3个方面综合分析GCRV在CIK细胞中的增殖过程。试验结果表明,GCRV在感染CIK细胞的早期病毒RNA拷贝数及病毒滴度均处于较低水平,说明这一时期的病毒多为残余的原代病毒及最先释放出来的子代病毒;24~72 h期间,病毒RNA水平迅速上调,呈现对数增长,而病毒滴度在24~48 h期间呈明显上升,之后趋于平稳;对照48 h的细胞CPE发展完全,说明细胞被完全裂解,胞内病毒得以释放,使病毒滴度趋于平稳。曾令兵等[13]利用组织培养微量滴定系统,研究GCRV-854毒株在CIK细胞上的繁殖过程,其动态曲线与本研究相似,但出现快速增殖的时间较本研究晚,说明不同毒株感染细胞的能力存在差异。邹桂平等[14]在电镜下观察到GCRV在感染CIK细胞4 h以内出现脱去部分外层衣壳的不完整病毒颗粒,感染8 h时浆胞内出现大量亚病毒颗粒,无外层蛋白结构,感染12~16 h后出现成熟的病毒粒子。丁清泉等[15]发现GCRV在感染细胞12 h后即开始增殖,24~72 h大量增殖,使细胞产生典型的细胞病变效应,5 d左右达到最大增殖,此时病毒的滴度最高,以后逐渐平缓。分析病毒在细胞中的增殖过程,不仅反映出病毒的生长特性,还指示出收获细胞培养的病毒材料的最佳时间。
应用Real-time PCR技术,实时监测GCRV在草鱼体内的病毒拷贝数,为精确分析病毒在鱼体中的增殖过程提供基础数据。本试验采用的毒株GCRV 873株为1型。该毒株在体外细胞中培养可使细胞产生明显病变,但是草鱼感染后未出现发病死亡情况,而其肝、脾、肾中的病毒RNA水平出现短期上升后下降到对照水平的结果,也正与无发病死亡情况相符。殷亮[16]研究发现GCRV HZ08株在感染稀有鮈鲫后,脾脏和肾脏中的病毒RNA水平呈现先升后降趋势,与本研究结果一致。丁清泉等[15]发现经人工感染GCRV的鱼体肾脏组织细胞内,存在无外衣壳的未成熟病毒。毛树坚等[17]观察草鱼出血病的病理切片发现在肝脏、肌肉、肾脏、脾脏、鳃等鱼体组织中含有大量的病毒颗粒。在本研究对比3种组织中病毒RNA的含量,发现肾脏中的含量最高,提示在取样检测时,可优先考虑肾脏组织。

图6 GCRV 873株感染草鱼后不同组织中病毒RNA复制水平的变化规律
4 结论
本研究显示:GCRV 在感染CIK细胞12 h后病毒RNA和病毒滴度开始上升;24~72 h期间,病毒RNA急剧上升,病毒滴度则在24~48 h内明显上升,48 h后趋于平稳,至72 h,病毒滴度达到最高,为106.75TCID50/mL。在感染CIK后36 h,所有细胞均已感染,72 h时,细胞基本上脱落。GCRV感染草鱼后,均能在其肝、脾、肾中检测到病毒,且病毒RNA均呈先升后降趋势;肾脏中的病毒RNA含量最高,因此应优先采集肾脏组织进行检测。
[1] 方 勤,丁清泉,汪亚平,等.两株水生呼肠孤病毒部分特性的比较[ J]. 中国病毒学,2003,18(5):464-467.
[2] AHNE W. Viral infectious of aquatic animals with special reference to asian aquaculture[J]. Annual review of fish disease,1994,4:375-388.
[3] 柯丽华,方 勤,蔡宜权.一株新的草鱼出血病病毒分离物特性[J]. 水生生物学报,1990,14(2):153-159.
[4] 陈燕新,江育林. 草鱼出血病病毒形态结构及其理化特性的研究[J]. 科学通报,1983,28:1138-1140.
[5] 毛树坚,邵建忠,杭绮,等. 草鱼出血病的病原研究[J]. 水产学报,1989,13(1):1-4.
[6] 中国科学院武汉病毒研究所,中国水产科学院长江水产研究所,长沙市分所草鱼出血病病毒研究协作组.草鱼出血病病毒的电子显微镜观摩初报[J]. 淡水渔业,1983(3):39.
[7] 方勤,朱作言. 水生呼肠孤病毒研究进展[J]. 中国病毒学,2003,18(1):82-86.
[8] 王 炜,赵桃英,方 如,等. 草鱼出血病病毒多肽的免疫原性[J]. 中国病毒学,1995,10(2):166-168.
[9] 叶雪平,杨广智,罗毅志,等. 草鱼出血病细胞培养灭活疫苗生产工艺的比较[J]. 中国兽药杂志,1998,32(4):9-12.
[10] 肖雪,颜其贵,欧 洋,等. 草鱼呼肠孤病毒的研究进展[J]. 水利渔业,2006,26:107-109.
[11] 周 勇,曾令兵,范玉顶,等. 草鱼呼肠孤病毒TaqMan real-time PCR检测方法的建立[J]. 水产学报,2011(35):774-779.
[12] 郭元吉,程小雯. 流行性感冒病毒及其实验技术[M].北京:中国三峡出版社,1997:109-115.
[13] 曾令兵,贺 路,左文功. 草鱼出血病病毒854株的理化、生物学特性及基因组结构[J].水产学报,1998,22(3):279-282.
[14] 邹桂平,方 勤. 草鱼呼肠孤病毒在 CIK细胞中复制及形态发生的研究[J]. 中国病毒学,2000,15(2):188-192.
[15] 丁清泉,余兰芬,王学兰,等. 草鱼出血病病鱼主要器官的超薄切片观察及感染力的比较[J]. 水产学报,1990,14(1):66-69.
[16] 殷 亮. 三株不同基因型草鱼呼肠孤病毒生物学特性的差异分析[D]. 上海:上海海洋大学,2014:27-31.
[17] 毛树坚,杭 绩,陈汉民,等. 草鱼出血病两种病原病毒的细胞病理学观察[J]. 海洋与湖沼,1988,l9(5):435-438.
