两种固相萃取柱在乙酰氨基阿维菌素药动学前处理中的比较
2018-03-09张振东刘希望申栋帅李剑勇
张振东,刘希望,马 宁,申栋帅,李剑勇
(中国农业科学院兰州畜牧与兽药研究所,农业部兽用药物创制重点实验室,甘肃省新兽药工程重点实验室,甘肃兰州 730050)
固相萃取(Solid-phase extraction,SPE)是近年发展起来一种样品预处理技术,由液固萃取和液相色谱技术相结合发展而来。其原理是利用组分与吸附剂(固定相)间的选择性吸附与选择性洗脱过程,达到分离、净化和富集的目的[1]。SPE技术与传统的液液萃取法相比有以下优点:(1)在样品分离、纯化和浓缩时,可以提高药物回收率;(2)选择性好,将药物与干扰组分更加有效分离;(3)可实现多样品平行处理,便于自动化,有较高的重现性,有助于提高检测灵敏度;(4)SPE柱的商品化,使其萃取操作更简单、省时[2]。SPE最普遍使用的形式是SPE柱。SPE柱是一种填充好固定相的短色谱柱。当液体样品通过固相吸附层时,基体被除去,待测物被富集,然后用少量溶剂(6~10 mL)洗脱回收待测物[3]。乙酰氨基阿维菌素(Eprinomectin,EPR)是高效、广谱、低残留的兽用最新一代祛虫药物,主要用于防治畜类(特别是产乳期)的虱、螨、蝇等各种体内外寄生虫,应用于奶牛和肉牛的休药期仅为1 d[4]。由于其对家畜体内外各种寄生虫的极高活性,以及在乳品中极低的分配系数,使其成为第一个可用于各种家畜任何生长期的杀虫剂,是一种防治家畜体内外各种寄生虫的首选药剂。EPR脂溶性较高,对其提取和净化较为困难。EPR在动物血液中残留时间较长,因此在动物血液检测中常先用SPE柱对样品进行净化,再经过衍生化,最后用超高效液相色谱-荧光检测器(HPLC-FLD)进行分析检测[5]。本试验通过比较两种SPE柱的EPR净化、萃取效果,为后期EPR的药物代谢动力学研究提供参考。
1 材料与方法
1.1 材料
1.1.1标准品 乙酰氨基阿维菌素(B1a含量为95.4%,B1b含量为2.37%,批号K0471411):中国兽医药品监察所提供。
1.1.2主要试剂 乙睛、甲醇、色谱纯:賽默飞世尔科技(中国)有限公司产品;冰醋酸、分析纯:天津市大茂化学试剂厂生产;N-甲基吡咯烷酮(含量99%):美国Fisher Scientific公司产品;三氟乙酸酐(含量99%):美国Fisher Scientific公司产品;蒸馏水、屈臣氏蒸馏水:广州屈臣氏食品饮料有限公司生产;甲酸、质谱纯(含量98%):日本化成工业株式会社产品。
1.1.3主要仪器设备 高效液相色谱仪(Agilent-LC 1290II)、调速振荡器(VORTEX-2,GENIE®): 美 国 Scientific Industries公 司 产品;快速蒸发器(LABCONCO®PapidVap):美国LABCONCO公司产品;离心机(MULTIFUGEX3R):賽默飞世尔科技(中国)有限公司生产;SPE柱(Bond Elut C18、500 mg、6 mL):Agilent科技(中国)有限公司生产;SPE 柱(Sep-pak C18、500 mg、6 mL):Waters科技(上海)有限公司生产。
1.1.4主要溶液配制 衍生化A液:N-甲基咪唑+乙睛(2+7,v/v);衍生化B液:三氟乙酸酐+乙腈(2+7,v/v)。现配现用。标准储备液的配制:精密称取EPR 102 mg,配制成1.02 mg/mL的A标准储备液,20.4 μg/mL的B标准储备液,2.04 μg/mL的C标准储备液,−20 ℃避光保存。
1.2 方法
1.2.1色谱条件及参数 色谱柱:C18反相色 谱 柱(Eclipse plus C18,RRHD 1.8 μm,2.1 mm×100 mm);流动相:乙腈∶水(0.1%的甲酸)=90∶10;流速0.4 mL/min;激发波长365 nm;检测波长 463 nm;柱温35 ℃;进样量 20 μL;检测时间10 min。
1.2.2EPR标准溶液的衍生化与测定 取10 μL 2.04 μg/mL的C标准储备液于磨口的玻璃离心管中,在40 ℃快速蒸发器中吹干;在上述干燥样品中(装于磨口玻璃离心管中)加入200 μL衍生化试剂A液,震荡混匀1 min;加入200 μL衍生化试剂B液,震荡混匀1min;最后加入45 μL冰醋酸,迅速盖上盖,震荡混匀0.5 min。将整个具盖玻璃管置于65 ℃烘箱中衍生化反应30 min,室温放置12 min。用流动相定容至1 mL,混匀后过0.22 mm针筒滤膜,进行HPLC分析检测。共进行6次平行试验,对结果求平均值及相对标准偏差。
1.2.3血浆样品处理、SPE C18柱萃取、衍生化与测定 从−20 ℃中取出冷冻的空白胎牛血清,待其恢复至室温后,取样品0.5 mL,向其中加入10 μL 2.04 μg/mL的C标准储备液,涡旋3 min,静置30 s,然后加入3.5 mL甲醇震荡,混匀20 min,4 000 g离心20 min,合并上清液,提取2次。向上清中加入7 mL蒸馏水(约1∶1稀释),震荡混匀备用。此时应先依次使用3 mL甲醇、3 mL超纯水、3 mL 70%甲醇水溶液,对C18SPE柱进行平衡,然后将混匀后的液体通过C18SPE柱进行萃取,使用3 mL蒸馏水、3 mL 50%甲醇水溶液进行淋洗;使用洗耳球将SPE柱吹干后,使用6 mL甲醇,平均分3次,每次2 mL进行洗脱。将洗脱液收集在磨口的玻璃离心管中,40 ℃下用快速蒸发仪吹干。在上述干燥样品中(装于磨口玻璃离心管中)加入200 μL衍生化试剂A液,震荡混匀1 min,加入200 μL衍生化试剂B液,震荡混匀1 min,最后加入45 μL冰醋酸,迅速盖上盖,震荡混匀0.5 min。将玻璃盖盖紧;将整个具盖玻璃管置于65 ℃烘箱中衍生化反应30 min,室温放置12 min;用流动相定容至1 mL,混匀后过0.22 mm针筒滤膜,进行HPLC分析检测。对这两种SPE柱分别进行6次平行试验,求其平均绝对回收率及相对标准偏差。
1.2.4绝对回收率计算 绝对回收率=经SPE柱萃取的样品药物峰面积/药物标准品峰面积。
2 结果
2.1 EPR及其经不同SPE柱萃取后的衍生化
EPR及其经不同SPE柱萃取后的衍生化结果见表1。
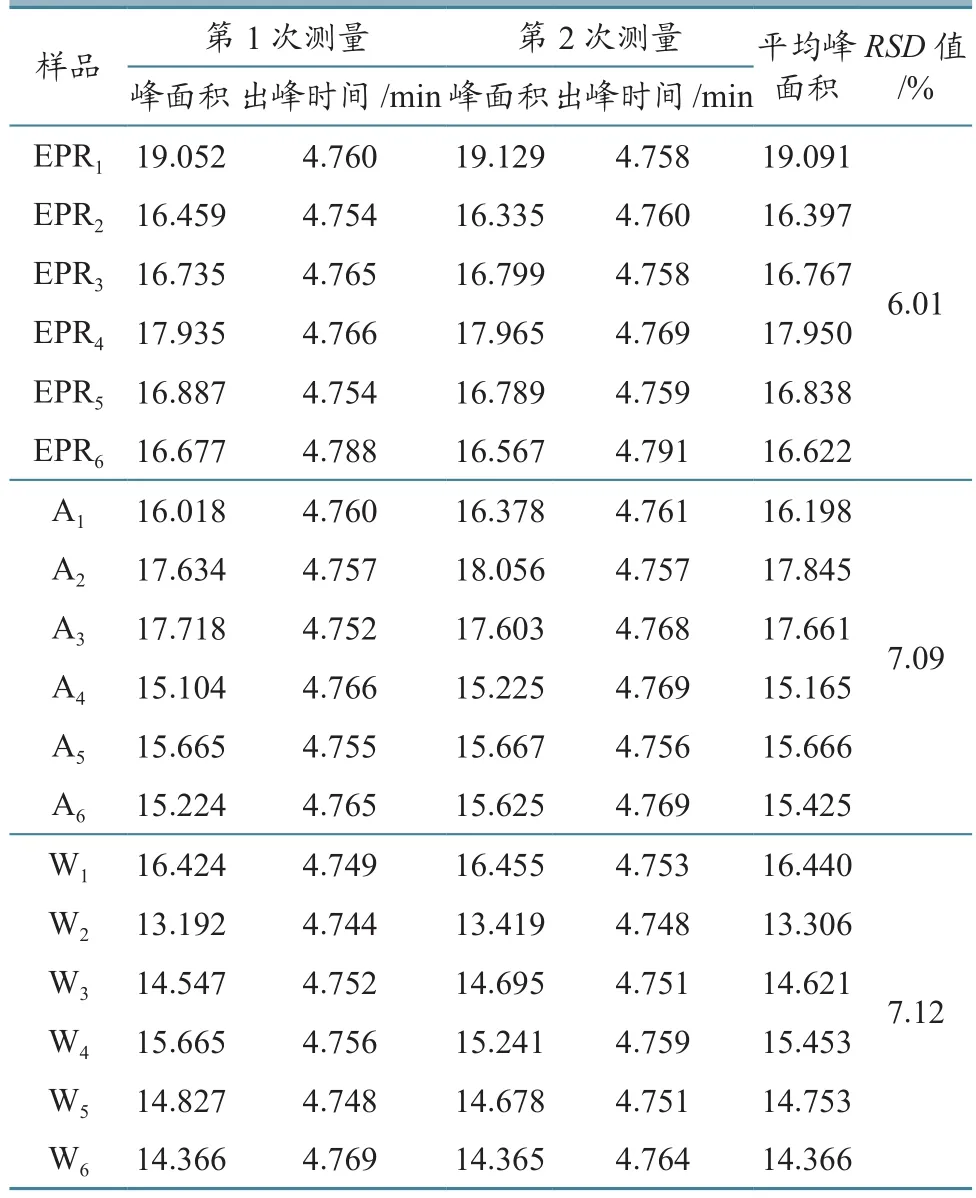
表1 EPR及EPR经不同SPE柱萃取后的衍生化结果
2.2 EPR衍生化峰图
由数据和图谱可得(图1、图2、图3、图4和图5),经Agilent公司的C18SPE柱萃取后,EPR峰形尖锐对称且无明显杂质峰,其平均绝对回收率为94.50%;经Waters公司的C18SPE柱萃取后,EPR峰形尖锐对称且无明显杂质峰,其平均绝对回收率为85.79%。Agilent公司的C18SPE柱与Waters公司的C18SPE柱净化效果相似,但是Agilent公司的C18SPE柱比Waters公司的C18SPE柱萃取EPR的效率更高。

图1 EPR标准溶液的衍生化
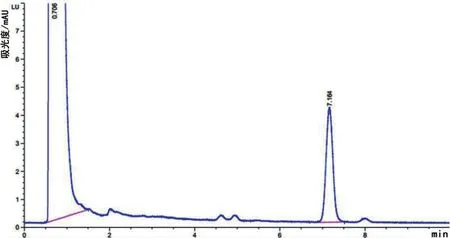
图2 Agilent C18 SPE柱-空白血浆衍生化
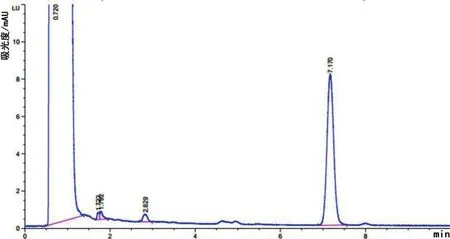
图3 Waters C18 SPE柱-空白血浆衍生化

图4 AgilentC18 SPE柱-EPR样品衍生化
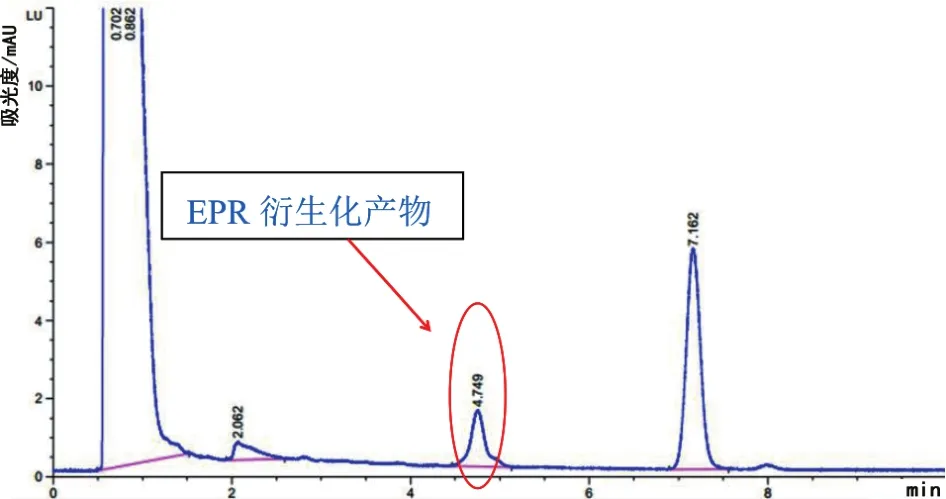
图5 Waters C18 SPE柱-PER样品衍生化
3 讨论
近年来,随着人们对EPR药物残留及代谢的深入研究,特别是在样品前处理中,越来越多的用到了SPE技术[6]。Nordlander等[7]使用C18SPE柱净化猪肌肉中的伊维菌素,以高效液相-荧光(HPLC-FLD)检测法进行测定。潘保良等[8]应用C18SPE柱净化技术,建立了绵羊血浆中伊维菌素HPLC-FLD检测法。刘迎贵等[9]应用C18SPE柱净化技术,建立了牛、羊、猪肉组织中的伊维菌素残留检测方法。文辉强等[10]在两种EPR浇泼剂在兔体内药代动力学的比较研究中,经过C18SPE柱净化,建立了一套完整的阿EPR浇泼剂HPLC-FLD检测法。高三玉等[11]在高效液相色谱法测定牛奶中EPR残留量研究中,利用C18SPE柱净化,应用HPLC-FLD检测法,建立了一种测定牛奶中EPR残留量的高效液相色谱方法。Dupuy等[12]等利用Agilent公司的C18SPE柱,对水牛血浆进行前处理,利用HPLC-FLD检测法研究了EPR浇泼剂在泌乳期水牛体内的药代动力学。Baoliang等[13]进行了EPR注射液在泌乳奶牛体内的药代动力学研究,将奶牛血浆经过Waters公司的C18SPE柱萃取后,以HPLC-FLD检测法绘制了药时曲线。Wen等[14]进行了EPR浇泼剂和口服糊剂在泌乳期奶牛体内的药物动力学研究,利用C18SPE柱前处理,以HPLC-FLD检测法绘制了两种剂型的药时曲线。
4 结论
本研究表明,Agilent公司和Waters公司的C18SPE柱对EPR的净化效果相似,但Agilent公司的C18SPE柱萃取效率更高。SPE技术在药物代谢动力学中的应用越来越广泛,筛选出一种优质SPE柱是进行药物代谢动力学试验的良好开端,也是试验成功的重要保障。
[1] 张启迪,邹明,刘文华,等. 阿维菌素残留检测中不同SPE柱净化效果的比较研究[J]. 中国动物检疫,2007,24(12):29-30.
[2] 杨二爽,李小莲,沈雁,等. 高效液相色谱法测定乙酰氨基阿维菌素的含量[J]. 黑龙江畜牧兽医,2017(12):162-164.
[3] 胡启飞. 伊维菌素原位凝胶植入剂的制备和家兔体内过程初步研究[D]. 重庆:西南大学,2009.
[4] 郑婷. 乙酰氨基阿维菌素/PLGA缓释微球的研究[D].河北:河北科技大学,2012.
[5] 徐会平,冯素香,李建生,等. SPE-HPLC法测定大鼠血浆中的大黄素及药物动力学研究[J]. 中成药,2011,33(7):1230-1232.
[6] 姚秋萍,俞道进,李健,等. 固相萃取-高效液相色谱法测定兔血浆中山奈素的含量[J]. 福建农林大学学报(自然版),2010,39(2):177-180.
[7] NORDLANDER I,JOHNSSON H. Determination of ivermectin residues in swine tissues--an improved clean-up procedure using solid-phase extraction[J].Food additives and contaminants,1990,7(1):79-82.
[8] 潘保良,汪明,王玉万. 绵羊血浆阿维菌素荧光高效液相色谱检测法的建立[J]. 中国兽医科学,2002,32(11):8-11.
[9] 刘迎贵,苏亚,韩琪,等. 牛羊猪肉组织中伊维菌素残留量检测HPLC法的改进[J]. 中国兽药杂志,2007,41(7):28-31.
[10] 文辉强,王芳菲,杨振中,等. 两种乙酰氨基阿维菌素浇泼剂在兔体内药代动力学的比较研究[C]//中国畜牧兽医学会家畜寄生虫学分会. 中国畜牧兽医学会家畜寄生虫学分会第六次代表大会暨第十次学术研讨会论文集. 兰州:中国畜牧兽医学会家畜寄生虫学分会,2009,15-16.
[11] 高三玉,周芷锦,罗成江,等. 高效液相色谱法测定牛奶中乙酰氨基阿维菌素的残留量[J]. 畜牧与饲料科学,2017,38(4):14-16.
[12] DUPUY J,SUTRA J F,ALVINERIE M,et al. Plasma and milk kinetic of eprinomectin and moxidectin in lactating water buffaloes(Bubalus bubalis)[J].Veterinary parasitology,2008,157(3/4):284-290.
[13] BAOLIANG P,YUWAN W,ZHENDE P,et al.Pharmacokinetics of eprinomectin in plasma and milk following subcutaneous administration to lactating dairy cattle[J]. Veterinary research communications,2006,30(3):263-270.
[14] WEN H,PAN B,WANG Y,et al. Plasma and milk kinetics of eprinomectin following topical or oral administration to lactating Chinese Holstein cows[J].Veterinary parasitology,2010,174(1/2):72-76.
