小鼠肝炎病毒抗体ELISA和IFA检测试剂盒真实性评价
2018-03-09张志妮郭中敏
张志妮,郭中敏,严 楚
(1. 中山大学,广东广州 510006;2. 广州市白云区动物卫生监督所钟落潭镇分所,广东广州 510550)
小鼠肝炎病毒((Mouse hepatitis virus,MHV)是一种高传染性,可造成小鼠肝炎并在小鼠群中剧烈暴发并遍及全球的病毒[1],属日冕冠状病毒科冠状病毒属,有囊膜,线性不分段的单股正链RNA病毒[1-2],主要经过空气和接触传播。在自然界中,小鼠是其唯一易感动物。该病毒多数情况下引起亚临床感染或慢性感染,应激或机体抵抗力下降时可引起急性发病和死亡,是对实验小鼠危害最为严重的病毒之一[2]。我国国家标准《实验动物 小鼠肝炎病毒检测方法》(GB/T 14926.22—2001)规定的检测方法有酶联免疫吸附试验(Enzyme-linked immune-sorbent assay,ELISA)、间接免疫荧光抗体试验(Immunofluorescence assay,IFA)和免疫酶试验(Immunoenzyme assay,IEA)。如ELISA检测为阳性的样品,经IFA检测仍为阳性,方可判为阳性结果。本研究分析了26份小鼠血清样本的ELISA、IFA检测结果,初步评价了两种方法的真实性,为实验动物房MHV日常监测提供了借鉴。
1 材料与方法。
1.1 材料
MHV ELISA Kit:购自EBI-xpress Biotech International;小鼠肝炎病毒免疫荧光(IFA)试剂盒:购自苏州西山生物技术有限公司;待测样品:近2年来自不同屏障设施的26份SPF级小鼠血清。
1.2 主要仪器
多功能酶标仪:Multiskan Ascent,美国Thermo。智能型生物显微镜:LEICA DM5000B,德国Leica。恒温振荡仪:ZD-85,中国金坛富华。
1.3 检测方法
1.3.1ELISA试剂盒 检测过程依据试剂盒说明书进行。将26份待测样品按1∶50的体积比稀释(待检血清∶样本稀释液=10∶490),对结果使用Multiskan Ascent多功能酶标仪于405 nm波长读值。阴性对照血清、阳性对照血清均为试剂盒自带。
1.3.2IFA试剂盒检测 检测过程依据试剂盒说明书进行。将26份待测样品按1∶25的体积比稀释(待检血清∶样本稀释液=5∶120),使用LEICA DM5000B智能型生物显微镜对结果进行判读。阴性对照血清、阳性对照血清均为试剂盒自带。镜下判读标准:仅有红色细胞背景为“−”,仅见黄绿色荧光为“+”,可见明亮的绿色与黄色荧光为“++”,耀眼的绿色与黄色荧光为“+++”。
1.3.3检测效果初步评价 根据检测结果,首先制作四格表(表1),再根据表格数据计算相应指标。灵敏度=a/(a+c)×100%,特异度=d/(b+d)×100%,误诊率=b/(b+d)×100%,漏诊率=c/(a+c)×100%,粗一致率,即准确度=(a+d)/(a+b+c+d)×100%,约登指数,即正确指数=[a/(a+c)+d/(b+d)]–1,阳性似然比=[a/(a+c)]/[b/(b+d)]×100%,阴性似然比=[c/(a+c)]/[d/(b+d)]×100%[3]。

表1 ELISA、IFA检测结果统计
2 结果
2.1 ELISA检测
2.1.1结果有效性判定 阴性对照血清的阳性病毒抗原孔读数减去阴性对照抗原孔读数必须<0.250,阳性对照血清的阳性病毒抗原孔读数减去阴性对照抗原孔读数必须>0.600,否则需重新检测。本试验试剂盒自带阴性对照血清ΔOD为0.012,阳性对照血清ΔOD为2.883,证实有效(表2)。
2.1.2待测样本结果判定 ΔOD=抗原孔读数OD值−对照抗原孔OD值,ΔOD≥0.300,结果判为阳性(P),ΔOD<0.300,结果判为阴性(N)。26份血清中,有15份阳性、11份阴性(表2)。
2.2 IFA检测
2.2.1结果有效性判定 阴性对照血清的阳性感染细胞孔和阴性对照细胞孔均为“−”,阳性对照血清的阳性感染细胞孔判读为“+~+++”,阴性对照细胞孔为“−”则本次试验有效,否则需重新检测。本试验试剂盒自带阴性对照血清阳性感染细胞孔和阴性对照细胞孔均为“−”,阳性对照血清的阳性感染细胞孔判读为“++”,阴性对照细胞孔为“−”,证实有效(表2)。
2.2.2样本结果判定 26份血清中,有13份显示阳性,其中5份为“+”,8份为“++”,剩余13份血清结果显示阴性(表2)。
2.3 ELISA和IFA检测结果真实性评价
26份血清中,有13份均被ELISA和IFA检测均为阳性、11份均为阴性,另2份分别为ELISA检测阳性、IFA检测阴性。根据表3统计结果,参比IFA,ELISA检测试剂盒的真实性指标为:灵敏度100%,特异度84.61%,误诊率15.38%,漏诊率0,准确度92.3%,正确指数0.846,阳性似然比650%,阴性似然比0。
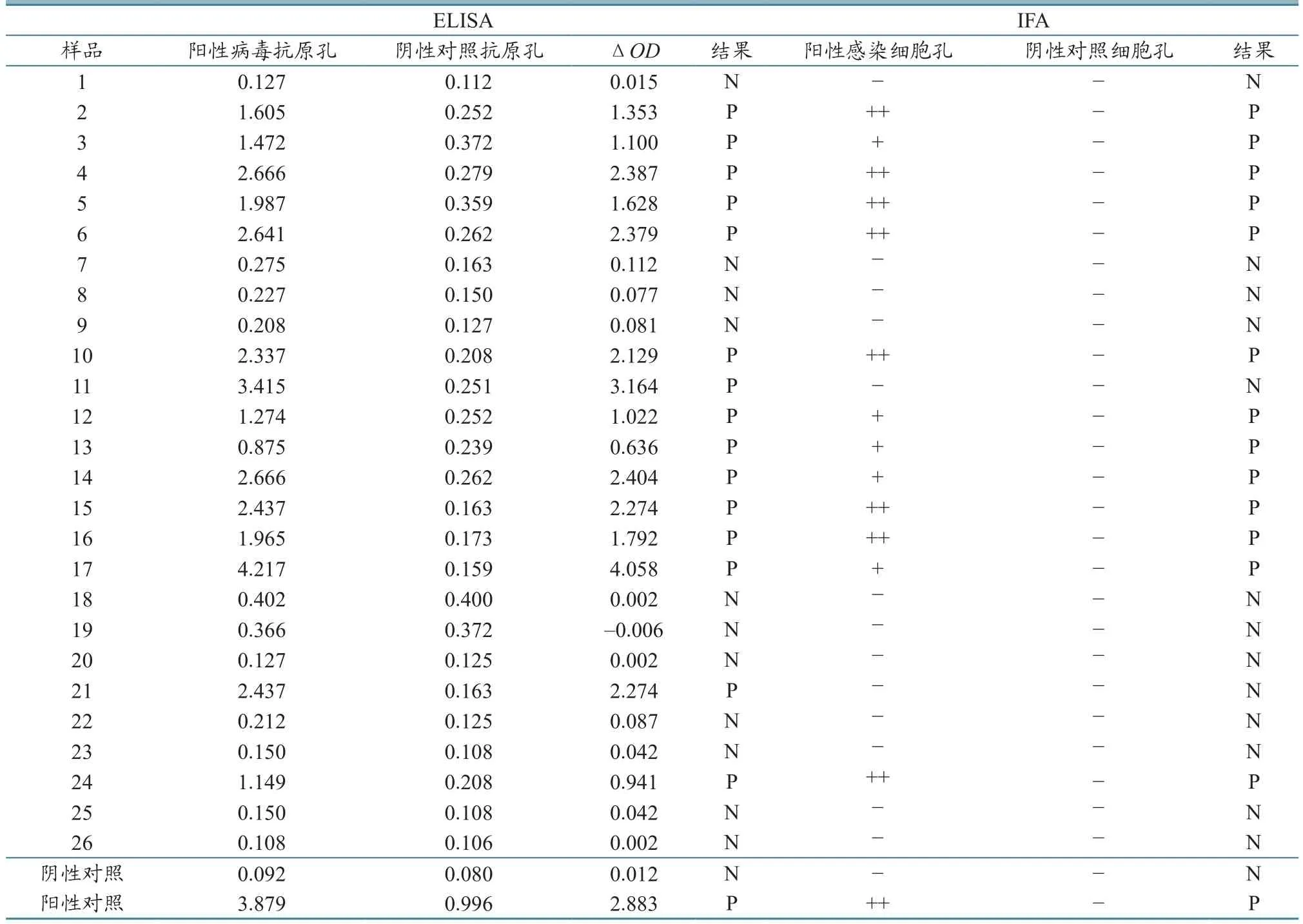
表2 样品的ELISA、IFA检测结果

表3 ELISA、IFA检测结果统计 单位:份
3 讨论
MHV是我国清洁级或以上级别实验小鼠应排除的病原之一,是国家标准《实验动物微生物学等级及监测》(GB 14922.2—2011)规定的必检项目,2013年首次被纳入新版《中华人民共和国进境动物检疫疫病名录》。
1949年Cheever首次在后肢瘫痪小鼠脑中首次分离到MHV-JHM 株,随后鉴定出其他毒株。我国1979年于裸鼠中发现并分离到该病毒[4]。近年来的血清流行病学调查显示,2004—2007年我国台湾地区的MHV阳性率为3.4%~12%[5],2000—2003年欧洲为12%,北美为1.59%[6];2003—2007年我国军事医学科学院的检出率为3%~7%[7],湖南省疾病预防控制中心在湖南省医药科研单位和药厂饲养动物中的阳性检出率为2.7%~6.8%[8],广东省实验动物监测所在广东省6个屏障设施中的阳性检出率为2%~13.7%[6];2011年中国农业科学院哈尔滨兽医研究所在11家繁殖区域送检的动物中均检出阳性[9];北京维通利华实验动物技术有限公司在2012—2013年国内送检小鼠中的阳性检出率高达19.9%[10];2015年在广东省举办的实验动物质量检测交流会上,北京、上海和广东监督检验站报告在近5年来的检测工作中均有阳性被检出。虽然不同时间、不同单位的监测结果不尽相同,但不难发现,MHV感染情况较为普遍,抗体阳性率较高。因此,对于MHV污染的防控,日常监控尤为重要。
研究发现,小鼠人工感染MHV后,抗体产生周期短,持续时间长,5~7 d 内IgG明显升高,3周时达到高峰,维持到28 d后开始缓慢下降;而IgM水平上升时间更早,3 d开始升高,7 d达高峰,3周后开始下降[11]。而更换“脏垫料”法自然感染的ICR小鼠阳性抗体持续至84 d未见明显降低;在接触病原2 d内,在肺脏中检出病毒阳性,随后在其他组织样本均检出阳性,14 d后,病毒检出率开始下降,84 d后所有组织样本中均未检出病毒[12]。可见,抗原可作为早期检测的辅助手段,而抗体检测具有较高稳定性,适用于MHV日常监控,同时IgM亦可考虑用于早期感染的血清学检测。
灵敏度高是ELISA、IFA的优点。国家标准GB/T 14926.22—2001规定,MHV检测方法为ELISA、IFA和IEA。鉴于IEA法抗原不易制备,而ELISA、IFA均有商品化检测试剂盒,故对于日常大量样本的MHV快速检测,目前国内检测单位一般采用ELISA 初筛,阳性样本用IFA进行复检。因此,选择适合的ELISA、IFA检测试剂盒尤为关键。
前期预试验中发现,国产ELISA试剂盒检测结果差强人意,故选择了进口试剂盒。13份检测均为阳性的结果中,ELISA检测数值大小与IFA不一致,估计为两种检测试剂盒包被的抗原不一致所致。
4 结论
本次试验初步评价了ELISA和IFA两种进口试剂盒,反观两者符合度高。ELISA检出率略高,有2份样品ELISA检测为阳性,但IFA检测却为阴性,进一步证实了初筛使用ELISA方法的必要性;参比,IFA,ELISA试剂盒的灵敏度为100%,特异度为84.61%,准确度为92.3%,正确指数为0.846,数据客观真实,初步证实ELISA试剂盒配合IFA适用于动物房MHV抗体的日常监测。但仍需扩大样本量对该检测方法的真实性进行数据补充和修正,同时需应用标准阳性血清和标准阴性血清进行可靠性指标检测。只有这样,才能较为客观、真实地反应检测区域的MHV感染率。
[1] 赫什D C. 兽医微生物学[M]. 王凤阳,译. 2版. 北京:科学出版社,1983.
[2] CHARLES B C,COSENTINO J M. Contemporary prevalence of infectious agents in laboratory mice and rats[J]. Laboratory animal,2009,43(2):165-173.
[3] 崔相学. 卫生统计学[M[. 1版. 北京:北京大学医学出版社,2009.
[4] 仇保丰,宋鸿雁,董蓉莲,等. 鼠痘、小鼠肝炎和鼠仙台病毒感染症的国内流行情况及防控对策[J]. 中国动物检疫,2015,32(10):9-14.
[5] LIANG C T. Microbial contaminations of laboratory mice and rats in taiwan from 2004 to 2007 [J]. Journal of the american association for laboratory animal science,2009,48(4):381-386.
[6] 刘香梅,张钰,赵维波,等. 广东省屏障设施小鼠群中小鼠肝炎病毒感染情况[J] .中国比较医学杂志,2009,19(10):72-74.
[7] 隋丽华,范薇,杨 敬,等. 实验动物微生物、寄生虫抽样调查及分析[J]. 实验动物与比较医学,2008,28(4):259-262.
[8] 黄凰,戴德芳,黄一伟,等. 湖南省2003—2007年实验大、小鼠病毒学监测结果[J]. 实用预防医学,2008,15(6):1926-1928.
[9] 魏巍,刘霄磊,刘家森,等. 大小鼠主要病毒血清抗体检测结果与分析[J]. 实验动物科学,2011,28(6):23-25.
[10] 王翠娥,陈立超,周倩,等. 实验大鼠和小鼠多种病毒的血清学检测结果分析[J]. 实验动物科学,2014,31(2):20-24.
[11] 高骏,孙凤萍,王胜昌,等. 实验小鼠感染小鼠肝炎病毒后的抗体变化[J]. 上海农业学报,2007,23(1):8-11.
[12] 刘香梅,赵维波,袁文,等. ICR小鼠自然感染小鼠肝炎病毒后抗原抗体的变化[J]. 中国比较医学杂志,2014,24(7):37-40.
