氮磷添加对杉木林土壤碳氮矿化速率及酶动力学特征的影响
2018-03-08聂二旗张心昱郑国砥王辉民陈伏生孙晓敏
聂二旗,张心昱,郑国砥,杨 洋,王辉民,陈伏生,孙晓敏
1 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室,北京 100101 2 中国科学院地理科学与资源研究所环境修复中心,北京 100101 3 中国科学院大学,北京 100049 4 江西农业大学江西省竹子种质资源与利用重点实验室,南昌 330045
在亚热带森林生态系统中,氮(N)、磷(P)有效性限制着森林初级生产力和生态系统稳定性[1]。然而,最近半个世纪由于人类活动等因素的影响,大气N沉降逐渐增加,导致亚热带土壤中N素有效性增加,N/P比失衡,P素相对更加缺乏[2]。养分有效性的增加会影响微生物对养分的需求,改变微生物对有机质的分解,影响土壤中的碳储存[3]。土壤C、N矿化将土壤中有机质分解成CO2和无机氮,并且对森林生态系统CO2排放和N养分供应中起着重要的作用[4]。尽管N添加对于C、N矿化影响的研究较多[5-6],而结论还不一致,有促进[5,7],抑制[5,8],无影响[9]。P素作为亚热带森林生态系统主要的限制因子,在C、N循环的过程中起着重要的调控作用[10],而目前关于外源P素输入对C、N矿化的影响还鲜见报道[5]。
土壤微生物是有机质中C、N矿化的主要驱动者[11],能够产生胞外酶催化土壤中有机质的分解,其水解酶活性能够反应微生物对于能量和养分的需求[12-13]。其中,β-1,4-葡萄糖苷酶(βG)能够分解纤维素二糖为葡萄糖,是表征土壤碳矿化的重要微生物指标。β-1,4-N-乙酰葡糖氨糖苷酶(NAG)能够降解几丁质和肽聚糖,将壳二糖水解为氨基葡萄糖,是表征土壤碳、氮矿化的重要微生物指标[14]。N、P添加通过调节微生物的底物有效性,进而影响微生物分泌酶的活性,目前研究发现N、P添加对土壤βG、NAG潜在最大酶活性(Vmax)的影响有促进、抑制、无影响[15-16],但潜在最大酶活性是饱和底物浓度下酶活性[17],未反映土壤中底物浓度对酶活性的影响。酶动力学特征一般遵循米氏方程,可以反映不同底物浓度下的酶活性,完整的描述酶的催化进程[18]。米氏方程中的半饱和常数(Km)是反应速率为酶最大反应速率一半时的底物浓度,与酶的本质属性有关,是表征酶与底物亲和力的常数,其值越小,酶与底物的亲和力越强,即酶-底物复合体的形成能力越强[19],酶动力学参数Vmax/Km可反映酶的催化效率[18]。所以开展N、P添加对土壤βG、NAG的动力学参数的影响具有重要的意义。
本文选择亚热带杉木人工林,开展野外长期N、P添加控制试验,分析N、P添加对杉木林土壤C、N矿化、βG和NAG动力学特征参数的影响,并分析土壤养分与土壤C、N矿化速率、酶动力学特征参数的关系,以期为未来氮沉降增加背景下亚热带森林土壤C、N矿化研究提供数据依据。
1 研究区域概况
1.1 研究区概述
试验样地位于江西省泰和县中国科学院千烟洲石溪林场 (26°44′52″N,115°04′13″E),该区地处亚热带季风气候区,雨量充沛,四季分明,海拔102m,年平均气温17.9℃,年平均无霜期280d,年平均降雨量1471mm,是典型的红壤丘陵地貌,成土母质多为红色砂岩、砂砾岩或泥岩以及河流冲积物,地处中亚热带常绿阔叶林区,由于原有植被被破坏,现多为人工林,森林覆盖近70%,主要树种为1985年前后种植的马尾松(Pinusmassoniana) 、湿地松(PinuselliottiiEngelem) 和杉木(Cunninghamialanceolate)[20- 21]。
1.2 试验设计
杉木人工林N、P添加控制试验共4个处理,对照(CK)、N(50 kg N hm-2a-1)、P(50 kg P hm-2a-1)、NP(50 kg N hm-2a-1+50 kg P hm-2a-1)氮肥为NH4NO3,磷肥为NaH2PO4。每个处理5次重复(n=5),各小区面积400m2(20m×20m),共20个小区,按随机区组设计小区间隔>10 m,各小区随机排列,其中每个小区中划分4个亚小区,允许土壤破坏性采样的面积为10m×10m,其他区域为永久观测区。自2012年开始施肥,每年4次,分别为3、6、9和12月,其中生长季6月和9月施肥量均为全年的30%,非生长季3月和12月施肥量均为全年的20%。本研究选择2014年11月采样,在每个允许土壤破坏性采样的亚小区中随机选取5点,除去地表凋落物层后,用直径2cm的土钻采集0—10cm土壤样品,过2mm筛,挑除根系后,自封袋密封保存,冷藏箱运回实验室,在4℃冰箱冷藏备用。
1.3 测定项目与方法
1.3.1 土壤碳、氮矿化速率
釆用室内需氧连续培养法[22],测定有机碳、氮矿化速率。培养前根据测定的土壤含水量,经过含水率公式换算后,再取相当于40g干土重的新鲜土样于150mL塑料瓶中,瓶盖上有3个直径约为2mm的透气小孔。将样品在25℃恒温培养箱中培养,每天进行称重补充水分,保持土壤含水量不变。在培养的第14天,进行土壤碳、氮矿化速率的测定。
采用自主研发装置测定碳矿化速率,该装置主要由Li-COR(Li- 7000) CO2红外浓度分析仪、数据采集器、低温循环仪、恒温水浴锅和电磁阀等组成。试验测定中系统可根据实验需求调节装置内起始CO2浓度、测试时间并能自动转换测定样品[23],土壤碳矿化速率计算公式如下:
式中:Cmin为土壤碳矿化速率(μg C g-1d-1);C为测试时间内CO2浓度变化的直线斜率;V为包括培养瓶和管线等所有气体体积;m为培养瓶内土壤转化为干土质量;α为CO2气体体积转化为质量的系数;β为时间(s)转化为天数的系数。
称取培养前后1g土样,测定土壤铵态氮、硝态氮含量,进行氮矿化速率的计算[24]
R铵=(NB铵-NA铵)/d
R硝=(NB硝-NA硝)/d
Nmin=(NB铵+NB硝-NA铵-NA硝)/d
式中:NB铵为培养后铵态氮量;NB硝为培养后硝态氮量;NA铵为培养前铵态氮量;NA硝为培养前硝态氮量;Nmin为土壤净氮矿化速率;R铵为土壤氨化速率;R硝为土壤硝化速率;d为培养时间。
1.3.2 酶反应动力学参数
土壤βG和NAG活性分析采用微孔板荧光法(Saiya-Cork, 2002),分别利用4-甲基伞形酮酰-β-D-吡喃葡萄糖苷(4-MUB-β-D-glucopyranoside)和4-甲基伞形酮- 2-乙酰氨基- 2-脱氧-β-D-吡喃葡萄糖苷(4-MUB-N-acetyl-b-D-glucopyranoside)做βG和NAG的底物,应用多功能酶标仪(SynergyH4, BioTek)在365nm荧光处激发,450nm处进行荧光检测。βG和NAG底物均设置8个浓度梯度(5、10、20、30、40、60、100、200μmol/L),并设置8个重复,避光条件下,恒温培养箱中培养4h后进行测定。
将测定的酶活性和底物浓度利用SigmaPlot10软件进行米氏方程曲线拟合,求出最大酶促反应速率(Vmax)和半饱和常数(Km):
V=Vmax[S]/ (Km+[S])
式中,V为酶促反应速率,Vmax为最大酶促反应速率,S为底物浓度,Km为半饱和常数,即酶促反应速率达到1/2Vmax时的底物浓度,可用来表示酶与底物的结合程度。
1.3.3 土壤理化性质

1.4 数据分析
采用单因素方差分析(One-Way ANOVA)和Duncan多重比较对各指标进行显著性检验,显著性水平P<0.05;采用主成分分析(PCA)方法评价不同处理对土壤性质、Cmin和Nmin、βG和NAG动力学参数的影响;利用Pearson检测Cmin、Nmin和βG和NAG动力学参数及土壤环境因子之间的相关性。用SPSS 19.0进行统计分析,Sigma Plot 10.0制图。
2 结果与分析
2.1 氮磷添加对土壤理化性质的影响

表1 氮、磷添加对土壤理化性质影响
每列不同小写字母表示不同处理间差异显著(P<0.05,n=5),数据表示平均值(标准误差);N (50kg N hm-2a-1), P (50kg P hm-2a-1), NP (50kg N hm-2a-1+ 50kg P hm-2a-1)
2.2 氮磷添加对土壤碳氮矿化速率的影响
N比CK的Cmin低25%(P<0.05),P、NP对Cmin的影响较CK均不显著;N添加显著的抑制了Nmin(P<0.05),N、NP主要通过抑制R铵使土壤Nmin较CK分别降低了18%和8%,其中,NP较CK 使Nmin减小达到显著水平(P<0.05)(图1)。
2.3 氮磷添加对土壤酶动力学的影响
土壤βG和NAG的活性与底物浓度的拟合均遵循米氏方程(图2)。N添加使βG的酶动力学参数Vmax、Km较CK(66nmol h-1g-1、53μmol/L)增加了36%、13%(P<0.05),但对酶的Vmax/Km影响不明显(P>0.05)。P输入(P、NP)降低了NAG的Vmax、Km,比CK降低了26%—60%(P<0.05)。NP同时添加使βG和NAG的Vmax/Km值分别较CK增加了61%、89%(P<0.05)(表2)。βG和NAG的动力学参数Vmax与Km之间均显著正相关(P<0.05)(图3)。

图1 氮磷添加对土壤碳氮矿化速率的影响Fig.1 The effects of nitrogen and phosphorus additions on the rates of soil carbon and nitrogen mineralization

图2 氮磷添加条件下β-1,4-葡萄糖苷酶(βG)和β-1,4-N-乙酰葡糖氨糖苷酶(NAG)米氏方程拟合结果Fig.2 Michaelis-Menten equation of β-glucosidase (βG) and N-acetyl-glucosaminidase (NAG) under N and P additions

处理TreatmentVmax/(nmolh-1g-1)Km/(μmol/L)Vmax/Km/h-1βGNAGβGNAGβGNAGCK66±11b34±0a53±12b38±3a1.3±0.13b0.9±0.06bN89±3a27±2b85±7a38±1a1.0±0.05b0.8±0.15bP74±4ab25±1b58±8b24±3b1.3±0.09b1.1±0.09bNP59±4b25±1b27±2c15±1b2.1±0.17a1.7±0.13a
每列不同小写字母表示不同处理间差异显著(P<0.05,n=3),数据表示平均值±标准误差;Vmax:最大酶促反应速率,Maximum rate of enzyme reaction;Km:半饱和常数,Michalis constant;Vmax/Km:酶促反应效率,The efficiency of enzyme reaction;βG:β-1,4-葡萄糖苷酶,β-glucosidase;NAG:β-1,4-N-乙酰葡糖氨糖苷酶,N-acetyl-glucosaminidase

图3 土壤β-1,4-葡萄糖苷酶(βG)和β-1,4-N-乙酰葡糖氨糖苷酶(NAG)动力学参数Vmax、Km的相关性分析Fig.3 Relationships between the kinetics parameters (Vmax and Km) of β-glucosidase (βG) and N-acetyl-glucosaminidase (NAG)
2.4 主成分分析

2.5 相关分析

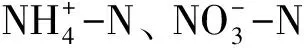

图4 土壤碳氮矿化速率、土壤βG、NAG动力学参数和土壤环境因子主成分分析Fig.4 Principal component analysis of the soil carbon and nitrogen mineralization rates, βG and NAG kinetic parameters and soil environment factors(a)不同处理得分,(a) score of different treatment;(b)土壤Cmin、土壤Nmin、土壤βG、NAG动力学参数和环境因子载荷值,(b) loading values of individual soil carbon and nitrogen mineralization rate, βG kinetics and soil environmental factors;βGVmax:βG酶促反应最大速率, Maximum rate of β-glucosidase;βGKm:βG米氏常数,Michalis constant of β-glucosidase; NAG Vmax:NAG酶促反应最大速率,Maximum rate of N-acetyl-glucosaminidase;NAGKm:NAG米氏常数, Michalis constant of N-acetyl-glucosaminidase;Ka (βG): 土壤βG的催化效率Vmax/Km, efficient reaction of N-acetyl-glucosaminidase; Ka (NAG): 土壤NAG的催化效率Vmax/Km,The efficient reaction of N-acetyl-glucosaminidase

矿化MineralizationpHpH有机碳SOC全氮TN全磷TP可溶性碳DOC铵态氮NH+4-N硝态氮NO-3-N有效磷aP碳矿化速率Cmin0.262-0.2390.1380.0470.551∗-0.189-0.01-0.187氮矿化速率Nmin0.635∗∗-0.3720.1530.3670.215-0.459∗-0.581∗0.204氨化速率R氨0.530∗-0.616∗-0.456-0.161-0.045-0.329-0.421-0.187硝化速率R硝0.0500.2980.2920.639∗-0.1050.166-0.1640.654∗
*P<0.05,**P<0.01,n=20;Cmin:碳矿化速率,Carbon mineralization;Nmin:氮矿化速率,Nitrogen mineralization;R氨:氨化速率,Ammonification rate;R硝:硝化速率,Nitrifying rate

表4 βG、NAG动力学参数与土壤环境因子的相关性
*P<0.05,**P<0.01,n=12
3 讨论
3.1 氮磷添加对土壤碳、氮矿化速率的影响
Cmin随着培养时间的延长而降低,与Fang等[26]的研究结果一致,这是由于培养后期土壤中易分解的糖类和蛋白质等物质减少,难分解的木质素、纤维素逐渐占主导地位,导致微生物对有机碳的利用效率降低[26]。本文表明N添加抑制土壤Cmin,这与Jussy等[7]的结果一致。N添加减少了杉木林中土壤微生物量及微生物群落的多样性[27],导致土壤Cmin降低。文中P添加对土壤Cmin没有明显影响,主要因为在P素限制的亚热带森林地区,外源P素输入主要被植物吸收[28],对与Cmin有关的微生物影响较小。

3.2 氮磷添加对土壤水解酶动力学特征的影响
文中结果显示,N添加增加了βG的Vmax,这与Stone等[31]的结论一致。N添加增加了土壤中氮素的有效性,导致碳素相对缺乏。根据微生物经济分配理论,此时微生物会产生更多与碳分解的酶,即增大碳水解酶的Vmax[31]。有研究结果表明Vmax、Km是米氏方程中两个独立的变量[16],本文研究结果也表明,N添加使βG的Vmax和Km同时增大(图3),其原因可能是酶与有机物结合的有效位点受有机物有效性的限制,而输入的氮素会与土壤中的含碳化合物形成复杂的有机体[32],降低了βG与底物的亲和力,增加了土壤βG的Km[30]。本文结果表明,N添加并未增加βG的Vmax/Km(催化效率)(表2),说明N添加条件下,土壤微生物不是通过提高酶的Vmax/Km,而是通过提高酶的Vmax[31]来缓解由于N添加引起的碳限制。另外文中结果表明,N添加条件下的Cmin与βG的Vmax成反比,这是因为Cmin、Nmin大小不但受Vmax的影响,还与酶与底物的亲和力常数Km有关,Cmin、Nmin的大小Vmax/Km决定[18]。
P添加抑制了NAG的Vmax(表2),这与Wang等[33]的研究结果一致,原因可能是在较高的aP条件下微生物减少了NAG数量的产生[33]。也有研究认为,aP可以缓解微生物对N素的需求,从而降低了氮水解酶的活性[34]。P添加对βG的Vmax无明显影响,这尽管与微生物经济分配理论不一致,但也和一些研究报道一致,例如Turner等[13]在亚热带的森林研究中发现持续10年的P添加对βG的Vmax无明显影响。然而,文中结果显示,NP同时添加明显的增加βG和NAG的Vmax/Km(表2),这可能与NP同时添加降低了这两种酶的Km,增加了酶与底物的亲和力有关(表2)。
4 结论

[1] Vitousek P M, Porder S, Houlton B Z, Chadwick O A. Terrestrial phosphorus limitation: mechanisms, implications, and nitrogen—phosphorus interactions. Ecological Applications, 2010, 20(1): 5- 15.
[2] Lu X K, Mo J M, Gundersern P, Zhu W X, Zhou G Y, Li D J, Zhang X. Effect of simulated N deposition on soil exchangeable cations in three forest types of subtropical China. Pedosphere, 2009, 19(2): 189- 198.
[3] Koyama A, Wallenstein M D, Simpson R T, Moore J C. Carbon-degrading enzyme activities stimulated by increased nutrient availability in Arctic tundra soils. PLoS One, 2013, 8(10): e77212.
[4] Tu L H, Hu T X, Zhang J, Li X W, Hu H L, Liu L, Xiao Y L. Nitrogen addition stimulates different components of soil respiration in a subtropical bamboo ecosystem. Soil Biology and Biochemistry, 2013, 58: 255- 264.
[5] Wang C H, Zhu F, Zhao X, Dong K H. The effects of N and P additions on microbial N transformations and biomass on saline-alkaline grassland of Loess Plateau of Northern China. Geoderma, 2014, 213: 419- 425.
[6] Min K, Kang H, Lee D. Effects of ammonium and nitrate additions on carbon mineralization in wetland soils. Soil Biology and Biochemistry, 2011, 43(12): 2461- 2469.
[7] Jussy J H, Colin-Belgrand M, Dambrine É, Ranger J, Zeller B, Bienaimé S. N deposition, N transformation and N leaching in acid forest soils. Biogeochemistry, 2004, 69(2): 241- 262.
[8] Swanston C, Homann P S, Caldwell B A, Myrold D D, Ganio L S, Sollins P. Long-term effects of elevated nitrogen on forest soil organic matter stability. Biogeochemistry, 2004, 70(2): 229- 252.
[9] 方熊, 刘菊秀, 张德强, 刘世忠, 褚国伟, 赵亮. 降水变化、氮添加对鼎湖山主要森林土壤有机碳矿化和土壤微生物碳的影响. 应用与环境生物学报, 2012, 18(4): 531- 538.
[10] Vance C P, Uhde-Stone C, Allan D L. Phosphorus acquisition and use: critical adaptations by plants for securing a nonrenewable resource. New Phytologist, 2003, 157(3): 423- 447.
[11] Holst J, Liu C Y, Brüggemann N, Butterbach-Bahl K, Zheng X H, Wang Y S, Han S H, Yao Z S, Yue J, Han X G. Microbial N turnover and N-oxide (N2O/NO/NO2) fluxes in semi-arid grassland of Inner Mongolia. Ecosystems, 2007, 10(4): 623- 634.
[12] German D P, Weintraub M N, Grandy A S, Lauber C L, Rinkes Z L, Allison S D. Optimization of hydrolytic and oxidative enzyme methods for ecosystem studies. Soil Biology and Biochemistry, 2011, 43(7): 1387- 1397.
[13] Turner B L, Wright S J. The response of microbial biomass and hydrolytic enzymes to a decade of nitrogen, phosphorus, and potassium addition in a lowland tropical rain forest. Biogeochemistry, 2014, 117(1): 115- 130.
[14] Sinsabaugh R L, Hill B H, Follstad Shah J J. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment. Nature, 2009, 462(7274): 795- 798.
[15] Wang C Y, Han G M, Jia Y, Feng X G, Guo P, Tian X J. Response of litter decomposition and related soil enzyme activities to different forms of nitrogen fertilization in a subtropical forest. Ecological Research, 2011, 26(3): 505- 513.
[16] Qian X, Gu J, Sun W, Li Y D, Fu Q X, Wang X J, Gao H. Changes in the soil nutrient levels, enzyme activities, microbial community function, and structure during apple orchard maturation. Applied Soil Ecology, 2014, 77: 18- 25.
[17] Xu Z W, Yu G R, Zhang X Y, Ge J P, He N P, Wang Q F, Wang D. The variations in soil microbial communities, enzyme activities and their relationships with soil organic matter decomposition along the northern slope of Changbai Mountain. Applied Soil Ecology, 2015, 86: 19- 29.
[18] 樊金娟, 李丹丹, 张心昱, 何念鹏, 部金凤, 王情, 孙晓敏, 温学发. 北方温带森林不同海拔梯度土壤碳矿化速率及酶动力学参数温度敏感性. 应用生态学报, 2016, 27(1): 17- 24.
[19] 陈晓丽,王根绪,杨燕,杨阳. 山地森林表层土壤酶活性对短期增温及凋落物分解的响应. 生态学报,2015,35(21): 7071- 7079.
[20] Yang B, Wen X F, Sun X M. Seasonal variations in depth of water uptake for a subtropical coniferous plantation subjected to drought in an East Asian monsoon region. Agricultural and Forest Meteorology, 2015, 201: 218- 228.
[21] 杨洋,王继富,张心昱,李丹丹,王辉民,陈伏生,孙晓敏,温学发.凋落物和林下植被对杉木林土壤碳氮水解酶活性的影响机制.生态学报,2016, 36(24): 8102- 8110.
[22] 马丽娜, 王喜明, 代万安, 潘剑玲, 陈晓鹏, 尚占环, 郭瑞英. 西藏高原日光温室菜地土壤碳、氮矿化特征研究. 中国生态农业学报, 2013, 21(11): 1340- 1349.
[23] He N P, Wang R M, Gao Y, Dai J Z, Wen X F, Yu G R. Changes in the temperature sensitivity of SOM decomposition with grassland succession: implications for soil C sequestration. Ecology and Evolution, 2013, 3(15): 5045- 5054.
[24] 张璐, 黄建辉, 白永飞, 韩兴国. 氮素添加对内蒙古羊草草原净氮矿化的影响. 植物生态学报, 2009, 33(3): 563- 569.
[25] 中国生态系统研究网络科学委员会. 陆地生态系统土壤观测规范. 北京: 中国环境科学出版社, 2007.
[26] Fang H, Mo J M, Peng S L, Li Z A, Wang H. Cumulative effects of nitrogen additions on litter decomposition in three tropical forests in southern China. Plant and Soil, 2007, 297(1/2): 233- 242.
[27] Dong W Y, Zhang X Y, Liu X Y, Fu X L, Chen F S, Wang H M, Sun X M, Wen X F. Responses of soil microbial communities and enzyme activities to nitrogen and phosphorus additions in Chinese fir plantations of subtropical China. Biogeosciences, 2015, 12(18): 5537- 5546.
[28] Chen F L, Zheng H, Zhang K, Ouyang Z Y, Lan J, Li H L, Shi Q. Changes in soil microbial community structure and metabolic activity following conversion from nativePinusmassonianaplantations to exoticEucalyptusplantations. Forest Ecology and Management, 2013, 291: 65- 72.
[29] Kadono A, Funakawa S, Kosaki T. Factors controlling mineralization of soil organic matter in the Eurasian steppe. Soil Biology Biochemistry, 2008, 40(4): 947- 955.
[30] Liu X R, Dong Y S, Ren J Q, Li S G. Drivers of soil net nitrogen mineralization in the temperate grasslands in Inner Mongolia, China. Nutrient Cycling in Agroecosystems, 2010, 87(1): 59- 69.
[31] Stone M M, Weiss M S, Goodale C L, Adams M B, Fernandez I J, German D P, Allison S D. Temperature sensitivity of soil enzyme kinetics under N-fertilization in two temperate forests. Global Change Biology, 2012, 18(3): 1173- 1184.
[32] 方运霆, 莫江明, Per G, 周国逸, 李德军. 森林土壤氮素转换及其对氮沉降的响应. 生态学报, 2004, 24(7): 1523- 1531.
[33] Wang Q K, Wang S L, Liu Y X. Responses to N and P fertilization in a youngEucalyptusdunniiplantation: microbial properties, enzyme activities and dissolved organic matter. Applied Soil Ecology, 2008, 40(3): 484- 490.
[34] Jing X, Yang X X, Ren F, Zhou H K, Zhu B, He J S. Neutral effect of nitrogen addition and negative effect of phosphorus addition on topsoil extracellular enzymatic activities in an alpine grassland ecosystem. Applied Soil Ecology, 2016, 107: 205- 213.
