白洋淀附着藻类的初级生产力及其与水质的关系
2018-03-08马牧源崔丽娟张曼胤王雪梅于一雷
马牧源,崔丽娟,张曼胤,王雪梅,于一雷,*
1 中国林业科学研究院湿地研究所,北京 100091 2 湿地生态功能与恢复北京市重点实验室,北京 100091 3 西昌学院动物科学学院,西昌 615013
初级生产力(GPP)是指自养生物通过光合作用或化学合成制造有机物的速率。初级生产力不仅是食物链(网)的基础环节,同时还反映生态系统的生产潜力[1]。对于湖泊生态系统,初级生产不仅决定湖泊的溶氧状况,还通过食物链(网)直接或间接影响其他生物和化学过程。因此,湖泊的初级生产力是确定湖泊状态、揭示湖泊生态系统结构和功能中不可忽视的重要研究内容[2-3]。湖泊的初级生产者主要由浮游植物、附着植物和大型水生维管束植物及自养细菌组成。附泥藻类(Epipelon),指栖息在柔软沉积物上的藻类;附植藻类(Epiphyton),指着生在沉水或挺水植物的外表面的藻类。附植藻类和附泥藻类在氮、磷等营养物质的固定方面起重要作用[4],由于附着藻类可以固定可溶性的氮,磷,因此可以作为氮、磷的汇[5],由于附泥藻类的重要作用,沉积物中的氮、磷常高于表层水[6]。附植藻类和附泥藻类作为浅水湖泊中重要的初级生产者,在碳固定方面起重要作用。如Vis等[7]在圣劳伦斯河拓宽区域(Lac St. Pierre)的研究显示,浮游植物和附着藻类对总初级生产的贡献达到整个水生态系统的50%。在清水态湖泊(草型湖泊)中,附着藻类对于初级生产贡献甚至会超过浮游植物的贡献[8-9];Hart和Lovvorn[10]对美国拉勒米流域的湖沼湿地初级生产力的研究表明,浮游植物、附植藻类,附泥藻类的贡献分别为3%—15%,20%—32%,1%—10%。在向高营养级的能量传递过程中,附着藻类起了更重要的作用[11-13]。当前对于湖泊的初级生产研究大多集中在浮游植物群落[14- 17],对于附着藻类初级生产力的研究相对较少[12,18]。研究拟通过对白洋淀附着藻类不同季节的现存量及初级生产进行测定与估算、分析其与水质指标的关系,为评估人类活动对白洋淀生态系统代谢的影响提供科学依据。
1 材料与方法
1.1 研究区概况
白洋淀湿地地处115°38′—116°07′E,38°43′—39°02′N,位于华北平原中部,是华北地区最大的浅水草型湖泊,流域面积366km2,淀底西高东低,海拔5.5—6.5m(大沽高程),被誉为“华北之肾”。该区属暖温带季风气候,多年平均气温7.3—12.7℃,年降水量563.9mm,降雨年际变化大,且年内分配不均,80%的雨量集中在6—8月。年平均蒸发量为1369mm,远大于降水量。近年来,9条入淀河流中,仅府河常年有水,其余河流基本断流或季节性有水。白洋淀主要由水域、芦苇沼泽、台田以及浅滩湖滨带组成,面积分别占淀区总面积的50%,36%和14%[19]。芦苇在白洋淀的分布面积约为6000hm2,是白洋淀分布面积最大、最典型的水生植被。
1.2 采样点和采样方法

图1 白洋淀湿地及其采样点分布示意图 Fig.1 Location of the Baiyangdian Lake and sampling sites S1—府河入淀口;S2—南刘庄;S3—烧车淀;S4—王家寨;S5—枣林庄;S6—圈头; S7—采蒲台; S8—端村
根据白洋淀的自然条件及村落分布特征,选取8个采样点(图1)。本研究在2014—2015年不同季节(11月,4月,6月,8月)分别在8个监测点收集附植藻类、附泥藻类用于生物量调查。选择白洋淀典型水生植物芦苇作为附植藻类的基质,收集水下40—60cm处的芦苇茎,所选芦苇直径不小于1cm,用刷子刮取芦苇上的附着藻类,并记录芦苇直径以计算附着面积。用塑料铲挖取底泥,刮取开敞浅水区域处(40cm<水深<80cm)约1mm厚表层泥样获得附泥藻类,并记录刮取面积。两种附着藻类在各采样点均设3个重复,所采集的附着藻类用经0.2μm滤膜过滤的采样区域过滤水悬浮,并冷藏保存至实验室测定其叶绿素a含量(chla)及无灰干重(AFDW)。
1.3 水样理化指标测定
现场测定水深(D)、塞氏盘深度(SD)、水温(T)、溶解氧(DO)。同步采集水样,实验室测定氨氮(NH4-N),硝氮(NO3-N),总氮(TN),总磷(TP),高锰酸盐指数(CODMn)及水体中的叶绿素(chla)等指标,参照《水和废水监测分析方法(第四版)》进行样品保存及测定。
1.4 生物量测定
附植藻类叶绿素a(chla1)和附泥藻类叶绿素a(chla2):采用热乙醇反复冻融法提取,并通过分光光度法进行测定,用μg/cm2表征。
附植藻类无灰干重(AFDW1)和附泥藻类无灰干重(AFDW2):分别取3份附着藻类平行样品用2mL蒸馏水悬浮,然后用孔径为0.2μm的玻璃纤维膜过滤,并105℃干燥24h后称干重(W1),500℃马弗炉内烘干1h后称量样品灰(W2),通过(W1-W2)/采样面积来计算无灰干重[20],用g/m2表征。
1.5 原位附着藻类初级生产力测定与计算
附着藻类的初级生产力采用密闭箱法进行估算。将3组(2L,透明和不透明各一个)有机玻璃箱置于各采样点,通过具有自动记录功能的溶氧仪测定不透明玻璃箱和透明玻璃箱中24h的溶氧变化,假定光照与黑暗条件下的呼吸强度相等,就可根据的溶氧变化计算出光合作用与呼吸作用的强度(公式1,2)。透明箱24h溶氧变化即净初级生产力(NPP),不透明箱24h溶氧变化即为呼吸速率(R),两者相加则计算出总初级生产力(GPP)。根据光合作用方程,将氧换算成固定的碳值,乘以系数0.35。其中附着藻类的GPP、R和NPP均用mgC m-2d-1表示。
附植藻类的初级生产力(GPP1) 呼吸速率(R1)和净初级生产力(NPP1):将直径不小于1cm附有藻类的芦苇段(长5cm)与过滤后的湖水共同置于密闭箱内中,并记录芦苇表面积。附泥藻类的初级生产力(GPP2)、呼吸速率(R2)和净初级生产力(NPP2):用经过清洗的直径为3cm的玻璃圆盘铲起附有藻类的薄层底泥,使底泥均匀地覆盖住玻璃板,并将其平置于装满过滤后湖水(32μm筛网)的密闭箱中,并记录底泥覆盖面积。
(1)
(2)
式1,2中,C0为水体中溶氧的初始浓度(mg/L),Cw为24小时后透明箱中的溶氧浓度(mg/L),Cb为24h后不透明箱中的溶氧浓度(mg/L),Vw为透明箱中湖水体积,Vb为不透明箱中湖水体积,Sw为透明箱中藻类附着面积(m2),Sb为不透明箱中附着藻类的面积(m2),Tw为光照时间(h)。
1.6 数据处理及分析
采用多元方差分析对于不同时间、不同地点的附着藻类生物量、初级生产的显著性进行检验,并通过事后多重比较进一步判断各变量间差异的显著性。附植藻类和附泥藻类之间的差异显著性主要通过重复测量方差分析(Repeated measures ANOVAs)进行检验。为便于比较,将水质参数及附着藻类生物量和初级生产归一化,采用CANOCO 4.5对附着藻类与环境因子的排序进行分析。首先对附着藻类生物量和初级生产进行除趋势对应分析(Detrended correspondence analysis,DCA), 以确定附着藻类分布模型(如排序轴长度>4,选择单峰模型CCA,反之,则选择线性模型RDA)。本研究中除趋势对应分析结果表明,排序轴长度小于3,因此选用基于RDA进行排序分析,同时采用向前引入法逐步筛选出显著相关的环境变量,每一步都采用蒙特卡罗置换进行检验。
2 结果
2.1 白洋淀水质状况
白洋淀各采样点的水质指标测定结果见表1。根据地表水环境质量标准(GB3838—2002),白洋淀为劣V类水体。超过地表水环境质量标准III类标准的指标为TN、NH4-N、TP和CODMn。2014—2015年白洋淀各水质参数具有明显的时间异质性(表1),6月和8月水质较差,4月和11月相对较好。除pH、T外其余水质指标在各采样点间变化较大。枣林庄(S5)、采蒲台(S7)水质状况较好,TN、NH4-N、TP和CODMn的范围分别为2.16—5.92mg/L,1.39—4.51mg/L,0.09—0.29mg/L和4.13—7.31mg/L;入淀口(S1)和南刘庄(S2)水质最差,TN、NH4-N,TP和CODMn的范围分别为0.29—8.95mg/L,4.85—6.99mg/L,0.24—0.74mg/L和5.84—12.31mg/L。

表1 采样点水质状况
2.2 白洋淀附着藻类生物量与初级生产力的时空分布
2.2.1 附着藻类叶绿素a的时空分布
附植藻类和附泥藻类的平均叶绿素a在不同采样期的变化范围分别为34.83—245.22μg/cm2和26.08—297.40μg/cm2。附着藻类叶绿素a在不同季节均存在显著差异(表2),事后多重比较结果表明,8月>6月>11月>4月,其中,4月与11月之间无显著差异,其余采样期差异显著(图2,P<0.05)。两种附着藻类相比,chla1和chla2在不同季节呈显著差异(Repeated measures ANOVA,F=96.34,P<0.001)。在温度较低的4月和11月,chla1>chla2, 在6月和8月则是chla2> chla1。
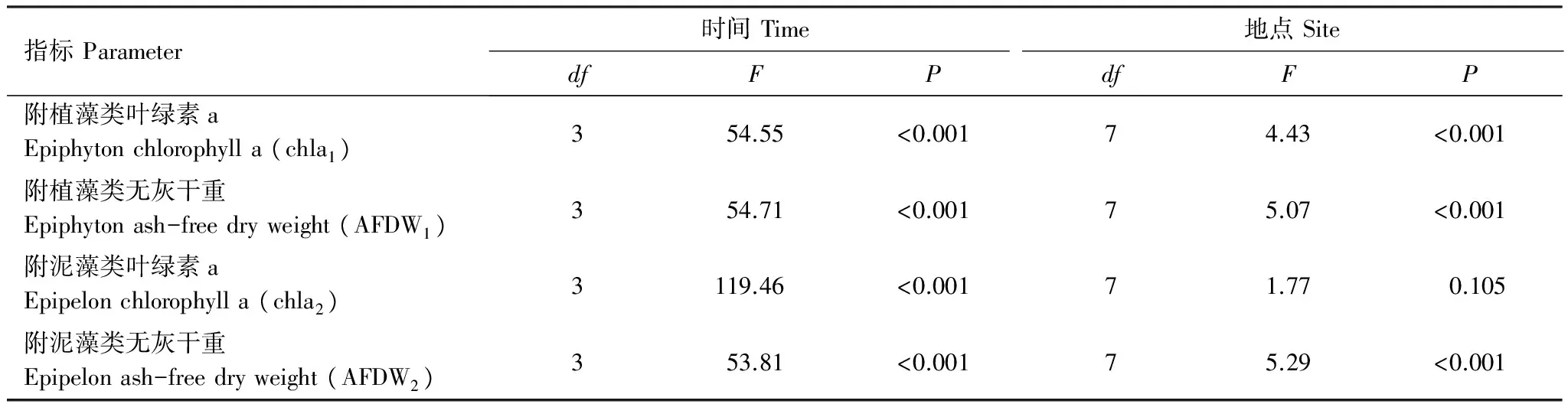
表2 附着藻类生物量多变量方差分析结果
附植藻类的叶绿素a在不同地点呈显著差异(表2)。附植藻类的叶绿素a平均大小依次为:S2>S1>S8>S4>S6>S3>S7>S5,其中S2、S1显著高于S7、S5(图3,LSD,P<0.05)。附泥藻类的叶绿素a平均大小依次为:S2>S1>S8>S6>S4>S3>S5>S7,但不同地点间无显著差异(图3)。两种附着藻类相比,chla1和chla2在不同地点间无显著差异(Repeated measures ANOVA,F=1.213,P=0.304),在所有采样点chla2均略高于chla1。
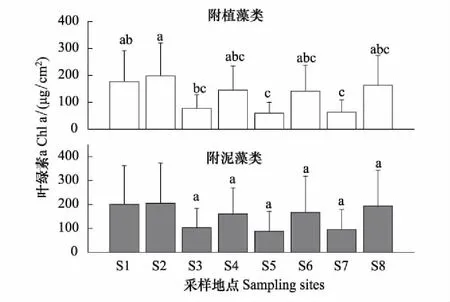
图3 2014—2015年白洋淀附着藻类叶绿素a的空间分布 Fig.3 Spatial distribution of chlorophyll a of periphyton in Baiyangdian Lake in 2014—2015
2.2.2 附着藻类无灰干重(AFDW)的时空分布
附植藻类和附泥藻类的平均AFDW在不同采样期的变化范围分别为0.46—5.21g/m2和0.61—5.81g/m2。两种附着藻类AFDW均呈现出显著的时间异质性(表2), 事后多重比较结果表明:附植藻类AFDW为8月>6月>11月>4月,其中,8月和6月无显著差异,其他采样期差异显著(图4,LSD,P<0.05);附泥藻类AFDW所有采样期均差异显著(图4,LSD,P<0.05),8月>6月>11月>4月。两种附着藻类的AFDW也都存在显著的空间异质性(表2)。附植藻类的AFDW平均大小依次为:S2>S8>S1>S4>S6>S3>S7>S5,其中S2显著高于S3、S5和S7(图5,LSD,P<0.05);附泥藻类的AFDW平均大小依次为:S1>S2>S8>S4>S6>S3>S7>S5,其中S1和S2均显著高于S3,S5和S7(图5,LSD,P<0.05)。比较两种附着藻类的AFDW可以看出,附植藻类和附泥藻类随时间、地点变化趋势相似,AFDW1略低于AFDW2,但二者在不同采样时间(Repeated measures ANOVA,F=2.137,P=0.101)不同采样地点并无显著差异(Repeated measures ANOVA,F=1.411,P=0.211)。
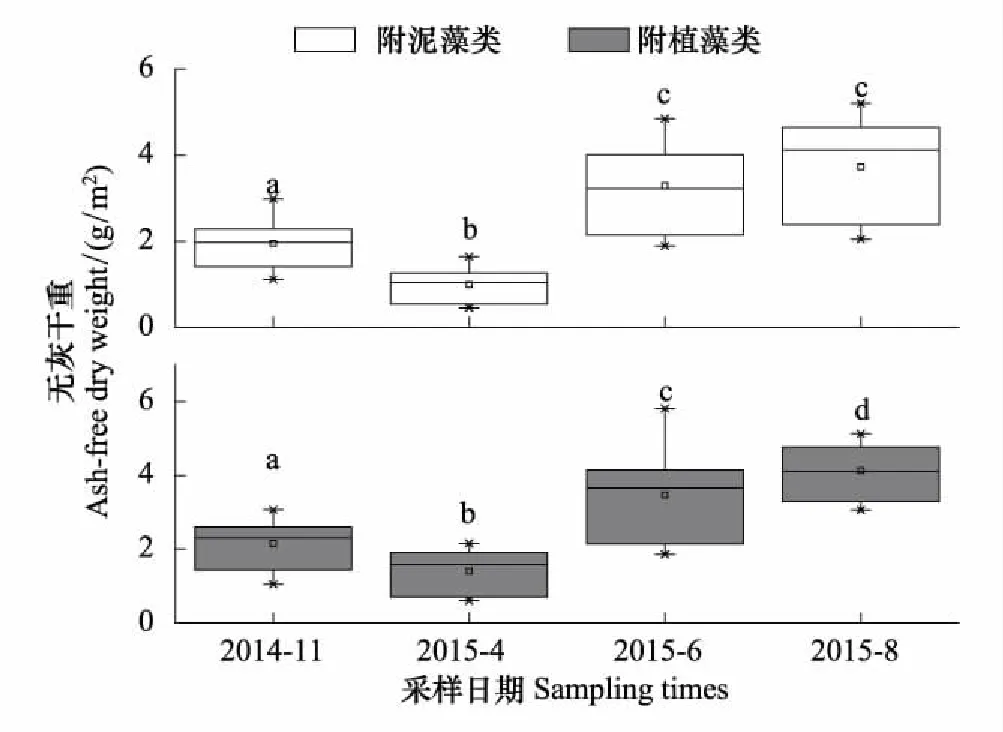
图4 2014—2015年白洋淀附着藻类无灰干重的时间变化 Fig.4 Temporal changes of ash-free dry weight of periphyton in Baiyangdian Lake in 2014—2015
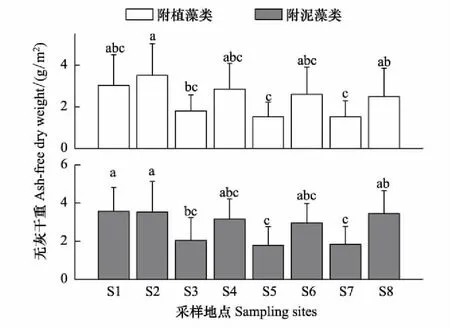
图5 2014—2015年白洋淀附着藻类无灰干重的空间分布 Fig.5 Spatial distribution of ash-free dry weight of periphyton in Baiyangdian Lake in 2014—2015
2.2.3 白洋淀附着藻类初级生产力的时空分布
附植藻类和附泥藻类的平均GPP在不同采样期的变化范围分别为203.6—1007.2mgC m-2d-1,177.20—920.30mgC m-2d-1;R分别为184.30—1145.30mgC m-2d-1和169.20—1081.60mgC m-2d-1;NPP分别为-188.20—52.78mgC m-2d-1和-217.60—43.20mgC m-2d-1。两种附着藻类的GPP、R和NPP在不同季节均存在显著差异(表3)。事后多重比较表明:GPP1,GPP2,R1和R2均为8月>6月>4月>11月,其中仅4月和11月无显著差异,其余采样期均呈显著差异(图6—7,LSD,P<0.05); NPP1和NPP2为4月>11月>6月>8月,其中4月和11月显著高于6月和8月(图8,LSD,P<0.05)。NPP在6月,8月为负值,4月和11月略高于0,表明白洋淀在6、8月以异养代谢群落为主;在4、11月则以自养群落为主。
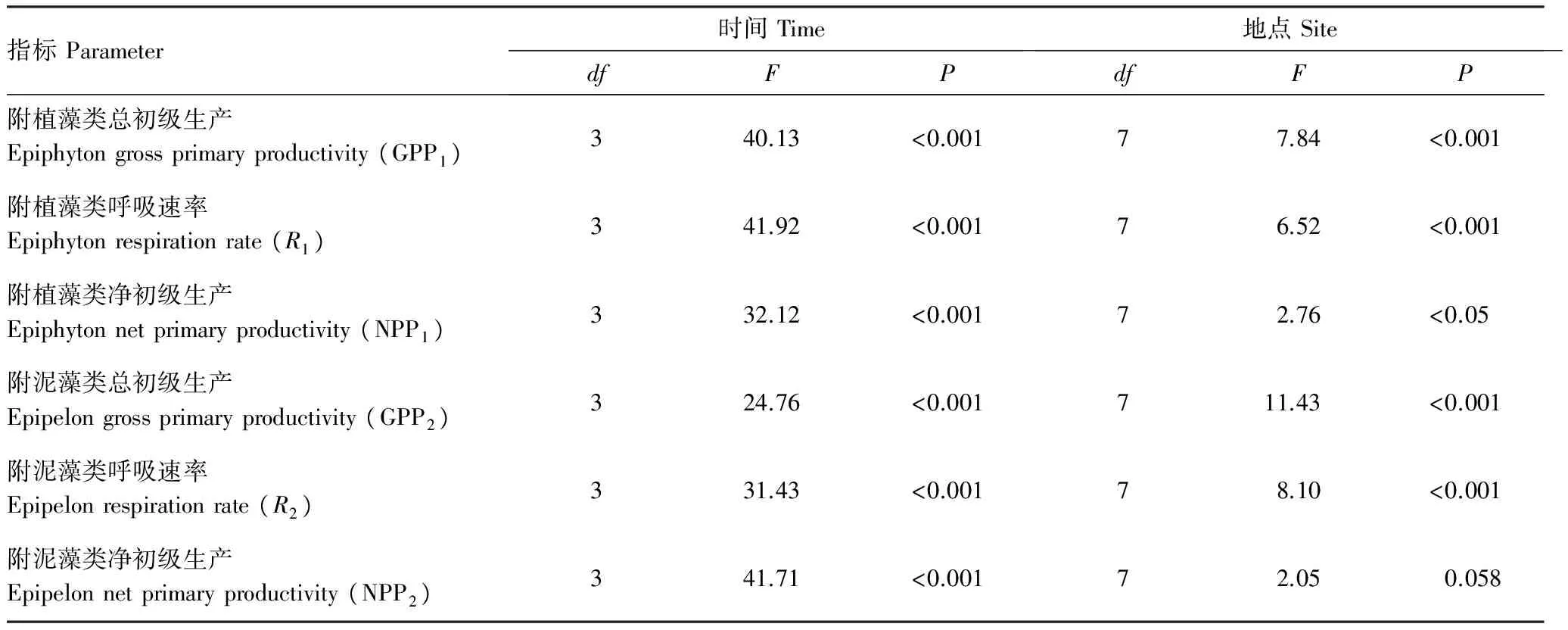
表3 附着藻类生物量多变量方差分析结果
附植藻类的GPP,R和NPP在空间上存在显著差异(表3)。附植藻类的平均GPP排序为S1>S2>S4>S6>S8>S3>S7>S5,其中S1,S2和S4显著高于S5,S7(图9,LSD,P<0.05);R排序为S1>S2>S8>S4>S6>S3>S7>S5,其中S1,S2显著高于S3,S5和S7(图10,LSD,P<0.05)。NPP排序为S5>S7>S3>S6>S4>S8>S2>S1,其中S5和S7的NPP大于0,其余点位的4个采样期的平均值均小于0,S5显著高于S1(图11,LSD,P<0.05)。附泥藻类的GPP和R在不同采样点呈显著差异,净初级生产(NPP2)无显著差异(表3)。各采样点GPP2的排序为S1>S2> S8>S4>S6>S3>S7>S5,其中S3,S7,S5显著低于其他各采样点(图9,LSD,P<0.05);R2的排序为S1>S2>S4>S6>S8>S3 >S5> S7,其中S1,S2显著高于S3,S5和S7(图10,LSD,P<0.05)。只有枣林庄(S5),采蒲台(S7)的两种附着藻类不同季节的NPP的均值大于0(图11),表明这两个采样点的附着生物都以自养群落为主。两种附着藻类相比,GPP1与GPP2,R1与R2, NPP1与NPP2在不同采样时间呈显著差异(Repeated measures ANOVA,P<0.001),但在不同地点无显著差异(Repeated measures ANOVA,P>0.05),表明相似的环境条件下,基质对附着藻类初级生产的影响较小。Pearson相关性检验表明,白洋淀的两种附着藻类的各代谢指标显著相关(表4)。
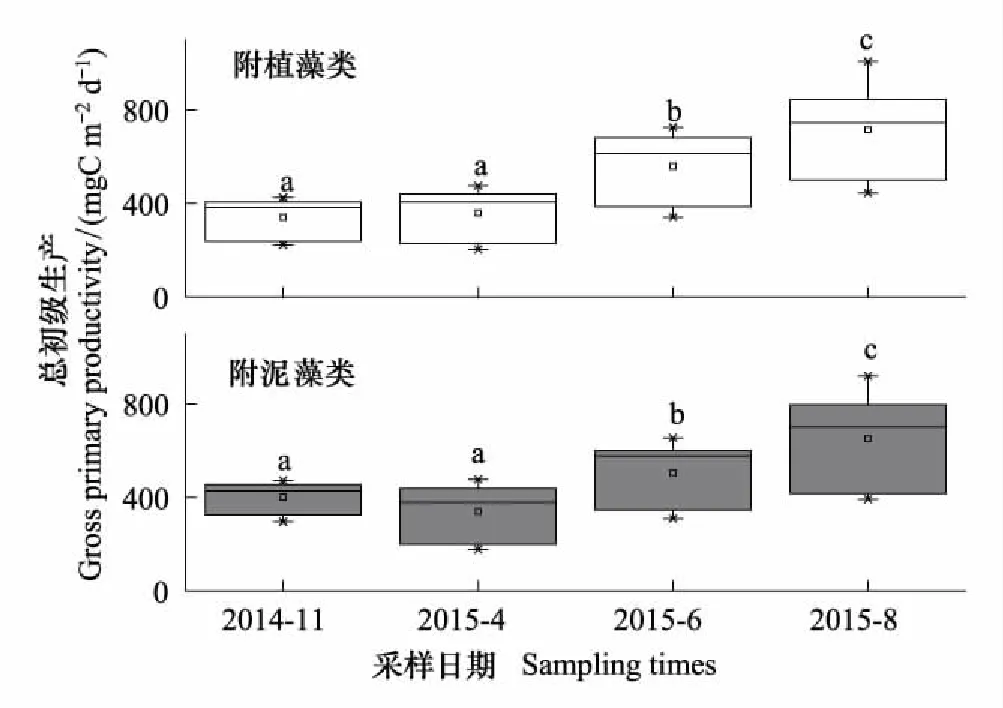
图6 2014—2015年白洋淀附着藻类总初级生产的时间变化 Fig.6 Temporal changes of the gross primary productivity of periphyton in Baiyangdian Lake in 2014—2015
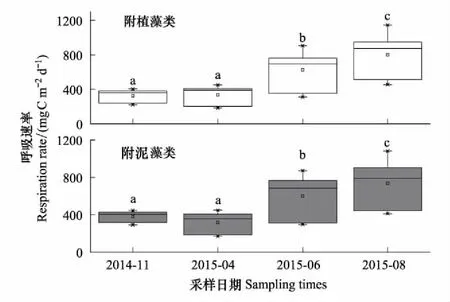
图7 2014—2015年白洋淀附着藻类呼吸速率的时间变化 Fig.7 Temporal changes of the respiration rate of periphyton in Baiyangdian Lake in 2014—2015
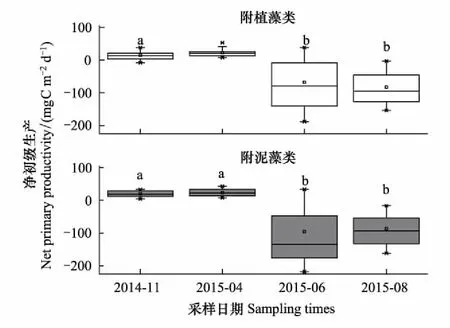
图8 2014—2015年白洋淀附着藻类净初级生产的时间变化 Fig.8 Temporal changes of the net primary production of periphyton in Baiyangdian Lake in 2014—2015
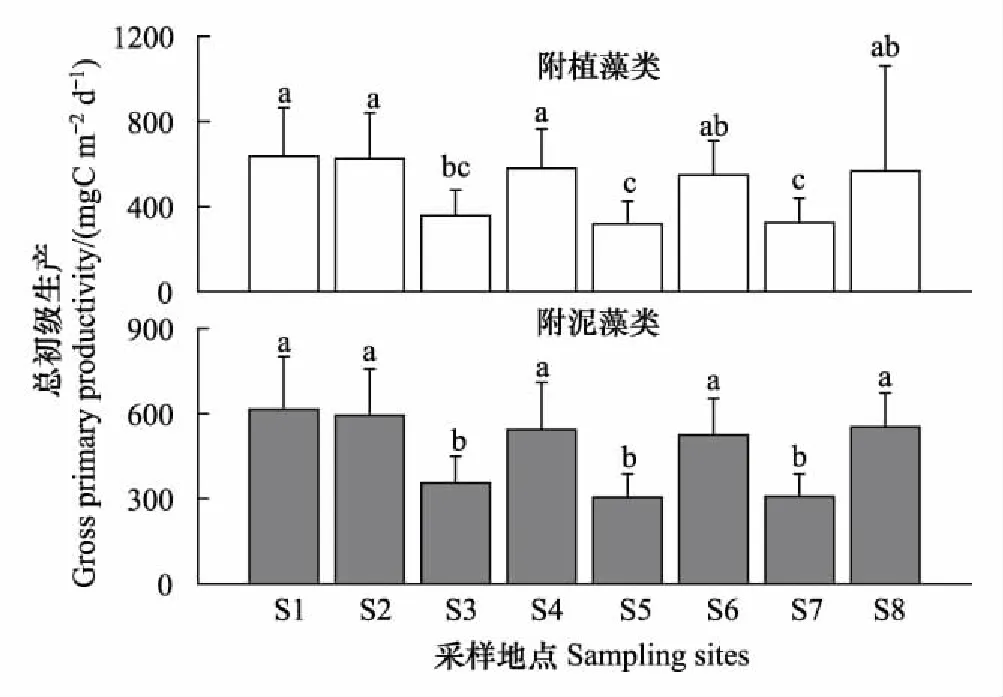
图9 2014—2015年白洋淀附着藻类总初级生产的空间分布 Fig.9 Spatial distributions of the gross primary productivity of periphyton in Baiyangdian Lake in 2014—2015
2.4 白洋淀附着藻类初级生产力与环境因子的关系
将附着藻类的生物量和初级生产(chla1,chla2,AFDW1,AFDW2,GPP1,GPP2,R1,R2,NPP1和NPP2)共10个指标作为功能指标,DCA排序结果显示4个排序轴长度都小于3,因此选择RDA方法对白洋淀附着藻类初
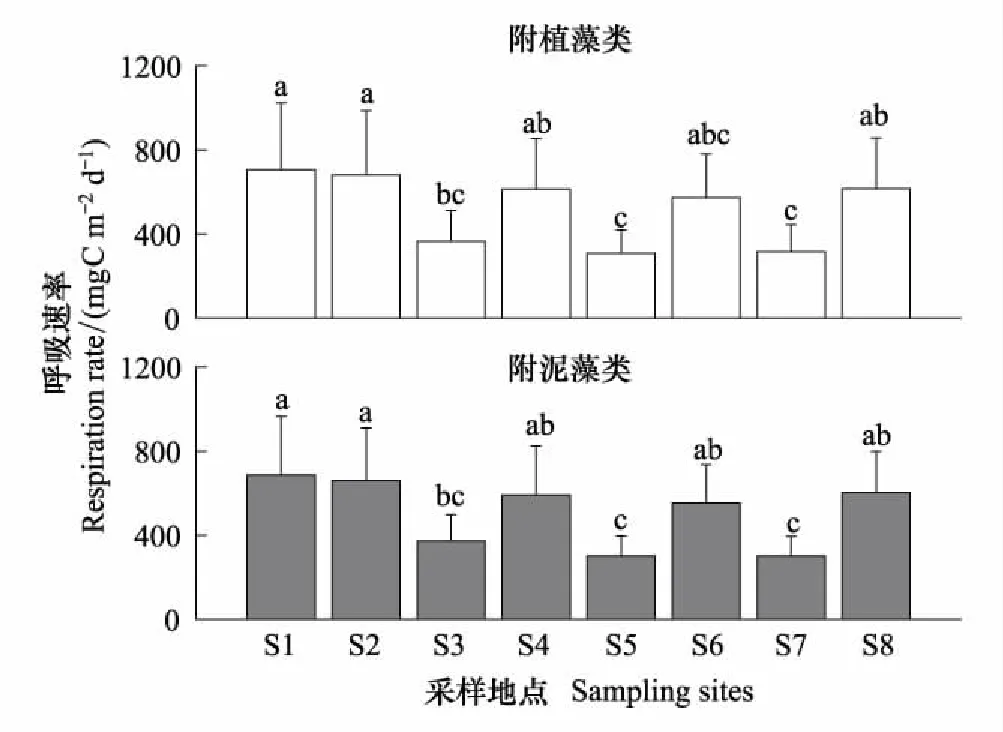
图10 2014—2015年白洋淀附着藻类呼吸速率的空间分布 Fig.10 Spatial distributions of the respiration rate of periphyton in Baiyangdian Lake in 2014—2015
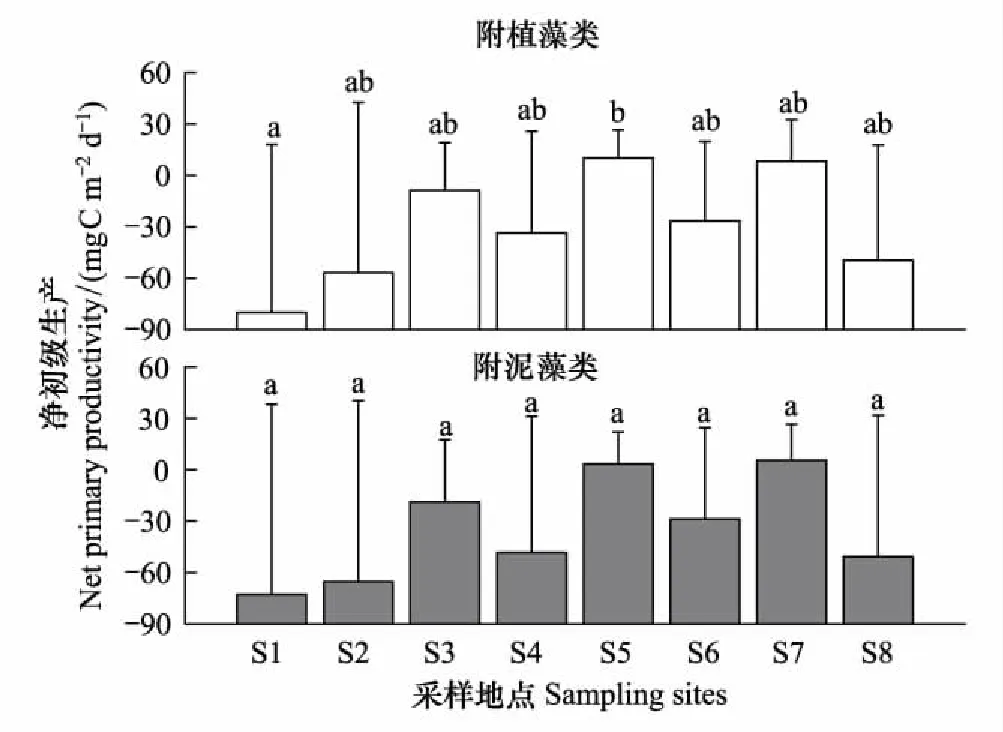
图11 2014—2015年白洋淀附着藻类净初级生产的空间分布 Fig.11 Spatial distributions of net primary productivity of periphyton in Baiyangdian Lake in 2014—2015
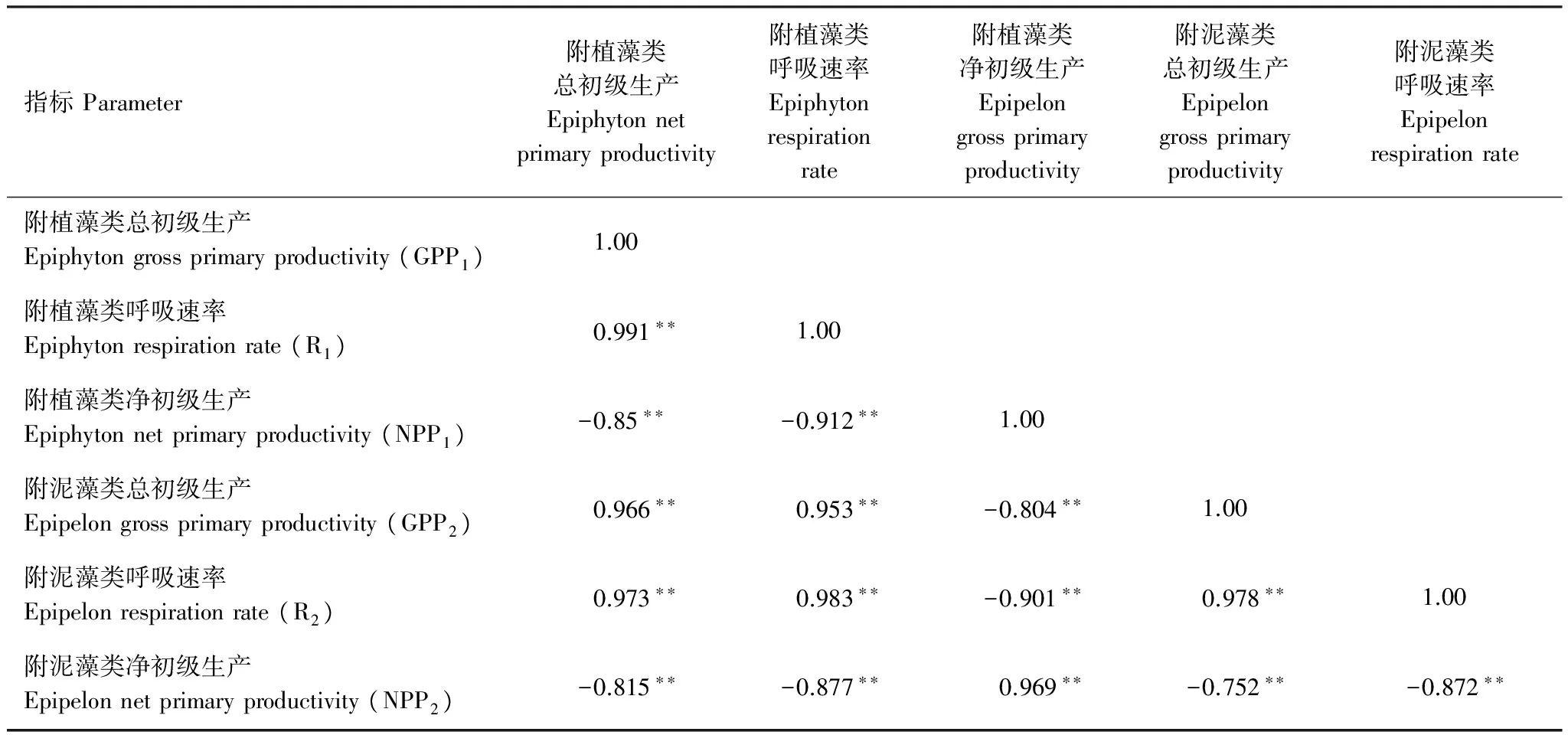
指标Parameter附植藻类总初级生产Epiphytonnetprimaryproductivity附植藻类呼吸速率Epiphytonrespirationrate附植藻类净初级生产Epipelongrossprimaryproductivity附泥藻类总初级生产Epipelongrossprimaryproductivity附泥藻类呼吸速率Epipelonrespirationrate附植藻类总初级生产Epiphytongrossprimaryproductivity(GPP1)1.00附植藻类呼吸速率Epiphytonrespirationrate(R1)0.991∗∗1.00附植藻类净初级生产Epiphytonnetprimaryproductivity(NPP1)-0.85∗∗-0.912∗∗1.00附泥藻类总初级生产Epipelongrossprimaryproductivity(GPP2)0.966∗∗0.953∗∗-0.804∗∗1.00附泥藻类呼吸速率Epipelonrespirationrate(R2)0.973∗∗0.983∗∗-0.901∗∗0.978∗∗1.00附泥藻类净初级生产Epipelonnetprimaryproductivity(NPP2)-0.815∗∗-0.877∗∗0.969∗∗-0.752∗∗-0.872∗∗
**, 在0.01水平(双侧)上显著相关
级生产与环境因子进行相关性分析。环境因子轴与功能排序轴的相关系数分别为0.98和0.87;两个功能排序轴近似垂直,相关系数为-0.04,两个环境排序轴的相关系数为0(表5),说明排序轴与环境因子间线性结合的程度较好地反映了附着生物功能与环境因子之间的关系,排序结果可靠[21]。首先对彼此强相关(R≥0.85,P<0.001)的环境因子进行筛选,再利用向前引入法对环境因子进行逐步筛选,Monte Carlo置换检验结果显示,共有8个环境因子达到显著水平,分别为TP(F=802.18,P=0.002),chla(F=20.19,P=0.002), NH4-N (F=6.28,P=0.002),T(F=4.91,P=0.014),pH (F=3.34,P=0.036),DO(F=7.07,P=0.006),SD(F=4.86,P=0.032), N/P (F=3.27,P=0.049)。附着藻类的生物量、初级生产与水质的相关关系的91.1%体现在第一排序轴上(表6),8个水质参数共解释了93.1%的总特征值,表明这8个环境因子对附着生物的生物量与初级生产的分布起主导作用。

表5 前两个排序轴和环境因子之间的相关系数
*在0.05水平上显著相关;**在0.01水平上显著相关
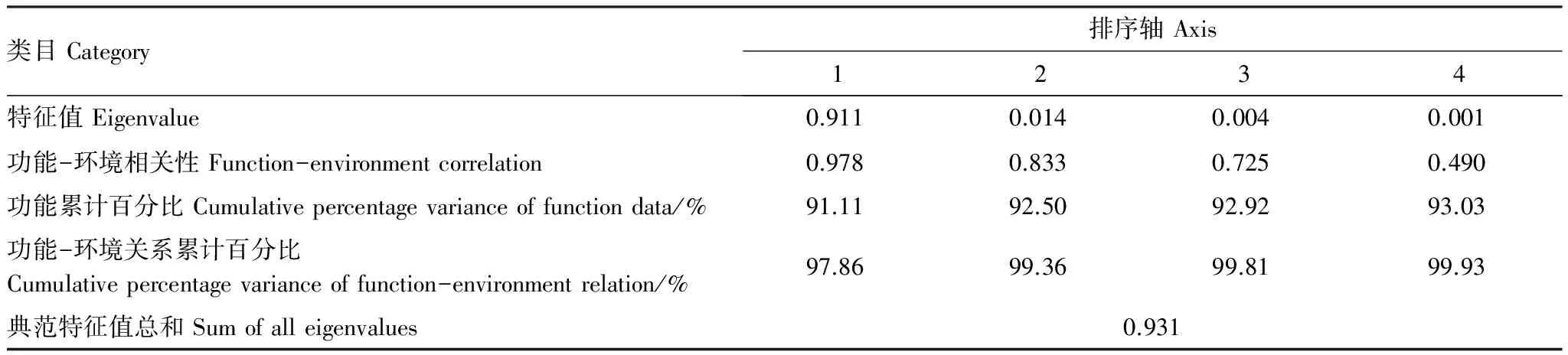
表6 附着生物与环境因子的RDA排序结果
白洋淀附着藻类与环境因子之间的关系可以很好的在RDA排序中表现出来(图12).第一排序轴与TP和chla呈显著正相关,与SD和N/P呈显著负相关,代表富营养化的梯度变化。在图12中从左到右,随着富营养化程度的增加,附着生物生物量(chla与AFDW)、总初级生产和呼吸速率相应增加,净初级生产相应减少;第二排序轴与pH、DO呈显著负相关。图12中,从上到下,随着pH和DO的增加,附着生物的总初级生产和净初级生产相应增加。

图12 附着藻类初级生产与水质参数间的RDA排序图Fig.12 RDA ordination of periphyton primary production and water quality parameters
3 讨论
附着藻类初级生产力和群落代谢是水生态系统中能量由初级生产者向高级营养水平转化或流动的基础。许多研究都表明附着藻类对于湖泊代谢具有重要意义。在早期的湖沼学研究中十分重视附着藻类在湖泊生态系统功能中的重要贡献[22-23],然而,近几十年来,学者们对浮游植物的重视远超附着藻类[24-25],因此,我们对湖泊中附着藻类的贡献仍需深入研究[26]。
3.1 白洋淀附着藻类的光合作用
附着藻类的生物量和光合作用具有明显的时空异质性,这种异质性不仅表现在不同的湖泊之间,也表现在同一湖泊内部(表7)。与其他浅水湖泊相比,白洋淀附着藻类总初级生产处在比较高的水平,但净初级生产则处于较低水平。这与不同湖泊的营养水平及污染程度密切相关。总体说来,富营养化程度越高的湖泊初级生产越高。通常,污水带,呼吸作用要远超过其初级生产,越靠近清水区,生产力和呼吸量都会下降,总初级生产与呼吸作用相当[37]。自2014年下半年,安新县制定出台了《清网行动实施方案》以规范白洋淀水产养殖秩序,逐步对淀区的网箱、网栏养殖进行清理和拆除,使得白洋淀水质明显改善,因此与2009—2010相比,2014—2015年的附着生物的呼吸作用明显减少,净初级生产显著增加。
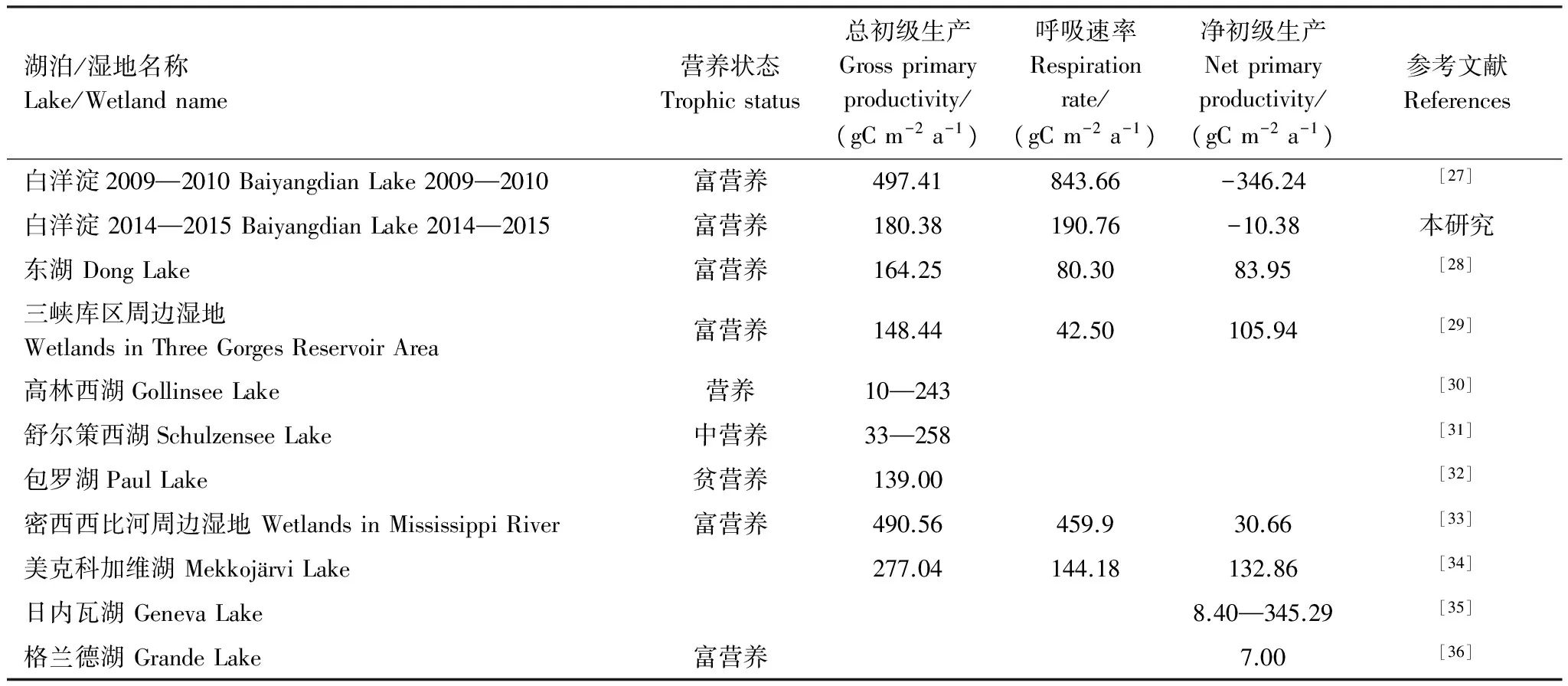
表7 浅水湖泊、湿地中附着藻类年初级生产力比较
附着藻类的现存量和初级生产力是藻类生产能力的重要体现,白洋淀附着藻类的现存量和初级生产力的时空变化表明在营养盐浓度较高的水域附着藻类现存量大、生产力高,营养盐浓度较低的水域附着藻类的生产力相对较低。白洋淀中两种附着藻类的GPP与R均显著相关(表7),这种现象多发生在富营养化水体中,主要是由于湖泊中的生物需要利用自养生物合成的有机物以维持呼吸速率,而在贫营养湖泊中,由于GPP较低,呼吸仍要依靠外来有机物的输入[38],在该种情况下,GPP与R之间的耦合取决于湖泊外部和内部的其他变量。而外部和沉积物中有机物的输入会更多地影响呼吸速率,从而使得二者的相关性进一步降低[39]。枣林庄、烧车淀和采蒲台的附着藻类群落的P/R≈1,说明其初级生产所消耗的营养元素绝大多数甚至全部来源于群落内部物质的循环,而非对上层水体中营养物质的吸收。尽管如此,却不可轻视附着藻类在生态系统中的作用,水体底层除自身生产的有机物外,还接纳了来自上层的有机颗粒,附着藻类是整个水生态系统分解者最为集中的区域,担负着物质循环中分解环节的主要任务,因此附着藻类起到了一个活的营养库的作用。通过光合作用附着藻类固定群落中分解产生的无机营养,再通过食物链在群落内形成物质循环,使得营养物质在群落内部有效地再循环和保存,从而减少对群落之外水体的营养排放。
3.2 营养盐及N/P对附着藻类的影响
许多环境因子都与附着藻类代谢的时空分布变化密切相关[40],如基质的类型、风速与风向、光照、有无大型水生植物、河流的汇入以及湖泊周边的陆生植被等都会影响附着藻类的结构和功能[41-43],但在众多因子中,营养盐浓度的作用显得尤为突出[44]。从RDA分析中可以看出,两种附着藻类的AFDW, GPP和R与富营养化程度(第一排序轴)显著相关,相比之下,NPP与第一轴的相关性相对较低(图8)。这表明NPP除了受营养盐的影响以外,比起AFDW GPP和R更易受到更多其他环境因素的影响,如pH,DO, 光照,其他消费者等。氮磷等营养盐与功能轴的相关性明显高于透明度(表5),这说明在白洋淀中,相比于光,营养物质对附着藻类的影响更大。这与太湖[45]、东湖[28]及丹麦湖泊[9]结果较为一致。
3.3 附着藻类与浮游藻类的关系
在附着藻类与环境因子的RDA分析中,浮游藻类叶绿素a与功能排序轴显著相关,相关系数为0.92(表5)。这是因为在附着藻类和浮游藻类GPP之间存在一种代偿权衡的关系,浮游植物会影响附着生物对光的利用[37]。在很多情况下,附着藻类的生长主要是受到光的限制,而不是营养物质的限制。尤其是附泥藻类的营养需求通过内沉积物的矿化作用即可满足[46]。因此,相比之下,营养物质更易引起浮游植物的生长繁殖,并因此降低了水体的透明度,从而抑制了附着藻类的初级生产。因此仅通过浮游植物计算全湖的初级生产可能会造成对整个湖泊初级生产的高估[47]。但在本研究中,附着藻类的采集区都在非常浅的水域,光并非限制因子,此时,营养物质在促进浮游植物初级生产的同时也会促进附着藻类初级生产的增长[46, 48]。有研究表明:当水体中的磷浓度小于0.01mg/L时,附着藻类初级生产主要取决于光的减弱程度,当磷浓度低于这个水平,增加营养物质可能会增加附着藻类的初级生产[46],也可能没什么影响[49]。但当磷浓度在0.01—0.1mg/L,或磷负荷达到2—5mg m-2d-1时,浮游植物对光的遮挡就会影响附着藻类的初级生产,使得附着藻类初级生产减少,进而促进沉积物中营养物质的释放从而使得浮游植物生产进一步升高[46]。在本研究中,白洋淀的磷浓度在0.04—0.74 mg/L之间,随着磷浓度的增加,浮游植物增加,附着藻类的初级生产随之增加,这与许多研究的变化趋势是一致的[50-51]。
4 结论
2014—2015年白洋淀附植藻类和附泥藻类的年均chla分别为128.14和151.74μg/cm2,AFDW为2.49和2.79g/m2;GPP分别为494.20mgC m-2d-1和474.45mgC m-2d-1,R为522.63mgC m-2d-1和508.98mgC m-2d-1,NPP为-28.44mgC m-2d-1和-34.52mgC m-2d-1。附着藻类的生物量和初级生产具有显著的时空异质性,8月最高,6月次之,4月和11月最低;空间分布呈自西向东递减的趋势,在府河入淀口和南刘庄处最高,枣林庄和采蒲台最低;水质较好的区域NPP为正值,表明这些区域以自养型群落为主,水质较差的区域NPP为负值,以异养型群落为主。附着藻类的生物量和初级生产主要受到总磷、 浮游植物叶绿素a、 高锰酸盐指数、氨氮、水温、透明度、溶解氧和氮磷比这8个水质因子的影响。
[1] 胡勇军, 孙刚, 韩德复. 长春南湖水生生态系统的初级生产(I)—浮游植物. 东北师大学报: 自然科学版, 2001, 33(2): 80- 83.
[2] 王骥, 沈国华. 武汉东湖浮游植物的初级生产力及其与若干生态因素的关系. 水生生物学集刊, 1981, 7(3): 295- 311.
[3] 秦伯强. 湖泊生态恢复的基本原理与实现. 生态学报,2007,27(11):4848- 4858.
[4] Flipo N, Rabouille C, Poulin M, Even S, Tusseau-Vuillemin M H, Lalande M. Primary production in headwater streams of the seine basin: the grand morin river case study. Science of the Total Environment, 2007, 375(1/3): 98- 109.
[5] Goldsborough L G, Hickman M. A comparison of periphytic algal biomass and community structure onScirpusvalidusand on a morphologically similar artificial substratum. Journal of Phycology, 1991, 27(2): 196- 206.
[6] Duthie H C. A study of the distribution and periodicity of some algae in a bog pool. Journal of Ecology, 1965, 53(2): 343- 359.
[7] Vis C, Hudon C, Carignan R, Gagnon P. Spatial analysis of production by macrophytes, phytoplankton and epiphyton in a large river system under different water-level conditions. Ecosystems, 2007, 10(2): 293- 310.
[8] Ivanova E A, Anishchenko O V, Glushchenko L A, Gaevsky N A, Kolmakov V I.Contribution of different groups of autotrophs to the primary production of the mountain Lake Oiskoe. Contemporary Problems of Ecology, 2014, 7(4): 397- 409.
[9] Liboriussen L, Jeppesen E. Temporal dynamics in epipelic, pelagic and epiphytic algal production in a clear and a turbid shallow lake. Freshwater Biology, 2003, 48(3): 418- 431.
[10] Hart E A, Lovvorn J R. Vegetation dynamics and primary production in saline, lacustrine wetlands of a rocky mountain basin. Aquatic Botany, 2000, 66(1): 21- 39.
[11] Ask J, Karlsson J, Persson L, Ask P, Byström P, Jansson M. Whole-lake estimates of carbon flux through algae and bacteria in benthic and pelagic habitats of clear-water lakes. Ecology, 2009, 90(7): 1923- 1932.
[12] Ask J, Karlsson J, Jansson M. Net ecosystem production in clear-water and brown-water lakes. Global Biogeochemical Cycles, 2012, 26(1): GB1017.
[13] Karlsson J, Säwström C. Benthic algae support zooplankton growth during winter in a clear-water lake. Oikos, 2009, 118(4): 539- 544.
[14] Allende L, Tell G, Zagarese H, Torremorell A, Pérez G, Bustingorry J, Escaray R, Izaguirre I. Phytoplankton and primary production in clear-vegetated, inorganic-turbid, and algal-turbid shallow lakes from the pampa plain (Argentina). Hydrobiologia, 2009, 624(1): 45- 60.
[15] Torremorell A, Llames M E, Pérez G L, Escaray R, Bustingorry J, Zagarese H. Annual patterns of phytoplankton density and primary production in a large, shallow lake: the central role of light. Freshwater Biology, 2009, 54(3): 437- 449.
[16] Dubourg P, North R L, Hunter K, Vandergucht D M, Abirhire O, Silsbe G M, Guildford S J, Hudson J J. Light and nutrient co-limitation of phytoplankton communities in a large reservoir: lake Diefenbaker, Saskatchewan, Canada. Journal of Great Lakes Research, 2015, 41: 129- 143.
[17] 邢鹏,孔繁翔,曹焕生,张民. 太湖浮游细菌与春末浮游藻类群落结构演替的相关分析. 生态学报,2007, 27(5): 1696- 1702.
[18] Vadeboncoeur Y, Peterson G, Vander Zanden M J, Kalff J. Benthic algal production across lake size gradients: Interactions among morphometry, nutrients, and light. Ecology, 2008, 89(9): 2542- 2552.
[19] 刘春兰,谢高地,肖玉. 气候变化对白洋淀湿地的影响. 长江流域资源与环境, 2007, 16 (2): 245- 250.
[20] Morin S, Coste M, Delmas F. A comparison of specific growth rates of periphytic diatoms of varying cell size under laboratory and field conditions. Hydrobiologia, 2008, 614(1): 285- 297.
[21] ter Braak C J F. Canonical correspondence analysis: a new eigenvector technique for multivariate direct gradient analysis. Ecology, 1986, 67(5): 1167- 1179.
[22] Lindeman R L. The trophic-dynamic aspect of ecology. Ecology, 1942, 23(4): 399- 417.
[23] Forbes S A. The lake as a microcosm. Illinois Natural History Survey Bulletin, 1925, 15(9): 537- 550. Vadeboncoeur Y, Vander Zanden M J, Lodge D M. Putting the lake back together: reintegrating benthic pathways into lake food web models: lake ecologists tend to focus their research on pelagic energy pathways, but, from algae to fish, benthic organisms form an integral part of lake food webs. BioScience, 2002, 52(1): 44- 54.
[24] Lodge D M, Blumenshine S C, Vadeboncoeur Y. Insights and application of large-scale, long-term ecological observations and experiments//Resetarits W J J, Bernardo J, eds. The State of Experimental Ecology: Questions Levels and Approaches. London: Oxford University Press, 1998: 202- 205.
[25] Stevenson R J, Bothwell M L, Lowe R L, Thorp J H. Algal Ecology: Freshwater Benthic Ecosystem. San Diego, United States: Academic Press, 1996: 3- 30
[26] Odum H T. Primary production in flowing waters. Limnology and Oceanography, 1956, 1(2): 102- 117.
[27] 马牧源. 白洋淀流域生物膜群落对人为干扰的响应[D]. 北京: 北京师范大学, 2011.
[28] 裴国凤, 洪晓星. 东湖底栖藻类群落的初级生产力. 中南民族大学学报: 自然科学版, 2010, 29(4): 27- 31.
[29] Ge J W, Wu S Y, Touré D, Cheng L M, Miao W J, Cao H F, Pan X Y, Li J F, Yao M M, Feng L. Analysis on biomass and productivity of epilithic algae and their relations to environmental factors in the Gufu River basin, Three Gorges Reservoir area, China. Environmental Science and Pollution Research, 2015: 1- 12, doi: 10.1007/s11356-015- 4112- 8. (in Press)
[30] Brothers S M, Hilt S, Meyer S, Köhler J. Plant community structure determines primary productivity in shallow, eutrophic lakes. Freshwater Biology, 2013, 58(11): 2264- 2276.
[31] Mehner T, Attermeyer K, Brauns M, Brothers S, Diekmann J, Gaedke U, Grossart H P, Köhler J, Lischke B, Meyer N, Scharnweber K, Syväranta J, Vanni M J, Hilt S. Weak response of animal allochthony and production to enhanced supply of terrestrial leaf litter in nutrient-rich lakes. Ecosystems, 2016, 19(2): 311- 325.
[32] Vadeboncoeur Y, Lodge D M, Carpenter S R. Whole-lake fertilization effects on distribution of primary production between benthic and pelagic habitats. Ecology, 2001, 82(4): 1065- 1077.
[33] Murdock J N, Shields F D Jr, Lizotte R E Jr. Periphyton responses to nutrient and atrazine mixtures introduced through agricultural runoff. Ecotoxicology, 2013, 22(2): 215- 230.
[34] Vesterinen J, Devlin S P, Syväranta J, Jones R I. Accounting for littoral primary production by periphyton shifts a highly humic boreal lake towards net autotrophy. Freshwater Biology, 2016, 61(3): 265- 276.
[35] Sager L. Measuring the trophic status of ponds: relationships between summer rate of periphytic net primary productivity and water physico-chemistry. Water Research, 2009, 43(6): 1667- 1679.
[36] Rodríguez P, Pizarro H. Phytoplankton and periphyton production and its relation to temperature in a humic lagoon. Limnologica-Ecology and Management of Inland Waters, 2015, 55: 9- 12.
[37] Vadeboncoeur Y, Steinman A D. Periphyton function in lake ecosystems. The Scientific World Journal, 2002, 2: 1449- 1468.
[38] Hanson P C, Bade D L, Carpenter S R, Kratz T K. Lake metabolism: relationships with dissolved organic carbon and phosphorus. Limnology and Oceanography, 2003, 48(3): 1112- 1119.
[39] Solomon C T, Bruesewitz D A, Richardson D C, Rose K C, Van de Bogert M C, Hanson P C, Kratz T K, Larget B, Adrian R, Babin B L, Chiu C Y, Hamilton D P, Gaiser E E, Hendricks S, Istvànovics V, Laas A, O′Donnell D M, Pace M L, Ryder E, Staehr P A, Torgersen T, Vanni M J, Weathers K C, Zhu G W. Ecosystem respiration: drivers of daily variability and background respiration in lakes around the globe. Limnology and Oceanography, 2013, 58(3): 849- 866.
[40] Van de Bogert M C, Bade D L, Carpenter S R, Cole J J, Pace M L, Hanson P C, Langman O C. Spatial heterogeneity strongly affects estimates of ecosystem metabolism in two north temperate lakes. Limnology and Oceanography, 2012, 57(6): 1689- 1700.
[41] Laas A, Nõges P, Kõiv T, Nõges T. High-frequency metabolism study in a large and shallow temperate lake reveals seasonal switching between net autotrophy and net heterotrophy. Hydrobiologia, 2012, 694(1): 57- 74.
[42] Muduli P R, Kanuri V V, Robin R S, Kumar B C, Patra S, Raman A V, Rao G N, Subramanian B R. Spatio-temporal variation of CO2emission from chilika lake, a tropical coastal lagoon, on the east coast of India. Estuarine, Coastal and Shelf Science, 2012, 113: 305- 313.
[43] They N H, da Motta Marques D, Souza R S. Lower respiration in the littoral zone of a subtropical shallow lake. Frontiers in Microbiology, 2012, 3: 434.
[44] 张景平,黄小平. 海草附生藻类生物量的主要影响因子. 生态学报,2009,29(10): 5611- 5617.
[45] 宋玉芝, 秦伯强, 高光. 氮及氮磷比对附着藻类及浮游藻类的影响. 湖泊科学, 2007, 19(2): 125- 130.
[46] Jäger C G, Diehl S. Resource competition across habitat boundaries: asymmetric interactions between benthic and pelagic producers. Ecological Monographs, 2014, 84(2): 287- 302.
[47] Daniels W C, Kling G W, Giblin A E. Benthic community metabolism in deep and shallow arctic lakes during 13 years of whole-lake fertilization. Limnology and Oceanography, 2015, 60(5): 1604- 1618.
[48] Hansson L A. Factors regulating periphytic algal biomass. Limnology and Oceanography, 1992, 37(2): 322- 328.
[49] Genkai-Kato M, Vadeboncoeur Y, Liboriussen L, Jeppesen E. Benthic-planktonic coupling, regime shifts, and whole-lake primary production in shallow lakes. Ecology, 2012, 93(3): 619- 631.
[50] 张晶, 刘存歧. 金鱼藻附生生物初级生产力的研究. 环境科学与技术, 2015, 38(9): 24- 29.
[51] McCormick P V, O′Dell M B, Shuford R B E III, Backus J G, Kennedy W C. Periphyton responses to experimental phosphorus enrichment in a subtropical wetland. Aquatic Botany, 2001, 71(2): 119- 139.
