不同剂量地佐辛对丙泊酚靶控输注全身麻醉下BIS和AEPI的影响
2018-03-08王馨
王馨
(河北省承德市中心医院,河北 承德 067000)
近年来,阿片类新型麻醉药物陆续出现,促使临床上麻醉技术持续变化,同时也要求麻醉管理水平达到更高层次,其中最重要需要关注的是麻醉深度及监测[1]。麻醉深度是患者被实施麻醉后,患者的刺激反应程度、镇痛水平及镇静水平等综合的反应,当前针对麻醉深度的定义没有确切解释。传统监测患者麻醉深度的方法可以反应其临床上的征象变化,例如血压、心率、瞳孔反射、眼球运动、流泪、出汗及体动反应等[2]。然而上述指标所受影响因素较多,特异性不强,加上临床上复合使用麻醉药物,已不能对麻醉深度做出准确反应,所致的术中问题越来越严重[3]。目前,脑电技术检测麻醉深度正成为麻醉监测重要方法,主要监测指标为脑电双频指数(bispectral index,BIS)和听觉诱发电位指数(auditory evoked potential index,AEPI),患者意识的恢复程度可以通过上述2个指标来评价,前者主要反应患者的镇静程度,后者则反应患者镇痛、镇静程度[4]。关于BIS、AEPI可受阿片类麻醉药的影响,已有相关报道过,主要研究吸入麻醉下μ阿片受体激动剂(芬太尼等)的影响,对静脉注射下影响的研究依然较少[5]。因此,本研究探讨不同剂量的地佐辛(阿片类受体的激动-拮抗剂)对丙泊酚靶控输注全身麻醉下BIS和AEPI的影响,为阿片类麻醉药的临床合理用药提供指导。
1 资料与方法
1.1 一般资料
选取2014年10月-2015年7月于承德市中心医院进行全身麻醉手术的100例患者作为研究对象。按照随机数字法分为4组,每组25例,分别为F组(芬太尼对照组),以及按照地佐辛的剂量不同分为D1、D2、D3组。上述所有研究对象在年龄、体重、身高、体重指数(BMI)、ASA分级以及体温等基本参数的比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究经本院伦理委员会批准。

表1 各组患者基本情况比较 (n=25)
1.2 纳入和排除标准
1.2.1 纳入标准 ①患者为20~65岁;②麻醉分级为ASA Ⅰ级或Ⅱ级;③BMI为18~26 kg/m2;④血红蛋白(Hb)>120 g/L,红细胞压积(Hct)>35%,血小板计数(Plt)>100×109/L。
1.2.2 排除标准 ①水、酸碱平衡、电解质紊乱及内分泌紊乱;②重度肝功能及肾功能不全;③呼吸道梗阻、支气管哮喘、呼吸功能不全;④重度心脑血管疾病,如颅内高压或脑损伤;⑤阿片类药物的成瘾史;⑥曾患有精神病;⑦短期内阿片类药物服用史;⑧长期大量服用精神类药物,如镇静药等。
1.3 方法
1.3.1 麻醉方法 实施麻醉前记录并保存所有患者的性别、年龄、身高、体重、BMI、ASA分级以及即将进行的手术类型。术前所有患者禁水6 h,禁食12 h。入室后,建立前臂静脉通路,滴注乳酸钠林格溶液10 ml/(kg·h),5 min后采用2%利多卡因进行表面麻醉。吸氧3 min后利用靶控输注泵进行丙泊酚靶控输注,初始浓度为1.0μg/ml,并以0.5μg/ml递增至BIS不超过60,AEPI不超过40,静脉滴注0.6 mg/kg罗库溴铵3 min,再进行气管插管,实施机械通气,并调整丙泊酚浓度为3~4μg/ml以维持麻醉状态。待15 min后血流动力学稳定,各组分别静脉滴注1μg/kg芬太尼(F组),0.05 mg/kg地佐辛(D1组),0.10 mg/kg地佐辛(D2组),0.15 mg/kg地佐辛(D3组)。
1.3.2 常规指数监测 采用多功能监护仪(Philips)监测患者的体温、心电图(ECG)、脉搏血氧饱和度(SpO2)以及无创血压(NIBP)等。
1.3.3 BIS监测 采用数量化脑电图检测仪(AspectA2000X-PTM)监测BIS。采用酒精脱脂皮肤,然后接BIS电极,负极位于右侧太阳穴的平眼角、参考电极位于前额右侧的眉骨上方、正极位于前额正中,保持>5kΩ的皮肤阻抗,0.5~50 Hz的滤波范围,SQI>50%。
1.3.4 AEPI监测 利用无创麻醉深度(Danmeter,A-1ine)监测仪对AEPI进行监测。清洁皮肤,接上AEPI监测电极,左乳突黑色负极,前额左侧绿色参考极、前额正中白色正极,维持>5kΩ电阻,耳机音量设定为60 dB、40 Hz。
1.4 观察指标
观察并记录全身麻醉诱导前(T)、给药前(T0)、给药后 3 min(T1)、6 min(T2)、9 min(T3)、12 min(T4)、15 min(T5)各时点的心率(HR)、平均动脉压(MAP)、BIS、AEPI。
1.5 统计学方法
所有数据采用SPSS19.0软件进行分析,计量资料采用均数±标准差(±s)表示,两组间比较采用t检验,计数资料以例表示,采用χ2检验,同一时间点多组间比较采用单因素方差分析,多时间点比较采用重复测量设计的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 血流动力学变化
2.1.1 HR①F组与不同给药剂量组比较有差别(F=5.948,P=0.007);②F组不同时间点比较无差别(F=0.694,P=0.500),不同给药剂量组不同时间点比较有差别(F=4.327,P=0.024);③组间、不同时间点比较有差别(F=4.978,P=0.013)。见表2。
2.1.2 MAP ①F组与不同给药剂量组比较有差别(F=6.332,P=0.002);②F组不同时间点比较无差别(F=2.775,P=0.064),不同给药剂量组不同时间点比较有差别(F=4.537,P=0.021);③组间、不同时间点比较有差别(F=5.348,P=0.009)。见表2。
表2 各组患者血流动力学指标比较 (n=25,±s)
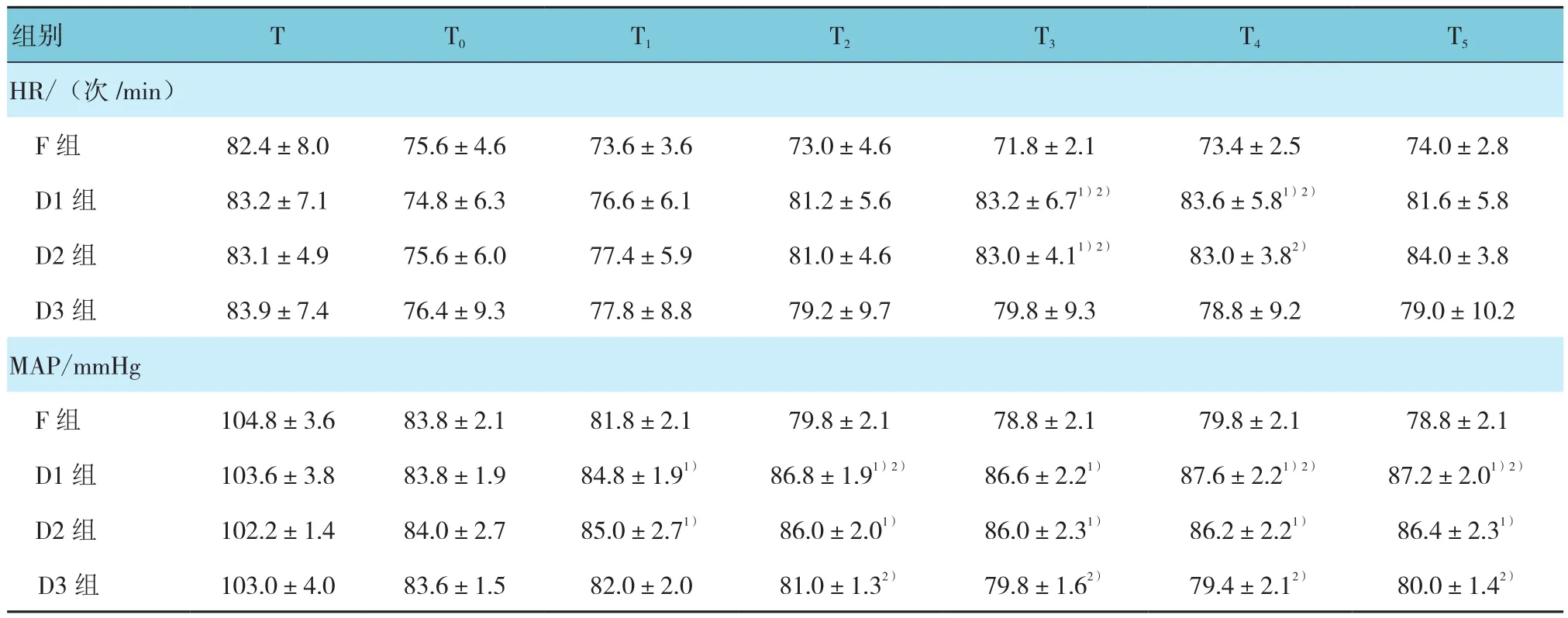
表2 各组患者血流动力学指标比较 (n=25,±s)
注:1)与F组相比,P<0.05;2)与T0时间段比较,P<0.05
组别 T T0 T1 T2 T3 T4 T5 HR/(次 /min)F 组 82.4±8.0 75.6±4.6 73.6±3.6 73.0±4.6 71.8±2.1 73.4±2.5 74.0±2.8 D1组 83.2±7.1 74.8±6.3 76.6±6.1 81.2±5.6 83.2±6.71)2) 83.6±5.81)2) 81.6±5.8 D2组 83.1±4.9 75.6±6.0 77.4±5.9 81.0±4.6 83.0±4.11)2) 83.0±3.82) 84.0±3.8 D3 组 83.9±7.4 76.4±9.3 77.8±8.8 79.2±9.7 79.8±9.3 78.8±9.2 79.0±10.2 MAP/mmHg F 组 104.8±3.6 83.8±2.1 81.8±2.1 79.8±2.1 78.8±2.1 79.8±2.1 78.8±2.1 D1 组 103.6±3.8 83.8±1.9 84.8±1.91) 86.8±1.91)2) 86.6±2.21) 87.6±2.21)2) 87.2±2.01)2)D2组 102.2±1.4 84.0±2.7 85.0±2.71) 86.0±2.01) 86.0±2.31) 86.2±2.21) 86.4±2.31)D3组 103.0±4.0 83.6±1.5 82.0±2.0 81.0±1.32) 79.8±1.62) 79.4±2.12) 80.0±1.42)
2.2 BIS和AEPI的变化
2.2.1 BIS ①F组与不同给药剂量组比较有差别(F=6.536,P=0.000);②F组不同时间点比较无差别(F=1.836,P=0.120),不同给药剂量组不同时间点比较有差别(F=4.923,P=0.015);③组间、不同时间点比较相比有差别(F=5.879,P=0.007)。见表3。
2.2.2 APEI ①F组与不同给药剂量组比较有差别(F=8.325,P=0.000);②F组不同时间点比较无差别(F=2.197,P=0.068),不同给药剂量组不同时间点比较有差别(F=6.426,P=0.000);③组间、不同时间点比较有差别(F=7.257,P=0.000)。见表3。
表3 各组患者BIS和AEPI变化情况比较 (n=25,±s)

表3 各组患者BIS和AEPI变化情况比较 (n=25,±s)
注:1)与F组相比,P<0.05;2)与T0时间段比较,P<0.05
组别 T T0 T1 T2 T3 T4 T5 BIS F 组 95.5±2.4 47.2±1.4 50.2±1.4 49.2±1.4 49.2±3.3 49.2±1.4 49.2±1.4 D1 组 96.4±1.8 47.2±3.2 52.2±3.6 56.8±2.81)2) 57.4±3.21)2) 56.8±2.81)2) 56.8±2.81)2)D2组 95.6±2.0 46.6±3.6 51.6±3.62) 52.6±3.62) 53.6±3.62) 52.6±3.62) 52.8±3.42)D3 组 94.8±2.9 47.4±2.9 48.6±3.0 47.6±3.0 49.4±2.9 46.4±2.4 46.2±2.3 AEPI F 组 86.9±10.1 27.2±1.4 30.2±1.4 29.2±1.4 31.2±3.3 29.2±1.4 29.2±1.4 D1 组 86.0±10.9 27.2±3.2 32.2±3.2 36.8±2.81)2) 37.4±3.21)2) 36.8±2.81)2) 36.8±2.81)2)D2组 87.8±9.6 26.6±4.0 31.6±3.62) 32.6±3.62) 33.6±3.62) 32.6±3.62) 32.8±3.42)D3 组 86.8±9.8 27.4±2.9 28.6±3.0 27.6±3.0 29.4±2.9 26.4±2.4 26.2±2.3
3 讨论
为维持生命体征平稳,全身麻醉常常被用于临床上,其目的旨在使患者机体保持肌松、镇痛、镇静、抑制牵拉反应。以往主要通过阿片类药物(如芬太尼等)达到镇痛效果[6]。作为阿片μ受体激动剂,芬太尼药效快,维持麻醉时间较短,并对心血管产生的副作用较小,因此临床上被大量应用[7]。同为阿片类镇痛药物的地佐辛,其麻醉镇痛的作用机制不同于芬太尼,其对μ受体作用比较弱,对κ受体激动作用较全面,具有有效的镇痛作用[8]。已有研究[9]证明地佐辛临床疗效较吗啡占优,不存在明显的呼吸以及心血管系统等副作用,另外,患者对其依赖性比较低。本研究结果表明,3~4μg/ml丙泊酚靶控输注全身麻醉下,相较于芬太尼组,0.15 mg地佐辛静脉注射对血流动力学HR及MAP的影响没有统计学意义,表明该剂量下的地佐辛能够使血流动力学保持稳定,其抑制心血管系统,且与丙泊酚一起发生协同作用,从而抑制交感神经活动,维持循环平稳。主要机制可能为地佐辛通过激动脊髓的κ受体发挥作用,使得儿茶酚胺的分泌受到抑制,从而维持血流动力学的稳定。
近些年来,诸多研究资料表明,BIS与丙泊酚、七氟烷、咪达唑仑等麻醉药物的浓度相关性较好,其中与丙泊酚最好,然而BIS是否受阿片类药物调控仍然存在较大争议[10]。BIS及AEPI的水平都能体现出患者意识情况,其中BIS反应镇静程度,AEPI则反应镇静及镇痛程度,两者数据范围为0~100,如数值越小则麻醉越深,反之麻醉越浅[11]。本研究结果表明,相较于芬太尼组,0.10 mg和0.15 mg地佐辛静脉注射对BIS及AEPI值差异没有统计学意义,且0.15 mg地佐辛对各个时间点的BIS及AEPI值均没有明显变化,表明该剂量下的地佐辛够维持麻醉深度。导致上述情况的原因猜测为:使用较低剂量的地佐辛时,其通过血脑屏障,拮抗中枢神经系统μ受体,发挥激动及兴奋作用,从而使得BIS及AEPI升高,而当剂量增大后,患者脑部电活动增强受到抑制,镇静效果增加,引起BIS及AEPI变化不明显[12]。本结果可知地佐辛经静脉滴注后,不仅能够增加AEPI与BIS值,也能够使血流动力学稳定,推测地佐辛不仅能够通过κ受体产生外周神经抑制及中枢神经镇静作用,可能还存在其他未知途径[13],如地佐辛不仅将痛觉冲动传导阻断,又能够令脑干边缘系统得到兴奋,并且能间接使交感神经兴奋,脑代谢与脑血流量增加,导致BIS及AEPI增加[14]。
综上所述,不同剂量地佐辛对丙泊酚全身麻醉患者的血流动力学参数及麻醉深度存在一定影响,说明剂量为0.15 mg/kg地佐辛可用于全身麻醉,可达有效的麻醉深度,维持稳定的术前血流动力学。
[1]贾茜茜,刘小颖.麻醉深度监测的研究进展[J].中国微创外科杂志,2014,20(1): 81-83.
[2]KENT C D,DOMINO K B.Depth of anesthesia[J].Current Opinion in Anaesthesiology,2009,22(6): 782-787.
[3]LUK T T H,JIA B,PANG E Y T,et al.Depth of anesthesia and postoperative delirium[J].Current Anesthesiology Reports,2015,5(1): 1-9.
[4]HUANG H H,WU C Y,LIN F S,et al.The alaris auditory evoked potential monitor as an indicator of seizure inducibility and duration during electroconvulsive therapy: an observational study[J].Bmc Anesthesiology,2014,14(1): 1-5.
[5]MATSUSHITA S,ODA S,OTAKI K,et al.Change in auditory evoked potential index and bispectral index during induction of anesthesia with anesthetic drugs[J].Journal of Clinical Monitoring& Computing,2015,29(5): 1-6.
[6]徐振东,林蓉,刘志强,等.全身麻醉药对发育期大脑的影响:毒性作用还是保护作用[J].中国临床医学,2014,(3): 370-373.
[7]SMITH M D,YANG W,CUDNIK M,et al.The effectiveness and adverse events of morphine versus fentanyl on a physicianstaffed helicopter[J].Journal of Emergency Medicine,2012,43(1):69-75.
[8]乔微,卢飞飞,殷琴,等.地佐辛的镇痛作用与κ受体关系的研究[J].南通大学学报(医学版),2012,32(5): 353-355.
[9]黎环.地佐辛、吗啡、纳布啡对于门诊患者术后镇痛效果的比较[J].中国医院药学杂志,2013,33(12): 978-981.
[10]王丽珊,杜静敏,赵彦君.BIS反馈靶控输注丙泊酚复合瑞芬太尼在无痛人流术中的应用[J].实用医学杂志,2012,28(18):3034-3036.
[11]HSU C W,SUN S F,CHU K A,et al.Monitoring sedation for bronchoscopy in mechanically ventilated patients by using the Ramsay sedation scale versus auditory-evoked potentials[J].Bmc Pulmonary Medicine,2014,14(4): 15.
[12]耿立成,李丽,冯洁.地佐辛药理及临床应用新进展[J].医学综述,2012,18(23): 4029-4031.
[13]胡剑平,李佩铂,刘志慧.地佐辛在围术期的临床应用[J].中国社区医师(医学专业),2012,14(22): 41-41.
[14]方崇杰,马逸俊,陈孟军,等.地佐辛对颅脑损伤患者麻醉苏醒期血流动力学指标影响[J].心脑血管病防治,2015(5): 412-414.
