sB7-H3、IL-17和IL-8对原发性肝癌的诊断效果
2018-03-08赵和平于燕
赵和平,于燕
(西安交通大学医学院附属红会医院 检验科,陕西 西安 710054)
机体抗肿瘤免疫应答过程涉及到多种免疫分子和免疫细胞的变化[1]。机体抗肿瘤免疫应答过程中发挥重要作用的免疫分子之一为协同共刺激分子,分为可溶性协同共刺激分子和膜型协同共刺激分子[2]。已有研究[3]证实B7-H3除能够在B细胞、活化的T细胞、树突状细胞和单核细胞内表达外,还能够在多种实体瘤组织内表达,已经成为肿瘤临床诊断的新靶点,且其参与炎症性疾病的发生和发展过程。本研究对sB7-H3、IL-17和IL-8对原发性肝癌的诊断效果进行了探究,以期能为后期临床治疗提供参考,现报道如下。
1 资料与方法
1.1 一般资料
选取2014年1月-2015年1月西安交通大学医学院附属红会医院收治的45例原发性肝癌患者为观察组,并选取同期该院健康检查的45名健康志愿者作为对照组。观察组男性35例,女性10例。年龄34~74岁,平均(58.39±11.23)岁。临床分期:Ⅰ、Ⅱ期27例,Ⅲ期18例。10例患者发生远处转移。对照组男性32例,女性13例。年龄32~75岁,平均(59.75±11.36)岁。该研究已经获得医院伦理学委员会的批准。
纳入标准:①经临床诊断为原发性肝癌的患者[4];②研究前6个月内没有发生感染的患者;③自愿参加本项研究并已经签署知情书的患者。排除标准:①合并其他自身免疫系统疾病的患者;②存在过敏性疾病史的患者;③严重的精神疾病患者。
1.2 方法
采集两组研究对象5 ml空腹静脉血,1 800 r/min的速率离心5 min,取血清保存在-80℃的冰箱中待测。对sB7-H3表达的检测采用ELISA试剂盒(苏州大学生物技术研究所)进行检测,操作步骤根据试剂盒说明书进行。对IL-17和IL-8的检测采用ELISA试剂盒(美国R&D公司)进行检测,操作步骤根据试剂盒说明书进行。
1.3 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料以均数±标准差(±s)表示,采用t检验,并进行Logistic逐步回归分析,采用Pearson相关系数进行相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1 血清中sB7-H3、IL-17和IL-8水平比较
观察组患者血清中sB7-H3、IL-17和IL-8水平与对照组相比,差异有统计学意义(P<0.05),观察组高于对照组。见表1。
2.2 原发性肝癌患者血清中sB7-H3、IL-17和IL-8水平与临床病理的关系
sB7-H3、IL-17和IL-8水平在患者的性别和年龄之间差异无统计学意义(P>0.05)。临床分期Ⅰ和Ⅱ的患者IL-17水平高于临床分期Ⅲ的患者,sB7-H3和IL-8水平低于临床分期Ⅲ的患者,有远处转移的患者sB7-H3和IL-8水平高于无远处转移的患者,IL-17水平低于无远处转移的患者,差异有统计学意义(P<0.05)。见表2。
2.3 血清中sB7-H3、IL-17和IL-8的相关性分析
原发性肝癌患者血清中sB7-H3与IL-8水平无相关,sB7-H3与IL-17呈正相关,IL-17与IL-8水平呈负相关。见图1~3。
2.4 逐步Logistic回归模型预测肝癌
血清内sB7-H3、IL-8和IL-17水平高的患者肝癌转移的风险分别为血清内sB7-H3、IL-8、IL-17水平低患者的1.001倍、1.030倍和1.003倍。Logistic回归预测模型的χ2=64.267,P=0.000,说明血清内sB7-H3、IL-8、IL-17水平能够诊断肝癌。见表3。
表1 血清中sB7-H3、IL-17和IL-8水平比较 (n=45,pg/ml,±s)

表1 血清中sB7-H3、IL-17和IL-8水平比较 (n=45,pg/ml,±s)
组别 sB7-H3 IL-17 IL-8观察组 4 143.47±976.27 356.62±78.51 337.86±95.26对照组 2 076.18±605.42 317.34±59.62 167.54±68.73 t值 2.561 2.492 2.377 P值 0.013 0.024 0.033
表2 原发性肝癌患者血清中sB7-H3、IL-17和IL-8水平与临床病理的关系 (pg/ml,±s)

表2 原发性肝癌患者血清中sB7-H3、IL-17和IL-8水平与临床病理的关系 (pg/ml,±s)
项目 IL-17 IL-8 sB7-H3性别男(n=35) 354.79±67.33 319.17±81.59 3 940.95±891.73女(n=10) 350.69±86.77 385.82±97.45 3 650.26±819.65 t值 1.687 1.861 1.939 P值 0.089 0.072 0.059年龄<60岁(n=16)349.93±76.55 337.34±94.01 3 873.36±622.36≥60岁(n=29)360.08±63.32 334.07±83.78 3 850.68±829.61 t值 1.956 1.627 1.652 P值 0.052 0.150 0.098临床分期Ⅰ、Ⅱ(n=27)361.38±63.41 326.11±87.64 3 620.95±688.28Ⅲ(n=18) 340.56±83.38 345.97±91.67 4 353.53±556.42 t值 2.580 2.465 2.279 P值 0.010 0.028 0.037远处转移有(n=10) 333.03±76.05 361.41±98.94 4 205.61±707.84无(n=35) 360.29±69.32 325.02±84.59 3 719.36±726.95 t值 2.569 2.147 1.975 P值 0.012 0.040 0.049

表3 逐步Logistic回归分析的相关参数

图1 sB7-H3与IL-8

图2 sB7-H3与IL-17
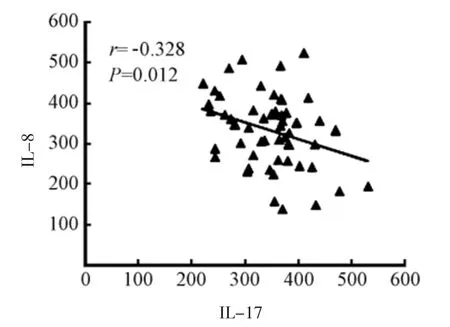
图3 IL-8与IL-17
3 讨论
肝癌患者生存质量和生存率的提高极大程度取决于早期诊断,临床上目前用于对肝癌辅助诊断的指标主要为癌胚抗原(CEA)、甲胎蛋白(AFP)和CA199等,但上述指标的敏感性和特异性并不理想,漏诊率较高[5]。B7-H3是一种Ⅰ型跨膜蛋白,人体多种组织内B7-H3的mRNA均能广泛表达,B7-H3的蛋白分子能够在B细胞、活化的T细胞、树突状细胞和单核细胞内表达,并参与自身免疫性疾病的发生过程与机体免疫应答的调节过程[6]。已有研究指出[7],B7-H3在原发性肝癌患者的组织中水平升高,且B7-H3与肾癌、乳腺癌、胃癌、胰腺癌、骨肉瘤、结直肠癌、肺癌等多种肿瘤组织的发生和发展均有密切的相关性。因而本研究对sB7-H3、IL-17和IL-8对原发性肝癌的诊断效果进行了探究,以期能为后期临床治疗提供参考。
IL-17是一种能够通过诱导趋化因子和TNF-α、IL-6等炎症因子的表达来促进中性粒细胞向炎症部位移动的新型炎症因子,帮助机体提高抗肿瘤效应,因而IL-17在对原发性肝癌的早期诊断中具有一定的作用[8-9]。IL-8是一种能够对黑色素瘤的迁移进行调节的炎性趋化因子,IL-8在机体对化疗药物产生的抵抗作用中和机体肿瘤细胞自我更新的维持中均有重要作用[10-11],且已有研究指出[12]抗癌药物能够促进IL-8的分泌,且IL-8水平的高低与肿瘤的大小呈正相关。本文研究结果显示,观察组患者血清中sB7-H3、IL-17和IL-8水平与对照组相比,差异有统计学意义,观察组均高于对照组。这一结果与上述论述相似,说明sB7-H3、IL-17和IL-8可以作为一种肿瘤标志物用于对原发性肝癌的早期诊断中。其次,本文研究结果显示,原发性肝癌患者血清中sB7-H3水平与IL-8水平无相关性,sB7-H3水平与IL-17呈正相关,IL-17水平与IL-8水平呈负相关。这说明细胞因子对于原发性肝癌的免疫调节作用存在一定的网络性,而对于这一特性的详细机制需要通过扩大研究群体,进一步研究和分析。而血清内sB7-H3、IL-8和IL-17水平高的患者肝癌转移的风险分别是血清内sB7-H3、IL-8和IL-17水平低患者的1.001、1.030和1.003倍。这可能是由于肝癌细胞株上的B7-H3表达能够对CD8+T细胞的增值产生影响,抑制IL-17的分泌,进而帮助肿瘤细胞逃逸。本研究还通过Logistic回归预测模型对sB7-H3、IL-8和IL-17水平的诊断作用进行验证,结果显示血清内sB7-H3、IL-8和IL-17水平能够诊断肝癌。因此,对血清内sB7-H3、IL-8和IL-17进行联合检测,可能会提高肝癌早期诊断率,此类研究未见报道,但是考虑本研究中所选研究对象较少,因此需要扩大研究群体,对此猜想进行进一步验证。
综上所述,原发性肝癌患者外周血血清中sB7-H3与IL-17水平呈正相关,IL-17与IL-8水平呈负相关。且血清内sB7-H3、IL-8和IL-17水平能够诊断肝癌。
[1]林璐,叶辉.细胞因子拮抗肽的制备、作用机制及应用研究进展[J].山东医药,2014,54(31): 98-101.
[2]王远,吴昌平,卢斌峰,等.调节性T细胞在肿瘤免疫逃逸中的机制[J].中华实验外科杂志,2013,30(11): 2466-2469.
[3]许文,李丰衣,余灵祥,等.血浆可溶型B7-H3可作为乙型肝炎病毒相关性肝癌辅助诊断标志物[J].细胞与分子免疫学杂志,2014,30(7): 744-747.
[4]中国抗癌协会肝癌专业委员会.原发性肝癌诊断标准[J].中华肝脏病杂志,2000,8(3): 135.
[5]ZHENG L,GONG W,LIANG P.et al.Effects of AFP-activated PI3K/Akt signaling pathway on cell proliferation of liver cancer[J].Tumour Biology: the Journal of the International Society for Oncodevelopmental Biology and Medicine,2014,35(5): 4095-4099.
[6]BIN Z,GUANGBO Z,YAN G,et al.Overexpression of B7-H3 in CD133+colorectal cancer cells is associated with cancer progression and survival in human patients[J].Journal of Surgical Research: Clinical and Laboratory Investigation,2014,188(2):396-403.
[7]康富标.共刺激分子B7-H3在肝细胞癌的表达及相关机制研究[D].北京: 中国人民解放军医学院,2015.
[8]崔芳芳,龚作炯.慢性丙型肝炎、肝硬化、肝癌患者血清IL-17、IL-6和维生素D水平变化及其临床意义[J].胃肠病学和肝病学杂志,2014,23(12): 1448-1450.
[9]范莎莎,李爱民,李荣,等.IL-17在肝癌患者血清中表达增高对肝癌诊断的研究[J].湖南师范大学自然科学学报,2014,37(3): 19-23.
[10]张嵘.血清IL-8与DCP联合检测诊断原发性肝癌及评价TACE预后的价值[D].江西: 南昌大学,2015.
[11]徐建春.肝硬化患者血清IGF-I和IL-6、IL-8检测的临床意义[J].标记免疫分析与临床,2014,21(3): 232-233.
[12]杨明德,李冬梅,于慧玲,等.化疗前后乳腺癌患者血清中IL-6、IL-8及TNF-α的变化及意义[J].中国妇幼保健,2015,30(1): 136-138.
