血清TGF-β1、CTGF与增生性糖尿病视网膜病变的关系
2018-03-08魏菁张明华
魏菁,张明华
(河南科技大学第一附属医院,河南 洛阳 471003)
糖尿病是我国常见的慢性疾病之一,发病率高达11.6%,而微血管是糖尿病主要累及器官之一,当微血管病变累及视网膜时,就会产生糖尿病视网膜病变(diabetic retinopathy,DR)。有文献显示,在我国37.2%~51.3%糖尿病患者合并DR,其中1/4患者视力明显受损,当视网膜血管持续病变产生新生血管时,则演变为增生性糖尿病性视网膜病变(proliferetive diabetic relatinopathy,PDR)[1]。相比于DR,PDR对患者的视力会产生更严重的影响,致盲率高达23.6%,预后较差,给患者的正常工作和生活带来严重影响[2]。对于DR的发病机制,目前尚未形成统一定论。该病的发病机制研究一直是国内外相关领域研究重点。近5年国内外相关研究显示,PDR的发病及病情演变过程与各类血清因子异常有重要联系。血清转化生长因子 β1(transforming growth factor-β1,TGF-β1)是一种多功能的细胞因子,在炎症、损伤修复及纤维化中起重要作用。人体视网膜组织中的TGF-β1主要由血小板、视网膜色素上皮细胞及巨噬细胞等分泌,可促进视网膜色素上皮细胞分泌血小板衍生因子,从而引起胶原凝胶收缩、纤维黏连、蛋白分泌增加,并促成成纤维细胞合成胶原纤维,在增生性视网膜病变中发挥重要作用。结缔组织生长因子(connective tissue growth factor,CTGF)是近年来新发现的多功能生长因子,是一种富含半胱氨酸的分泌性生长因子,在促进多种细胞生长、黏附及促进Ⅰ型胶原等胞外基质分泌中具有重要作用,与组织纤维环密切相关,在肺、肾脏、心肌纤维化、动脉粥样硬化和肿瘤病变中都呈高表达[2]。本研究通过分析患者TGF-β1和CTGF的表达水平,探讨其在PDR发病中的意义,现报道如下。
1 资料与方法
1.1 研究对象
选取2013年8月-2015年11月在河南科技大学第一附属医院诊疗的2型糖尿病患者230例,所有患者符合1999年世界卫生组织所修定的2型糖尿病诊断标准[3]。排除标准:①合并有急性糖尿病并发症;②合并有自生免疫性疾病、身体重要器官功能不全、恶性肿瘤等疾病;③合并有其他可能导致眼部疾患的疾病。并依据1984年全国眼底病学术会议所制定的PDR诊断标准[2],判断患者是否合并PDR,将所有患者分为非增生性糖尿病性视网膜病变(non proliferetive diabetic relatinopathy,NPDR)组和PDR组。其中,PDR组120例,其中,男性65例,女性55例;年龄47~71岁,平均(57.3±6.2)岁;NPDR组110例,其中,男性59例,女性51例;年龄48~69岁,平均(56.9±6.5)岁。本研究另挑选110例同期体检正常的健康人作为对照组。其中,男性57例,女性53例;年龄43~70岁,平均(57.6±6.6)岁,对照组患者无心、肝、肺、肾等身体重要脏器疾病,并排除眼底疾病和内分泌疾病。
1.2 观察指标
3组患者空腹抽取静脉血5 ml,4℃低温保存,并检测空腹血糖(fasting plasma glucose,FPG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high denisity lipoprotein chilesterol,HDL-C)、三酰甘油(Triglyceride,TG),总胆固醇(Total cholesterol,TC)。将部分血液标本离心提血清后,采用ELISA法检测血清标本中的TGF-β1和CTGF水平(试剂盒购自上海酶联生物科技有限公司)。记录3组患者的体重指数(body mass index,BMI),以及NPDR组和PDR组的病程。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计数资料以百分数表示,计量资料以均数±标准差(±s)表示,两组比较用t检验,多组比较用单因素方差分析,两两比较用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组患者一般资料比较
3组患者的性别、年龄等基础情况比较,差异无统计学意义(P>0.05)。见表1。
2.2 3组患者临床资料比较
3组血清FPG水平比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,经SNK-q检验,PDR和NPDR组血清FPG水平高于对照组(q=50.316和、51.098,均P=0.000)。3组HbAlc水平比较,,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,经SNK-q检验,PDR和NPDR组的HbAlc水平高于对照组(q=50.166和43.370,均P=0.000)。3组血清LDL-c表达水平比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,经SNK-q检验,PDR组高于另外两组(q=2.520和2.863,P=0.012和0.005);PDR组和NPDR组的病程比较,采用t检验,差异有统计学意义(t=10.419,P=0.000),PDR组患者的病程长于NPDR组。3组患者其余临床资料比较,采用方差分析,差异无统计学意义(P>0.05)。见表2。
2.3 3组患者血清TGF-β1和CTGF表达水平比较
3组血清TGF-β1水平比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,经SNK-q检验,PDR组血清TGF-β1水平高于NPDR组和对照组(q=81.986和84.088,均P=0.000)。3组CTGF水平比较,经方差分析,差异有统计学意义(P<0.05);进一步两两比较,经SNK-q检验,PDR组的CTGF表达水平也高于其余两组(q=31.285和32.536,均P=0.000)。两两比较的SNK-q检验中,NPDR组与对照组TGF-β1和CTGF表达水平比较,差异无统计学意义(q=2.058和1.225,P=0.142和0.237)。见表3。
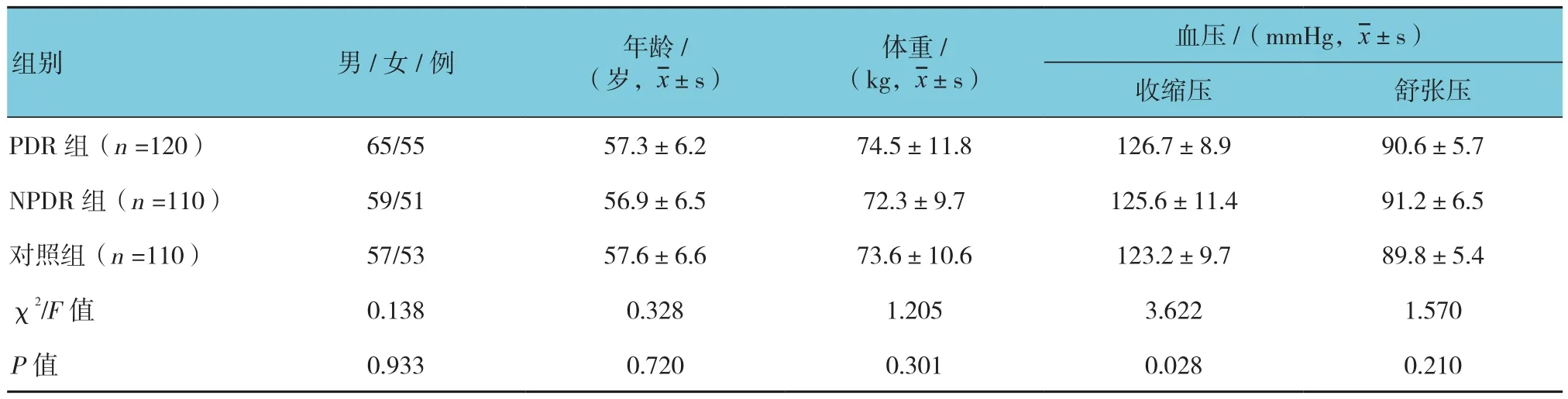
表1 3组患者一般资料比较
表2 3组患者临床资料比较 (±s)

表2 3组患者临床资料比较 (±s)
注:1)与对照组比较,P<0.05;2)与NPDR组比较,P<0.05
病程/年PDR 组(n=120) 6.73±0.481) 13.58±2.191) 3.17±0.821)2) 1.25±0.28 4.76±1.61 1.39±0.51 25.17±3.17 16.05±3.822)NPDR组(n=110) 6.81±0.401) 12.61±1.991) 2.81±1.31 1.30±0.38 4.51±1.34 1.43±0.55 24.91±3.16 10.28±4.57对照组(n=110) 4.59±0.48 5.28±0.72 2.75±1.36 1.29±0.37 4.65±1.67 1.48±0.39 25.42±3.12 -F/t值 851.125 735.683 4.317 0.686 0.749 0.974 0.721 10.419 P值 0.000 0.000 0.014 0.505 0.474 0.379 0.487 0.000组别 FPG/(mmol/L)HbAlc/%LDL-c/(mmol/L)HDL-c/(mmol/L)TC/(mmol/L)TG/(mmol/L)BMI/(kg/m2)
表3 3组患者血清TGF-β1和CTGF表达水平比较(ng/ml,±s)
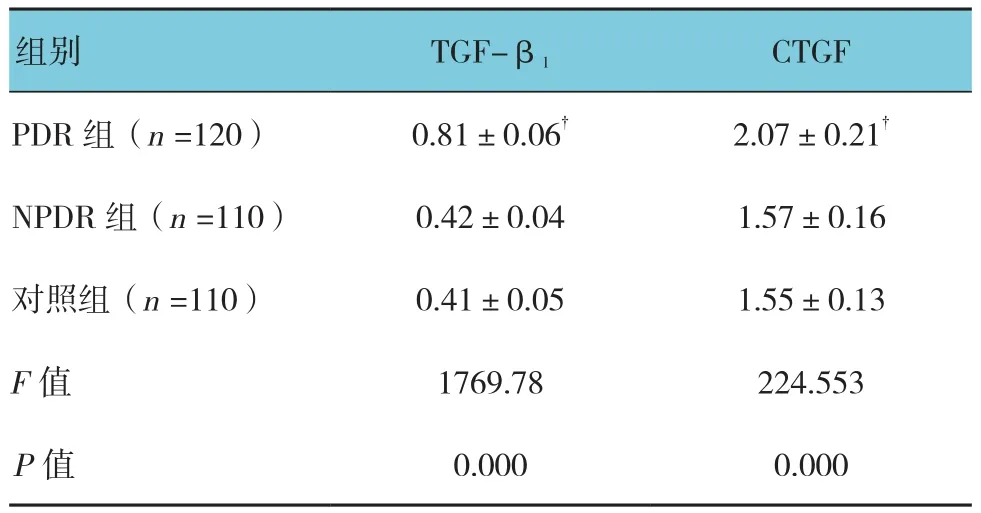
表3 3组患者血清TGF-β1和CTGF表达水平比较(ng/ml,±s)
注:†与对照组、NPDR组比较
组别 TGF-β1 CTGF PDR组(n=120) 0.81±0.06† 2.07±0.21†NPDR 组(n=110) 0.42±0.04 1.57±0.16对照组(n=110) 0.41±0.05 1.55±0.13 F值 1769.78 224.553 P值 0.000 0.000
3 讨论
DR是糖尿病性微血管病变中最重要的表现之一,是一种具有特异性改变的眼底病变,是糖尿病的严重并发症[4]。临床上根据是否出现视网膜新生血管为标志,将没有视网膜新生血管形成的糖尿病视网膜病变称为NPDR(或称单纯型或背景型),而将有视网膜新生血管形成的DR称为PDR[2]。糖尿病患者主要是胰岛素代谢异常,引起眼组织、神经及血管微循环改变,造成眼底营养和视功能的损坏。微血管是指直径介于微小动脉和微小静脉之间,管腔<100μm的微小血管及毛细血管网,是组织和血液进行物质交换的场所。糖尿病患者血液成分的改变,而引起血管内皮细胞功能异常,使得血-视网膜屏障受损。视网膜毛细血管内皮细胞和色素上皮细胞间的联合被破坏,造成小血管的渗漏[5]。
目前,有关DR的发病机制,国内外学者尚未形成统一定论,其确切的发病机制尚未得到肯定性阐述。FRANK等[6]等认为,患者的年龄、血压、血糖、血脂水平与与该病的发生具有重要联系,患者年龄越大、血压越高、空腹血糖水平越高、病程越长,其合并DR的概率就越高,上述指标是DR发病的重要危险因素。在PDR中,视网膜损害刺激新生血管生长。新生血管生长对视网膜有害无益,可引起纤维增生,有时还可导致视网膜脱离。新生血管亦有可能长入玻璃体,引起玻璃体出血。与NPDR相比,PDR对视力的危害性更大,会导致严重视力下降甚至完全失明。弓欣等[7]通过回顾性分析136例合并有视网膜病变的糖尿病患者的临床资料发现,患者是否合并糖尿病肾病、糖尿病周围神经性疾病、病程长短、FPG水平、餐后2 h血糖水平、HbA1c、血压水平、TC、TG、UAER、是否坚持锻炼、是否坚持降血糖治疗、血清肌酐、尿素氮水平等,均影响NPDR向PDR进展的过程。
目前,有关DR发病机制的研究重点已从常规生化指标检测转移到特殊的血清因子的检测中。陈薇等[8]研究发现,维生素D、游离脂肪酸水平在DR患者中具有特异性表达。SAFI等[9]通过对比分析58例糖尿病未合并DR和67例糖尿病合并DR患者的血清视黄醇结合蛋白4、D-二聚体、血清载脂蛋白B及血清载脂蛋白A1比值等临床资料,发现上述血清指标均能起到很好的早期筛查DR的作用。由于长期的高血糖、高血压、缺氧刺激,PDR患者的特征性病理变化是视网膜表面新生蔓延微血管,随着病程的进展,新生血管长入玻璃体中,而新生血管质地脆弱,容易破裂、出血、纤维化、最终产生牵拉性视网膜剥离,严重影响患者视力[10]。因此,PDR患者血清和血管新生有关的血清因子是该领域的研究重点。李若琳等[11]研究结果表明,在PDR患者的血清中,血管内皮生长因子均上升,这也为阐述PDR的发病机理提供新的方向。
作为一种多效能血清生长因子,TGF-β1在细胞外基质的产生和沉淀方面有着重要作用,其通过Smads蛋白将信号由细胞外传导到细胞内,可以在细胞水平方面发挥其生物学效益,无论是诱导细胞凋亡、新生血管形成、胚胎形成、骨形成,还是调控细胞迁移、调节细胞周期、血细胞新生以及免疫应答,TGF-β1均发挥着重要的生理作用;在多种组织纤维化疾病、肿瘤产生、炎症进展等方面,TGF-β1也与其密切先关[12]。KIM等[13]应用双抗体夹心酶联免疫吸附法检测89例PDR患者的视网膜增生膜上面的TGF-β1受体Ⅱ,发现相比于DR患者,其表达水平上升,这意味着患者血清中的TGF-β1也有着较高的表达水平,说明TGF-β1能加速PDR患者视网膜上新生血管和增生膜的产生[14]。CTGF在人体多个器官都有表达,是一种多功能的分泌性多肽,由TGF-β通过Smads蛋白信号诱导表达,其在调节细胞增殖、分化、黏附爬行等细胞生物学活性方面均起着重要作用,并广泛参与细胞组织的发育和分化、血管的新生、伤口修复愈合、纤维化性疾病、肿瘤的发生和发展、炎症、骨细胞破坏和新生、雌性个体生殖系统发育等生理病理过程。CTGF的表达与糖尿病微血管病变有着重要联系。WANG等[15]通过检测糖尿病患者的尿液样本发现,患者尿中CTGF水平异常升高,且患者尿蛋白水平越高,CTGF水平越高,这说明CTGF是诊断糖尿病和评估病情的重要指标。
既往文献显示,糖尿病患者病变是否累及眼部,与其血糖、血脂异常程度密切先关[2]。本研究结果显示,在血清FPG和HbAlc的表达水平比较方面,PDR和NPDR组患者要高于对照组;在血清LDL-c表达水平方面,PDR组患者高于另外两组研究对象,这说明较高水平的FPG、HbAlc和LDL-c是糖尿病患者发生增生性视网膜病变的重要危险因素。HUGENSCHMIDT等[16]通过长期跟踪收集76例糖尿病患者的临床资料,发现患者病程越长、胰岛素治疗越不规律,越容易并发DR。本研究中,PDR组患者平均病程长于另外NPDR组患者,这说明较长的病程亦是患者并发PDR的危险因素。PDR组血清TGF-β1和CTGF表达水平高于NPDR组和对照组,NPDR组和对照组在TGF-β1和CTGF表达水平方面差异无统计学意义,这很好地解释了PDR发病与血清TGF-β1、CTGF表达水平上升的相关性。
综上所述,PDR患者血清TGF-β1和CTGF表达水平较高,TGF-β1和CTGF是提示PDR发病的重要辅助指标。
[1]周杨琳,陈雪燕,陈雪艺.糖尿病视网膜病变患者相关生化指标测定及其预测意义[J].中国全科医学,2014(15): 1715-1718.
[2]杨赞章,李静,李志金.早期糖尿病视网膜病变发病机制中相关因子的研究进展[J].广东医学,2014(9): 1455-1457.
[3]张艳敏,张萌,蒋晓忠,等.甘油三酯对2型糖尿病患者新发非酒精性脂肪肝的预测价值[J].实用预防医学,2015,22(4): 438-441.
[4]CHEW E Y,DAVIS M D,DANIS R P,et al.The effects of medical management on the progression of diabetic retinopathy in persons with type 2 diabetes,the action to control cardiovascular risk in diabetes (ACCORD) eye study[J].Ophthalmology,2014,121(12):2443-2451.
[5]杨宇,田敏,吕红彬.糖尿病视网膜病变的治疗进展[J].眼科新进展,2015,35(5): 497-500.
[6]FRANK R N.Systemic therapies for diabetic retinopathy: the accord eye study[J].Ophthalmology,2014,121(12): 2295-2296.
[7]弓欣,徐国兴.糖尿病视网膜病变致病危险因子控制与药物干预[J].国际眼科杂志,2014,14(12): 2165-2167.
[8]陈薇,童秀峰,黎安玲,等.不同分期糖尿病肾病患者血清游离脂肪酸、同型半胱氨酸和胱抑素C水平变化[J].微循环学杂志,2014(3): 38-41.
[9]SAFI S Z,QVIST R,KUMAR S,et al.Molecular mechanisms of diabetic retinopathy,general preventive strategies,and novel therapeutic targets[J].Biomed Research International,2014,2014(3): 801269.
[10]薛尚才,李惠荣,范勇,等.糖尿病视网膜病变眼轴轴长与中心视网膜厚度的相关性研究[J].眼科新进展,2014,34(3):253-256.
[11]李若琳,陈楠.血管内皮生长因子和结缔组织生长因子在增生型糖尿病视网膜病变中的研究进展[J].临床眼科杂志,2015,23(6): 573-576.
[12]单俊杰,袁志兰,曹国平.血清中转化生长因子2β1和bFGF水平与糖尿病视网膜病变关系的临床研究[J].临床眼科杂志,2014,22(1): 77-79.
[13]KIM Y J,KIM J G,LEE J Y,et al.Development and progression of diabetic retinopathy and associated risk factors in Korean patients with type 2 diabetes: the experience of a tertiary center[J].Journal of Korean Medical Science,2014,29(12):1699-1705.
[14]马俊起.血管内皮生长因子基因多态性与2型糖尿病视网膜病变相关性的Meta分析[J].中国中医眼科杂志,2015(1): 46-49.
[15]WANG B,WANG F,ZHANG Y,et al.Effects of RAS inhibitors on diabetic retinopathy: a systematic review and meta-analysis[J].Lancet Diabetes Endocrinology,2015,3(4): 263-274.
[16]HUGENSCHMIDT C E,LOVATO J F,AMBROSIUS W T,et al.The cross-sectional and longitudinal associations of diabetic retinopathy with cognitive function and brain MRI findings:the action to control cardiovascular risk in diabetes (ACCORD)trial[J].Diabetes Care,2014,37(12): 3244-3252.
