耐力训练对高脂饮食小鼠脂肪组织NLRP3炎症小体通路的影响
2018-03-08黄徐根
程 燕,黄徐根
耐力训练对高脂饮食小鼠脂肪组织NLRP3炎症小体通路的影响
程 燕,黄徐根
安徽师范大学 体育学院,安徽 芜湖 241000
目的:研究耐力训练对高脂饮食小鼠脂肪组织NLRP3炎症小体信号通路的影响。方法:4周龄雄性C57BL/6小鼠随机分为正常饮食对照组(NC,10只)、正常饮食运动组(NE,10只)、高脂饮食对照组(HC,12只)、高脂饮食运动组(HE,12只)。运动组小鼠每天进行60 min的递增负荷跑台耐力训练(12~20 m/min),5天/周,共16周。测定小鼠脂肪组织NLRP3炎症小体通路相关基因、蛋白变化和氧化应激相关指标。结果:1)与NC组相比,HC组小鼠体质量、附睾脂肪重量显著增加(<0.01),血清TG、TC、LDL-c、FFAs显著升高(<0.01),附睾脂肪NLRP3、ASC、Caspase1、TNF-α、IL-6、IL-1β mRNA表达显著升高(<0.01),NLRP3、ASC、pro-casp1、p20蛋白含量显著增加(<0.01),附睾脂肪MDA、H2O2含量和NOX活性显著升高(<0.01),Mn-SOD活性显著下降(<0.01);2)与NC组相比,NE组小鼠各项指标没有显著差异;3)与HC组相比,HE组小鼠体质量、血清TG、FFAs显著下降(<0.05),在附睾脂肪重量没有显著变化的情况下NLRP3、ASC、Caspase1、IL-1β、TNF-α、IL-6 mRNA表达和NLRP3、ASC蛋白含量显著下降(<0.05或<0.01),pro-casp1蛋白含量没有显著变化,但p20蛋白含量显著下降(<0.05);附睾脂肪MDA、H2O2含量和NOX活性显著下降(<0.05),Mn-SOD活性显著提高(<0.05);4)与NE组相比,HE组小鼠体质量、附睾脂肪重量、血清TG、TC、LDL-c、FFAs和附睾脂肪NLRP3、ASC、Caspase1、TNF-α、IL-6、IL-1β mRNA、NLRP3蛋白含量等显著高于NE组(<0.05或<0.01)。结论:长期递增负荷耐力训练能有效抑制高脂饮食诱导的脂肪组织NLRP3炎症小体信号通路激活,降低脂肪组织炎症因子表达,这可能与脂肪组织氧化应激降低有关。
耐力训练;脂肪组织;NLRP3炎症小体;慢性炎症;氧化应激
已有研究表明,长期高脂饮食可导致肥胖[1,4],提高II型糖尿病、代谢综合征等的风险。肥胖引起的慢性低度炎症又被称为“代谢炎症”[19],是导致胰岛素抵抗的关键机制,慢性炎症同II型糖尿病[13]、动脉粥样硬化[16]等密切相关。同炎症因子TNF-α一样[40],IL-1家族炎症因子是肥胖诱导胰岛素抵抗的重要介质[39]。早前临床研究指出,白介素受体阻滞药阿那白滞素(Anakinra)阻断IL-1信号可以降低II型糖尿病人群的炎症水平,改善糖尿病状况[31]。IL-1家族成员包括IL-1α、IL-1β、IL-18、IL-33,IL-1β为最经典的炎症因子,可以通过破坏胰岛素信号通路降低脂肪细胞对葡萄糖摄取[21]。脂肪组织是慢性炎症的主要来源,高脂饮食显著提高小鼠脂肪组织IL-1β mRNA水平[30],相反,IL-1β-/-小鼠能抵抗高脂饮食诱导的脂肪组织炎症[35]。肥胖时脂肪组织炎症因子主要来自脂肪组织基质血管组分中的巨噬细胞[42],巨噬细胞可通过自身细胞表面的模式识别受体识别相关的病原体或微生物,主要包括Toll样受体(TLRs)和Nod样受体(NLRs),NLRs家族的NLRP3还可以识别非微生物来源的危险信号(如代谢产物),结合半胱氨酸蛋白酶Caspase1、配体蛋白ASC形成炎症小体,caspase1剪切胞浆中的前体IL-1β,调节成熟IL-1β分泌。研究表明,肥胖时脂肪组织NLRP3炎症小体的激活在脂肪组织炎症中起重要作用,NLRP3-/-小鼠对肥胖引起的脂肪组织巨噬细胞堆积和脂肪组织炎症产生抗逆,胰岛素敏感性较野生型肥胖小鼠提高[41]。有氧耐力训练为改善脂肪组织炎症和系统性慢性炎症的有效手段,生物学机制包括降低脂肪组织巨噬细胞数量,转变巨噬细胞的炎症激活状态,降低炎症因子表达等[24-26]。然而,耐力训练对高脂饮食小鼠脂肪组织NLRP3炎症小体信号通路的影响到目前尚不清楚,本文研究目的是观察长期递增负荷耐力训练对高脂饮食小鼠脂肪组织NLRP3炎症小体信号通路的影响,并探讨氧化应激的作用。
1 实验对象与方法
1.1 实验对象
健康4周龄雄性C57BL/6小鼠44只,适应性饲养1周随机分为正常饮食对照组(Normal Diet Control,NC,n=10)、正常饮食运动组(Normal Diet Exercise,NE,n=10)、高脂饮食对照组(High Fat Diet Control,HC,n=12)、高脂饮食运动组(High Fat Diet Exercise,HE,n=12)。清洁级动物房饲养温度23~26 ℃,相对湿度控制在55%~65%,每天光照12 h。高脂饲料购自上海普路腾生物科技有限公司,粗蛋白22.3 g/100 g(供能20%)、脂肪19.8 g/100 g(供能40%)、碳水化合物44.6 g/100 g(供能40%)。
1.2 运动干预和取材
适应性饲养期间运动组小鼠进行1周的运动预适应(表1),确保运动组小鼠能完成60 min的全程跑,各组筛选出8只用于正式实验。正式实验运动方案参考Kawanishi[26]的研究方案,并在此基础上进行了改良:采用递增负荷跑台运动试验,跑台坡度为0,跑速12~20 m/min,起始速度12 m/min跑10 min,从13 m/min开始每7 min提高1 m/min,每天训练60 min,每周5 d,共16周。末次运动干预结束小鼠给食6 h,随后禁食12 h处死小鼠取材:摘眼球取全血,血样室温静置30 min,3 500 r/min离心15 min,收集上层血清, -20 ℃保存;取双侧附睾脂肪垫,-80℃冰箱保存。

表1 运动预适应方案
1.3 指标测试与方法
1.3.1 测定血清脂代谢相关指标
根据南京建成甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-c)、游离脂肪酸(FFAs)试剂盒通过酶标仪测定小鼠血清中甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-c)、游离脂肪酸(FFAs)浓度。
1.3.2 测定脂肪组织氧化应激相关指标
根据南京建成丙二醛(MDA)、过氧化氢(H2O2)、锰超氧化物歧化酶(Mn-SOD)、NADPH氧化酶(NOX)试剂盒通过酶标仪测定小鼠脂肪组织MDA、H2O2含量和Mn-SOD、NOX活性。
1.3.3 Western blot法检测蛋白表达
预冷RIPA蛋白裂解液(碧云天)中均浆脂肪组织,14 000 r/min 4℃离心30 min,取上清液于-80℃保存备用(要去除上层油脂),BCA法测定总蛋白浓度(Pierce),通过10%浓度的SDS-PAGE凝胶和4%~20%浓度的梯度胶(Bio-Rad)电泳分离NLRP3(118kDa)、Caspase1(45kDa)、ASC(21kDa)、GAPDH(37kDa)等蛋白分子,湿法转PVDF膜100v 100 min,丽春红S染色,剪取目标条带,5%脱脂牛奶室温封闭60 min,一抗 NLRP3 1:1 500(CST);Caspase1 1:1 000(CST);ASC 1:1 500(Abcam);GAPDH 1:1 000(Santa Cruz),5%脱脂牛奶稀释,4℃孵育过夜,1×TBST洗PVDF膜3次,每次10 min;羊抗兔二抗1:5 000(CST),5%脱脂牛奶稀释,室温孵育2 h,1×TBST洗PVDF膜3次,每次10 min,ECL法发光,凝胶成像系统获取蛋白条带并拍照,读取条带灰度值,目的蛋白与内参灰度值比值为蛋白相对表达含量。
1.3.4 qRT-PCR法检测基因表达
Trizol法提取脂肪组织总RNA,RNA逆转录获取cDNA用于qRT-PCR实验,具体方法参照邹华刚[6],即100 mg附睾脂肪于1 mLTrizol中剪碎,匀浆2~3次,14 000 r/min低温离心10 min,取上清(去油脂),加入200 µL氯仿,室温静置 5 min,14 000 r/min低温离心15 min,取上层水相(~400 µL)加等体积异丙醇(约400 µL),室温静置10 min,14 000 r/min低温离心10 min,去上清,1 mL预冷75%乙醇重悬沉淀, 7 500 r/min低温离心5 min,去乙醇,DEPC水(20 µL)溶解RNA,酶标仪检测RNA浓度和纯度。通过TOYOBO逆转录试剂盒进行RNA逆转录,20 µL反应体系:5×RT buffer 4 µL、RT酶Mix1 µL、Primer Mix1 µL、RNA模板2 µL、DEPC水12 µL,逆转录反应条件:37 ℃15 min,98℃ 5 min。NLRP3上游引物(5’-3’) CTC TTA CTC CTG CCC CTC CT,下游引物(5’-3’)CTT ATG CGG GAT GGT CAG TT;IL-1β上游引物(5’-3’)TTT CTC CAC GCA GGA GAC TT,IL-1β下游引物(5’-3’)TCC ACG ATT TCC CAG AGA AC;TNF-α上游引物(5’-3’) AGC CCC CAG TCT GTA TCC TT,TNF-α下游引物(5’-3’) ATC CCT TTG CAG AAC TCA GG;IL-6上游引物(5’-3’)AGT TGCCTTCTT GGG ACT GA,IL-6下游引物(5’-3’)TCC ACG ATT TCC CAG AGA AC;ASC上游引物(5’-3’)TTA ATC CCA GCA ACC AGG AG, ASC下游引物(5’-3’)CTT GAG TTA GGC CAG CCT TG;Caspase 1上游引物(5’-3’)GAC AAG ATC CTG AGG GCA AA, Caspase 1下游引物(5’-3’)TCC TGC CAG GTA GCA GTC TT;GAPDH(5’-3’)AAC TTT GGC ATT GTG GAA GG,下游引物(5’-3’)ACA CAT TGG GGG TAG GAA CA。SYBR Green掺入法进行PCR反应。反应条件为95 ℃ 1 min预变性→95 ℃ 15 s变性→60℃ 30 s退火→72 ℃ 45 s延伸,进行50个循环,统计Ct值,以2-△△Ct值表示mRNA相对定量值。
1.4 数据统计分析
所有实验数据均以平均数±标准误形式呈现,以<0.05为显著性差异,以<0.01为极显著性差异。GraphPad Prism 6软件进行数据处理和作图,采用双因素方差分析(Two-way ANOVA)研究运动和饮食的总体效应,组间进行两两比较。
2 实验结果
2.1 体质量和体成分的变化
表2数据表明,饮食对体重(BW)和附睾脂肪重量(EW)均有显著影响(<0.01),总体上运动只对BW有显著影响(<0.05),对EW无显著影响,运动、饮食对BW和EW均不存在交互作用。组间两两比较显示,同NC组相比,HC组小鼠BW和EW显著增加(<0.01);同NC组相比,NE组小鼠BW、EW虽然下降,但无显著性差异;同HC组相比,HE组小鼠BW要显著低于HC组(<0.05),EW无显著性差异。

表2 小鼠代谢和生理相关参数比较
注:*表示高脂与普通饮食相比<0.05 **表示<0.01;#表示运动与安静相比<0.05,##表示<0.01,下同。
2.2 血清脂代谢指标的变化
表3数据表明,饮食对TG、TC、LDL-c、FFAs均有显著影响(<0.01),运动对TG、TC、LDL-c和FFAs均有显著影响(<0.05),运动和饮食对TG、TC、LDL-c、FFAs均不存在交互作用。组间两两比较显示,同NC组相比,HC组小鼠TG、TC、LDL-c、FFAs均显著升高(<0.01);同NC组相比,NE组小鼠各项指标均不同程度下降,但无显著性差异;与HC组相比,HE组小鼠TG、FFAs显著低于HC(<0.05);与NE组相比,HE组小鼠TG、TC、LDL-c、FFAs显著高于NE组(<0.01)。
2.3 小鼠脂肪组织炎症因子相关基因表达
为研究运动对高脂饮食诱导的脂肪组织炎症的影响,我们检测了附睾内脏脂肪TNF-α、IL-6、IL-1β mRNA。结果显示,饮食对脂肪组织TNF-α、IL-6和IL-1β mRNA表达均有显著影响(<0.01),同样,运动对脂肪组织TNF-α、IL-6和IL-1βmRNA表达有显著影响(<0.05或<0.01),运动和饮食对TNF-α mRNA表达不存在交互作用,对IL-6和IL-1β mRNA表达存在交互作用(<0.05)。组间两两比较显示,与NC组相比,HC组小鼠脂肪组织TNF-α、IL-6、IL-1β mRNA表达均不同程度显著升高(<0.01);与NC组相比,NE组小鼠脂肪组织TNF-α、IL-6、IL-1β mRNA表达没有出现显著差异;与HC组相比,HE组小鼠脂肪组织TNF-α、IL-6、IL-1β mRNA表达显著低于HC组(<0.01);与NE组相比,HE组TNF-α、IL-6、IL-1β mRNA显著高于NE组(<0.01)。

表3 小鼠血清脂代谢指标比较

图1 小鼠脂肪组织炎症因子基因表达比较(n=8)
Figure1. Comparison of Gene Expression of Inflammatory Cytokines in Adipose Tissue of Mice among Groups
注:*表示高脂与普通饮食相比<0.05 **表示<0.01;#表示运动与安静相比<0.05,##表示<0.01,下同。
2.4 小鼠脂肪组织NLRP3炎症小体信号通路相关基因表达
为了检测运动对高脂饮食诱导的脂肪组织NLRP3炎症小体信号通路的影响,我们检测了附睾内脏脂肪NLRP3、ASC、Caspase1 mRNA。结果显示,饮食对脂肪组织NLRP3、ASC、Caspase1mRNA表达均有显著影响(<0.01),同样,运动对脂肪组织NLRP3、ASC、Caspase1 mRNA表达有显著影响(<0.01),运动和饮食对NLRP3和Caspase1 mRNA表达不存在交互作用,对ASC mRNA表达存在交互作用(<0.05)。组间两两比较显示,与NC组相比,HC组小鼠附睾脂肪NLRP3、ASC、Caspase1 mRNA表达均显著提高(<0.01);与NC组相比,NE组小鼠附睾脂肪NLRP3、ASC、Caspase1 mRNA表达均没有显著变化;与HC组相比,HE组小鼠附睾脂肪NLRP3、ASC、Caspase 1 mRNA表达均显著低于HC组(<0.05或<0.01);与NE组相比,HE组小鼠附睾脂肪NLRP3、ASC、Caspase 1 mRNA表达显著高于NE组(<0.05或<0.01)。
2.5 小鼠脂肪组织NLRP3炎症小体信号通路NLRP3、ASC蛋白表达的变化
为了研究运动对高脂饮食诱导的脂肪组织NLRP3炎症小体信号通路的影响,我们通过Western blot检测了附睾脂肪NLRP3、ASC蛋白含量。结果显示,饮食对脂肪组织NLRP3、ASC蛋白表达均有显著影响(<0.01),运动对脂肪组织ASC蛋白表达有显著影响(<0.01),对NLRP3蛋白表达没有显著影响,运动和饮食对NLRP3蛋白表达有交互作用(<0.05),对ASC 蛋白表达不存在交互作用。组间两两比较显示,与NC组相比,HC组小鼠附睾脂肪NLRP3、ASC蛋白表达显著升高(<0.01);与NC组相比,NE组小鼠附睾脂肪NLRP3、ASC蛋白含量没有显著差异;与HC组相比,HE组小鼠附睾脂肪NLRP3、ASC蛋白表达均显著低于HC组(<0.05);与NE组相比,HE组小鼠附睾脂肪NLRP3蛋白表达显著高于NE组,ASC蛋白没有显著差异。
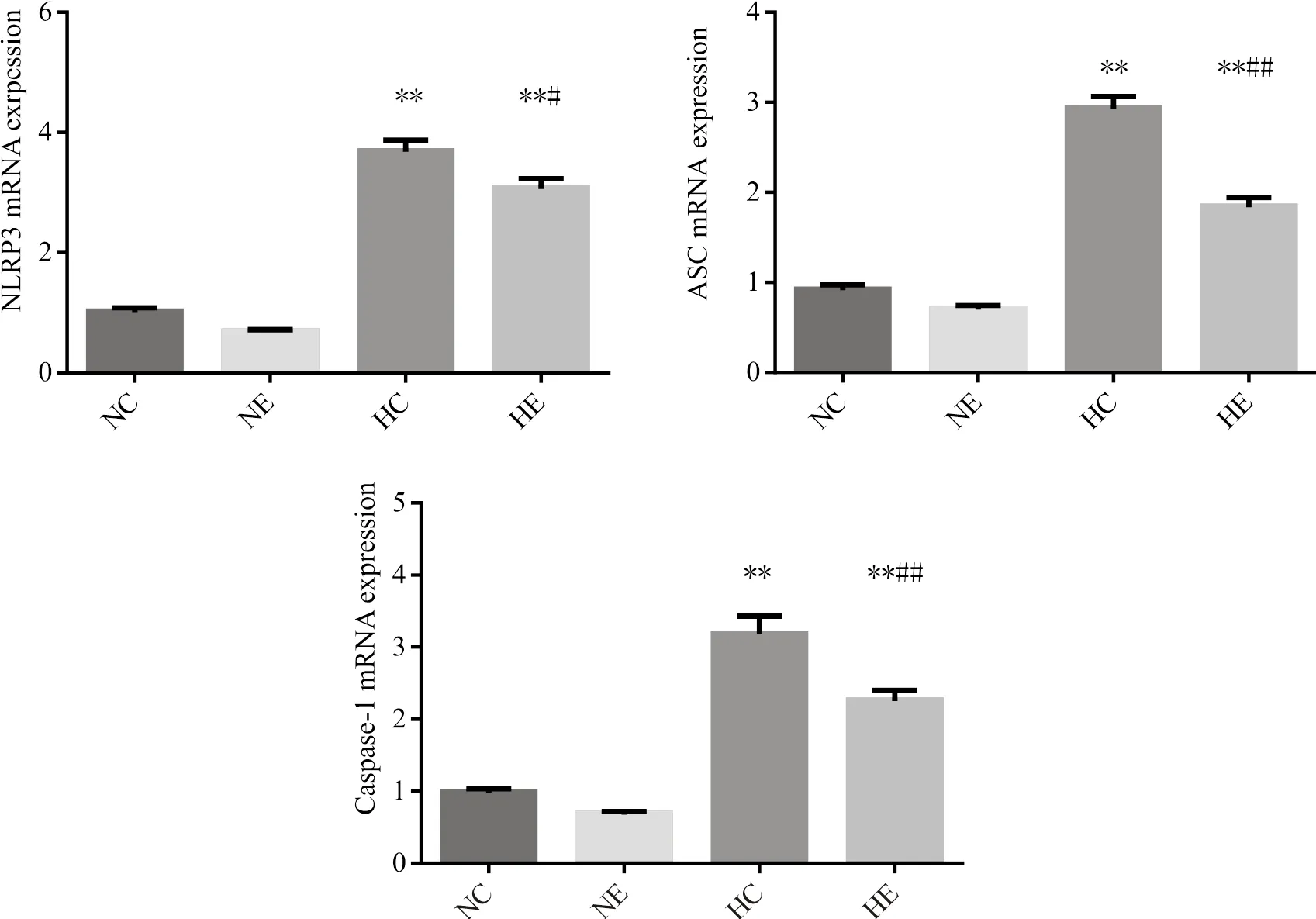
图2 小鼠脂肪组织NLRP3炎症小体信号相关基因表达比较
Figure2. Comparison of Gene Expression of NLRP3 Inflammasome Pathway in Adipose Tissue of Mice among Groups(n=8)

图3 各组小鼠脂肪组织NLRP3、ASC蛋白表达比较
Figure3. Comparison of NLRP3 and ASC Protein in Adipose Tissue of Mice among Groups(n=8)
2.6 小鼠脂肪组织Caspase1的变化
为了研究运动对高脂饮食诱导的脂肪组织NLRP3炎症小体信号通路活性的影响,我们通过Western blot检测了附睾脂肪procasp1(45 kDa)及cleaved caspase1(p20 20 kDa)变化。结果显示,饮食对附睾脂肪procasp1和p20蛋白含量均有显著影响(<0.01),运动对附睾脂肪procasp1含量无显著影响,对p20蛋白含量有显著影响(<0.01),运动和饮食对procasp1和p20蛋白含量均无交互作用。与NC组相比,HC组小鼠附睾脂肪procasp1蛋白含量显著升高(<0.01),p20片段含量显著增加(<0.01);与NC组相比,NE组小鼠附睾脂肪procasp1、p20蛋白含量没有显著差异;与HC组相比,HE组小鼠附睾脂肪p20片段含量显著低于HC组(<0.05);与NE组相比,HE组小鼠附睾脂肪procasp1、p20蛋白含量没有显著变化。
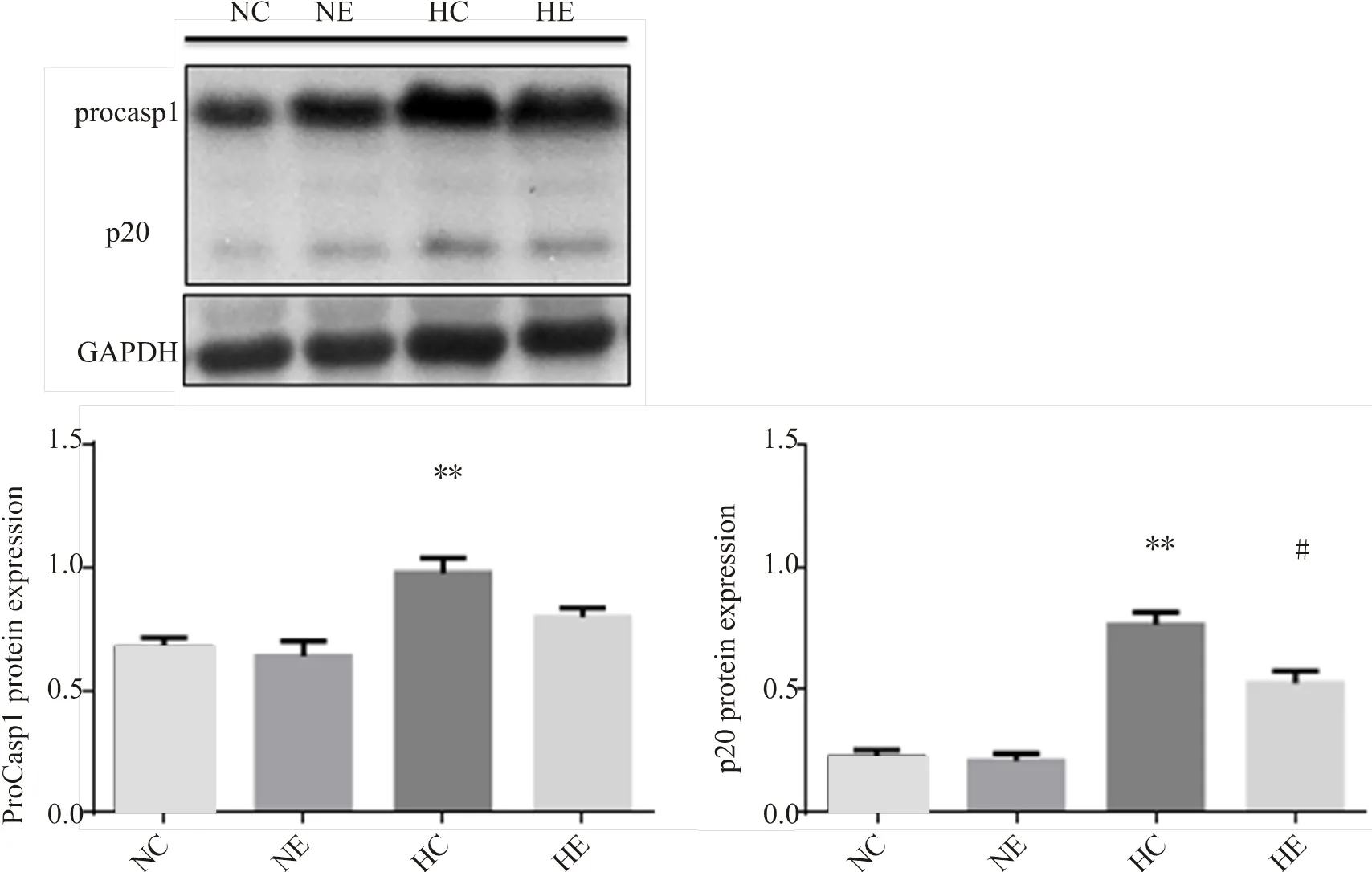
图4 各组小鼠脂肪组织Caspase1活性比较(n=8)
Figure4. Comparison of Caspase 1 Activity in Adipose Tissue of Mice among Groups
2.7 小鼠脂肪组织氧化应激变化
为了研究运动对高脂饮食诱导的脂肪组织氧化应激的影响,我们检测了附睾脂肪脂质过氧化指标丙二醛(MDA)和活性氧过氧化氢(H2O2)含量以及NADPH氧化酶(NOX)、锰超氧化物歧化酶(Mn-SOD)活性。结果显示,饮食对附睾脂肪MDA、H2O2含量和Mn-SOD、NOX活性均有显著影响(<0.01),运动对附睾脂肪MDA、H2O2含量和Mn-SOD、NOX活性均有显著影响(<0.05或<0.01),运动和饮食对MDA、H2O2含量均无交互作用,对Mn-SOD、NOX活性存在交互作用(<0.05)。与NC组相比,HC组小鼠附睾脂肪H2O2、MDA含量和NOX活性显著升高(<0.01),Mn-SOD活性显著下降(<0.01);与NC组相比,NE组小鼠附睾脂肪MDA、H2O2含量显著下降(<0.05),Mn-SOD活性显著提高(<0.05);与HC组相比,HE组小鼠附睾脂肪H2O2、MDA含量和NOX活性显著低于HC组(<0.05),Mn-SOD活性显著高于HC组(<0.05);与NE组相比,HE组小鼠附睾脂肪MDA、H2O2含量和NOX活性显著高于NE组(<0.01),Mn- SOD活性显著低于NE组(<0.01)。
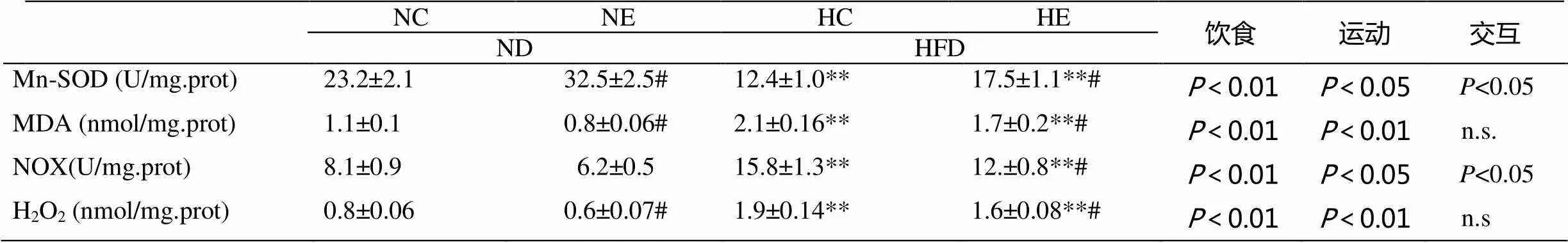
表4 各组小鼠脂肪组织氧化应激比较
3 分析与讨论
3.1 耐力训练对高脂饮食小鼠体质量、附睾脂肪及血脂的影响
长期高脂饮食为常见的肥胖、糖尿病动物模型造模方法,8~16周不等时长的高脂饲料喂养可显著提高小鼠热量摄入、体质量和血清TG、TC、VLDL等[2,3,14]。为了提高肥胖造模成功率,本课题采用了16周高脂饲料喂养,脂肪供能比例为45%,经过16周高脂饮食组小鼠体质量较正常饮食对照组显著提高,附睾脂肪为代表的内脏脂肪重量显著增加,血清TG、TC、LDL-c、FFAs水平均显著升高,这与前人研究结果一致。体育运动在健身和预防疾病中的作用被高度重视,有氧类运动处方被广泛应用于多种慢性疾病的预防和干预治疗[33]。前期动物实验表明,有氧耐力运动可以改善或预防高脂饮食诱导的肥胖,改善脂代谢,降低脂肪含量,比如,Emami等[14]发现,8周递增负荷耐力训练(15 m/min、15 min/d逐渐提高到20 m/min、60 min/d,每周5 d)可以显著降低高脂饮食大鼠的热量摄入和体质量,降低TG、TC、LDL-c水平。邹华刚等[7]的研究发现,6周有氧耐力训练(12 m/min,90 min/天,每周5天)可以改善高脂饮食小鼠的血脂。本文发现,16周的递增负荷运动(12~20 m/min,60 min/天,每周5天)可有效缓解高脂饮食小鼠肥胖的进展,改善小鼠血脂,减少内脏脂肪。
3.2 耐力训练对高脂饮食小鼠脂肪组织炎症的影响
肥胖通常伴随着骨骼肌、肝脏、脂肪、胰腺等局部组织和系统性炎症水平提高,这种代谢紊乱引起的慢性低度炎症又被称为代谢性炎症,慢性炎症在链接肥胖和胰岛素抵抗中起重要作用,在II型糖尿病发病中扮演重要的角色[8]。Weisberg[42]发现,长期高脂饮食小鼠脂肪组织巨噬细胞数量大幅增加,巨噬细胞释放了绝大部分的炎症因子TNF-α、IL-1β等。前期研究表明,炎症因子TNF-α为重要的胰岛素抵抗介质,能直接破坏脂肪组织、骨骼肌的胰岛素信号通路,降低胰岛素敏感性[20]。炎症因子IL-1β同样在肥胖相关胰岛素抵抗中发挥重要作用[21,35]。长期高脂饮食提高脂肪组织炎症反应,激活了经典的炎症信号通路,提高炎症因子基因表达[34]。同前期研究结果基本一致,本实验结果发现,16周的高脂饲料喂养显著提高了小鼠脂肪组织炎症因子TNF-α、IL-6、IL-1β mRNA表达,表明脂肪组织炎症水平提高。前期已经有大量研究通过建立肥胖模型观察运动对肥胖小鼠脂肪组织炎症的影响,或观察高脂饮食的同时运动干预对脂肪组织炎症的影响,均表明耐力运动对改善或预防脂肪组织炎症有着良好的效果[27,28]。同样,大量人体实验表明,长期有氧运动干预对改善肥胖或糖尿病人群脂肪组织炎症效果明显[11,12]。本实验同样证明,耐力训练可以有效抑制高脂饮食诱导的肥胖性脂肪组织炎症,抑制脂肪组织TNF-α、IL-6、IL-1β mRNA表达。
3.3 耐力训练对高脂饮食小鼠脂肪组织炎症小体的影响
脂肪组织巨噬细胞释放的IL-1β可在局部作用于脂肪细胞,影响脂肪细胞的胰岛素敏感性、脂肪生成,为肥胖相关胰岛素抵抗的关键机制[10]。脂肪组织巨噬细胞释放成熟IL-1β分子的过程需要两个信号严格调控。1)饱和脂肪酸、TNF-α等炎症介质通过TLR4/NF-КB信号通路提高巨噬细胞IL-1β基因表达,合成前体IL-1β,前体IL-1β没有生物活性[36]。2)NLRP3炎症小体通过激活半胱氨酸蛋白酶caspase1剪切前体IL-1β分子,形成IL-1β,分泌到局部或外周血[22]。有几项研究发现,NLRP3炎症小体为肥胖相关危险信号的感受器,NLRP3炎症小体激活与代谢紊乱密切相关。Vandanmagsar等[41]发现,长时间高脂饮食显著提高小鼠脂肪组织巨噬细胞表达NLRP3、ASC mRNA,而脂肪细胞NLRP3、ASC mRNA表达量极少。高脂饮食显著激活皮下和内脏脂肪NLRP3炎症小体(Caspase1活化),内脏脂肪尤为显著,附睾脂肪Caspase1随高脂饮食干预时间延长活化水平进一步提高。NLRP3-/-小鼠对肥胖诱导的脂肪组织NLRP3炎症小体激活产生抵抗,同时胰岛素敏感性显著高于正常基因型小鼠,敲除NLRP3基因还能降低脂肪组织IFN-γ、IL-1β mRNA表达,提高初始T细胞数量,降低效应T细胞数量。Stienstra等[38]通过研究NLRP3-/-、ASC-/-、Caspase1-/-3种小鼠同样发现,NLRP3炎症小体通路在肥胖诱导的炎症和胰岛素抵抗中起重要作用。NLRP3-ASC炎症小体通路还在肥胖诱导的胰腺炎症中发挥重要作用,通过调节IL-1β分泌影响胰岛β细胞功能和胰岛素分泌[43]。本实验结果发现,16周高脂饮食显著提高了脂肪组织NLRP3、ASC、Caspase1 mRNA表达,NLRP3 、ASC 蛋白表达同样显著提高,Caspase1显著激活,提示,高脂饮食激活了脂肪组织NLRP3炎症小体。Vandanmagsar等[41]的研究还发现,热量限制、运动训练均能显著降低肥胖的2型糖尿病患者脂肪组织NLRP3和IL-1β mRNA表达。然而,目前,耐力训练对高脂饮食动物脂肪组织NLRP3炎症小体通路的影响尚不清楚,本实验首次发现,16周有氧耐力训练显著抑制了脂肪组织炎症小体激活,降低了NLRP3、ASC、Caspase1 mRNA表达,降低了NLRP3、ASC蛋白含量,抑制caspase1激活。
3.4 耐力训练对高脂饮食小鼠脂肪组织氧化应激的影响
肥胖总是伴随脂肪组织氧化应激水平提高[15]和抗氧化酶活性下降,提示脂肪组织氧化还原平衡被破坏[32]。长期高脂饮食还提高了氧化应激相关的基因表达,Ko等[29]发现,5周高脂饮食显著提高了小鼠附睾脂肪NADPH氧化酶(NOX2)mRNA表达,NOX为脂肪细胞活性氧(ROS)主要来源。脂肪组织氧化应激在高脂饮食诱导的胰岛素抵抗中扮演着重要角色,超氧化物歧化酶(SOD)模拟物可以降低高脂饮食小鼠脂肪含量,改善脂肪组织炎症[37]。有意思的是,脂肪细胞特异性敲除锰超氧化物气化酶(Mn-SOD)的小鼠虽然脂肪组织超氧化物水平提高,但该小鼠对高脂饮食诱导的肥胖产生抵抗,因为Mn-SOD的缺失刺激了线粒体生物发生和解偶联呼吸,提高了能量消耗和代谢率[18]。氧化应激为脂肪组织炎症的一个重要机制,NOX产生的ROS可以上调脂肪细胞炎症因子IL-6、单核细胞趋化蛋白(MCP-1)表达[17]。MCP-1为募集外周血单核/巨噬细胞浸润脂肪组织的主要趋化因子,在高脂饮食诱导的脂肪组织慢性炎症中扮演着重要角色[23]。ROS还是激活NLRP3炎症小体信号通路的一个重要机制[9]。Furukawa等[15]发现,高脂膳食诱导的肥胖小鼠脂肪组织产生大量的过氧化氢(H2O2),抗氧化酶表达和活性下降,NOX蛋白表达增加。本研究发现,16周高脂饲料喂养提高了小鼠脂肪组织脂质过氧化标志物MDA和H2O2的含量,提示氧化应激水平提高,另外,NOX活性显著提高,Mn-SOD活性下降。有氧运动训练可以降低高脂饮食诱导的脂肪组织氧化应激,降低脂质过氧化(MDA),提高抗氧化酶表达[5,29]。Ko等[5]发现,8周递增负荷耐力运动显著降低了高脂饮食小鼠附睾脂肪NOX2 mRNA表达,提高了MnSOD mRNA表达,同时脂肪组织慢性炎症得到改善,提示,运动对慢性炎症的改善与氧化应激下降有关。本文也发现,16周有氧耐力训练能降低高脂饮食诱导的脂肪组织氧化应激,MDA、H2O2水平下降,NOX活性降低,同时Mn-SOD活性提高。
4 结论
长期高脂饮食不但可激活小鼠脂肪组织NLRP3炎症小体信号通路,还能提高NLRP3炎症小体信号通路相关基因表达;长期耐力训练可明显缓解高脂饮食诱导的小鼠脂肪组织炎症,抑制NLRP3炎症小体信号通路激活和相关基因表达,这可能与脂肪组织氧化应激降低有关。
[1] 曹姣,宋德军,肖国强.有氧运动和白藜芦醇对肥胖大鼠主动脉内皮细胞内分泌功能的影响[J].体育科学,2014,34(5):29-34.
[2] 付鹏宇,龚丽景,赵林青,等.有氧运动和饮食干预对肥胖小鼠Visfatin水平的影响及其与氧化应激的关系[J].中国运动医学杂志,2014,(1):52-57.
[3] 马国栋,刘艳环,刘善云.有氧运动对高脂膳食诱导小鼠脂肪肝及血脂改善效果的观察[J]. 天津体育学院学报, 2006,(1):35-37.
[4] 孙婧瑜,漆正堂,崔迪,等.骨骼肌腺苷酸活化蛋白激酶在高脂饮食诱导小鼠肥胖易感性差异中的作用[J].中国运动医学杂志, 2014,(2):141-146.
[5] 杨洪涛,李娟,陈巍,等.运动对胰岛素抵抗大鼠脂肪组织氧化应激及炎症的影响[J].西安体育学院学报,2010,(2):206-209.
[6] 邹华刚,陈香仙.耐力运动通过抑制HIF-1α/iNOS预防高脂饮食小鼠脂肪组织炎症[J].中国体育科技,2016,(2):85-89.
[7] 邹华刚,陈香仙.耐力运动和AdipoRon对高脂饮食小鼠脂肪组织炎症的影响[J].西安体育学院学报, 2015, (4): 468-475.
[8] 詹莉莉,杨志秋,傅正伟.肥胖与慢性炎症的研究进展[J].中国细胞生物学学报,2011,(3):297-305.
[9] ABAIS J M, XIA M, ZHANG Y,. Redox regulation of NLRP3 inflammasomes: ROS as trigger or effector?[J]. Antioxid Redox Signal, 2015, 22(13): 1111-1129.
[10] BING C. Is interleukin-1beta a culprit in macrophage-adipocyte crosstalk in obesity?[J]. Adipocyte, 2015, 4(2): 149-152.
[11] BRUUN J M, HELGE J W, RICHELSEN B,. Diet and exercise reduce low-grade inflammation and macrophage infiltrat-ion in adipose tissue but not in skeletal muscle in severely obese subjects[J]. Am J Physiol Endocrinol Metab, 2006, 290(5): 961-967.
[12] CHRISTIANSEN T, PAULSEN S K, BRUUN J M,. Exercise training versus diet-induced weight-loss on metabolic risk factors and inflammatory markers in obese subjects: a 12-week randomiz-ed intervention study[J]. Am J Physiol Endocrinol Metab, 2010, 298(4): 824-831.
[13] DONATH M Y, SHOELSON S E. Type 2 diabetes as an inflame-matory disease[J]. Nat Rev Immunol, 2011, 11(2): 98-107.
[14] EMAMI S R, JAFARI M, HAGHSHENAS R,. Impact of eight weeks endurance training on biochemical parameters and obesity-induced oxidative stress in high fat diet-fed rats[J]. J Exerc Nutrition Biochem, 2016, 20(1): 29-35.
[15] FURUKAWA S, FUJITA T, SHIMABUKURO M,. Increas-ed oxidative stress in obesity and its impact on metabolic syndro-me[J]. J Clin Invest, 2004, 114(12): 1752-1761.
[16] FUSTER J J, OUCHI N, GOKCE N,. Obesity-induced changes in adipose tissue microenvironment and their impact on cardiovascular disease[J]. Circ Res, 2016, 118(11): 1786-1807.
[17] HAN C Y, UMEMOTO T, OMER M,. NADPH oxidase-derived reactive oxygen species increases expression of monocyte chemotactic factor genes in cultured adipocytes[J]. J Biol Chem, 2012, 287(13): 10379-10393.
[18] HAN Y H, BUFFOLO M, PIRES K M,. Adipocyte-specific seletion of manganese superoxide dismutase protects from diet-Induced obesity via increased mitochondrial uncoupling and biogenesis[J]. Diabetes, 2016, 65(9): 2639.
[19] HOTAMISLIGIL G S. Inflammation and metabolic disorders[J]. Nat, 2006, 444(7121): 860-867.
[20] HOTAMISLIGIL G S, PERALDI P, BUDAVARI A,. IRS-1-mediated inhibition of insulin receptor tyrosine kinase activity in TNF-alpha- and obesity-induced insulin resistance[J]. Sci, 1996, 271(5249): 665-668.
[21] JAGER J, GREMEAUX T, CORMONT M,. Interleukin-1beta-induced insulin resistance in adipocytes through down-regulation of insulin receptor substrate-1 expression[J]. Endocri-nol, 2007, 148(1): 241-251.
[22] JINN C, FLAVELL R A. Molecular mechanism of NLRP3 infla-mmasome activation[J]. J Clin Immunol, 2010, 30(5): 628-631.
[23] KANDA H, TATEYA S, TAMORI Y,. MCP-1 contributes to macrophage infiltration into adipose tissue, insulin resistance, and hepatic steatosis in obesity[J]. J Clin Invest, 2006, 116(6): 1494-1505.
[24] KAWANISHI N, MIZOKAMI T, YANO H,. Exercise atten-uates M1 macrophages and CD8+ T cells in the adipose tissue of obese mice[J]. Med Sci Sports Exerc, 2013, 45(9): 1684-1693.
[25] KAWANISHI N, NIIHARA H, MIZOKAMI T,. Exercise training attenuates neutrophil infiltration and elastase expression in adipose tissue of high-fat-diet-induced obese mice[J]. Physiol Rep, 2015, 3(9):e12534.
[26] KAWANISHI N, YANO H, YOKOGAWA Y,. Exercise trai-ning inhibits inflammation in adipose tissue via both suppression of macrophage infiltration and acceleration of phenotypic switch-ing from M1 to M2 macrophages in high-fat-diet-induced obese mice[J]. Exerc Immunol Rev, 2010, 16: 105-118.
[27] KAWANISHI N, YANO H, YOKOGAWA Y,. Exercise training inhibits inflammation in adipose tissue via both suppress-ion of macrophage infiltration and acceleration of phenotypic swi-tching from M1 to M2 macrophages in high-fat-diet-induced obese mice[J]. Exerc Immunol Rev, 2010, 16: 105-118.
[28] KIZAKI T, MAEGAWA T, SAKURAI T,. Voluntary exer-cise attenuates obesity-associated inflammation through ghrelin expressed in macrophages[J]. Biochem Biophys Res Commun, 2011, 413(3): 454-459.
[29] KO J, KIM K. Effects of exercise and diet composition on expres-sion of MCP-1 and oxidative stress-related mRNA of adipose tissue in diet-induced obese mice[J]. J Exerc Nutrition Biochem, 2013, 17(4): 181-188.
[30] KOENEN T B, STIENSTRA R, VAN TITS L J,. The inflam-masome and caspase-1 activation: a new mechanism under-lying increased inflammatory activity in human visceral adipose tissue[J]. Endocrinol, 2011, 152(10): 3769-3778.
[31] LARSEN C M, FAULENBACH M, VAAG A,. Interleukin-1-receptor antagonist in type 2 diabetes mellitus[J]. N Engl J Med, 2007, 356(15): 1517-1526.
[32] LEE Y S, KIM A Y, CHOI J W,. Dysregulation of adipose glutathione peroxidase 3 in obesity contributes to local and systemic oxidative stress[J]. Mol Endocrinol, 2008, 22(9): 2176-2189.
[33] LEVIN B E, DUNN-MEYNELL A A. Differential effects of exer-cise on body weight gain and adiposity in obesity-prone and resistant rats[J]. Int J Obes (Lond), 2006, 30(4): 722-727.
[34] LUMENG C N, BODZIN J L, SALTIEL A R. Obesity induces a phenotypic switch in adipose tissue macrophage polarization[J]. J Clin Invest, 2007, 117(1): 175-184.
[35] MCGILLICUDDY F C, HARFORD K A, REYNOLDS C M,. Lack of interleukin-1 receptor I (IL-1RI) protects mice from high-fat diet-induced adipose tissue inflammation coincident with improved glucose homeostasis[J].Diabetes,2011,60(6):1688-1698.
[36] PAHWA R, DEVARAJ S, JIALAL I. The effect of the accessory proteins, soluble CD14 and lipopolysaccharide-binding protein on Toll-like receptor 4 activity in human monocytes and adipocytes[J]. Int J Obes (Lond), 2016, 40(6): 907-911.
[37] PIRES K M, ILKUN O, VALENTE M,. Treatment with a SOD mimetic reduces visceral adiposity, adipocyte death, and adipose tissue inflammation in high fat-fed mice[J]. Obesity (Silver Spri-ng), 2014, 22(1): 178-187.
[38] STIENSTRA R, VAN D J A, Tack C J,. Inflamma-some is a central player in the induction of obesity and insulin resistance[J]. Proc Natl Acad Sci U S A, 2011, 108(37): 15324-15329.
[39] TACK C J, STIENSTRA R, JOOSTEN L A,. Inflammation links excess fat to insulin resistance: the role of the interleukin-1 family[J]. Immunol Rev, 2012, 249(1): 239-252.
[40] UYSAL K T, WIESBROCK S M, MARINO M W,. Protect-ion from obesity-induced insulin resistance in mice lacking TNF-alpha function[J]. Nat, 1997, 389(6651): 610-614.
[41] VANDANMAGSAR B, YOUM Y H, RAVUSSIN A,. The NLRP3 inflammasome instigates obesity-induced inflammation and insulin resistance[J]. Nat Med, 2011, 17(2): 179-188.
[42] WEISBERG S P, MCCANN D, DESAI M,. Obesity is assoc-iated with macrophage accumulation in adipose tissue [J]. J Clin Invest, 2003, 112(2): 1796-1808.
[43] YOUM Y H, ADIJIANG A, VANDANMAGSAR B,. Elimi-nation of the NLRP3-ASC inflammasome protects against chronic obesity-induced pancreatic damage[J]. Endocrinol, 2011, 152(11): 4039-4045.
The Effects of Endurance Training on NLRP3 Inflammasome Pathway in Adipose Tissue of Mice Fed a High-fat Diet
CHENG Yan, HUANG Xu-gen
Anhui Normal University, Wuhu 241000, China.
Objective: The aim of this study was to investigate the effects of endurance training on NLRP3 inflammasome signaling pathway in adipose tissue of mice fed a high-fat diet. Methods: 4-week old male C57BL/6 mice were randomly divided into normal diet control group(NC, n=10), normal diet exercise group(NE, n=10), high fat diet control group (HC, n=12) and high fat diet exercise group (HE, n=12). Exercise groups were trained on a motorized treadmill for 60 min/d at running speeds of 12-20 m/min, 5 times/week, for 16 weeks. NLRP3 inflammasome-related gene, protein changes and oxidative stress in adipose tissue were measured. Results:1) Compared with NC group, body mass, epididymal fat mass in HC group was significantly increased (<0.01), serum TG, TC, LDL-c, FFAs were significantly elevated (<0.01); epididymal fat NLRP3, ASC, Caspase1, TNF-α, IL-6 and IL-1β mRNA were markedly increased (<0.01), NLRP3, ASC, pro-casp1 and the clevaged caspase1 (p20) protein were also significantly increased (<0.01), epididymal fat MDA, H2O2 levels and NOX activity were increased significantly (<0.01) while Mn-SOD activity was reduced significantly (<0.01). 2) Compared with NC group, no significant difference was found among all parameters in NE group. 3) Compared with HC group, body mass, serum TG, FFAs in HE group was significantly reduced (<0.05). Although epididymal fat mass was not significantly reduced, NLRP3, ASC, Caspase1, TNF-α, IL-6 and IL-1β mRNA expression and NLRP3, ASC protein content were significantly reduced (<0.05 or<0.01). While the pro-casp1 protein was not significantly changed, p20 was significantly reduced (<0.05). In addition, epididymal fat MDA, H2O2 levels and NOX activity were significantly reduced (<0.05) while Mn-SOD activity was increased significantly (<0.05). 4) Compared with NE group, body mass, serum TG, FFAs, epididymal fat NLRP3, ASC, Caspase1, TNF-α, IL-6 and IL-1β mRNA expression and NLRP3 protein in HE group was significantly higher than NE group (<0.05 or<0.01). Conclusion: Long-term incremental load endurance training obviously inhibited the activation of NLRP3 signaling pathway and inflammation in adipose tissue-induced by high fat diet, possibly by reducing oxidative stress.
1000-677X(2018)02-0065-09
10.16469/j.css.201802006
G804.7
A
2017-12-13;
2018-02-02
安徽省高校省级自然科学基金重点项目(KJ2014A086)。
程燕,女,讲师,硕士,主要研究方向为运动与健康促进,E-mail:1198601755@qq.com;黄徐根,男,副教授,博士,主要研究方向为肥胖与胰岛素抵抗的运动干预, Email:xugen huang@126.com。
