团头鲂池塘工业化生态养殖系统中浮游动物群落特征分析
2018-03-07孟顺龙李丹丹裘丽萍胡庚东范立民宋超吴伟郑尧陈家长徐跑
孟顺龙, 李丹丹, 裘丽萍, 胡庚东, 范立民,宋超, 吴伟, 郑尧, 陈家长, 徐跑
(1.中国水产科学研究院淡水渔业研究中心,农业部长江下游渔业资源环境科学观测试验站,中国水产科学研究院内陆渔业生态环境和资源重点开放试验室,江苏无锡214081;2.南京农业大学无锡渔业学院,江苏无锡214081)
中国是世界水产养殖大国,池塘养殖以其占水产养殖总产量49.2%的绝对优势而成为中国水产养殖的主体[1]。但是,目前中国的池塘养殖面临着水环境污染严重[2-3]和机械化程度低[4]两大瓶颈问题,从而限制了池塘养殖业的健康可持续发展。因此,创新养殖模式,提升池塘养殖的现代化程度,降低池塘养殖对内、外环境的污染,已经成为现代池塘养殖业亟待解决的关键问题。为此,国内学者在借鉴国外分区养殖系统的基础上,提出了池塘工业化生态养殖系统概念,即利用占池塘面积2%~5%的水面建设具有气提推水充气和集排污装备的系列水槽作为养殖区进行类似于 “工厂化”的高密度养殖,实施工业化管理,并对其余95%~98%的水面进行适当改造后,作为净化区对残留在池塘的养殖尾水进行生物净化处理,实现养殖周期内养殖尾水的零排放或达标排放[5]。这样,通过将养殖单元和水质净化单元分离,仅用小面积水域就养殖了原有甚至超过原有总水域面积的产量,彻底革新了传统池塘养鱼模式,是80∶20养殖模式的技术升级。
池塘工业化生态养殖系统作为一种新型池塘生态养殖模式,虽然已经在部分地区得到了推广应用[6],但其基础研究仍十分薄弱,仅开展了池塘工业化生态养殖系统的工程建设[7]、集排污效果[8-9]、养殖品种选择[10],以及产量[5]和经济效益[6]等方面的研究,而有关该系统中浮游动物群落结构的研究尚未见报道。浮游动物是重要的次级生产者,是食物链的关键环节,在生态系统结构、功能和生源要素循环中起着重要作用[11]。浮游动物不仅能反映出水体生态环境状况[12-13],而且也是一些经济型水产动物的主要饵料[11]。为此,本试验中研究了团头鲂池塘工业化生态养殖系统中浮游动物 (轮虫、枝角类、桡足类)的群落结构变化,以期为阐明池塘工业化生态养殖系统的生态学机理提供科学依据。
1 材料与方法
1.1 材料
试验养殖品种为团头鲂Megalobrama amblycephala,初始体质量为 (3.33±0.52)g,体长为 (56.13±3.45)mm。
1.2 方法
1.2.1 试验设计 试验于江苏省建湖县的盐城正荣生态渔业有限公司进行。池塘工业化生态养殖系统包括养殖区、进水区、排水区、净化区、循环区、循回区6个试验分区 (图1);其中,养殖区根据试验需要可划分为高密度养殖区 (300 ind./m2)和低密度养殖区 (200 ind./m2);净化区、循环区、循回区应用生物浮岛栽培空心菜、水芹等进行水质净化,并根据水流方向将其命名为净化区、循环区、循回区;其余各区均未有净化植物。进水区、排水区、净化区、循环区、循回区的面积分别为3000、900、15 000、170 000、55 000 m2,水深分别为4.0、2.0、1.2、1.5、2.0 m。养殖区总面积为5720 m2,由52个面积为110 m2的水泥池组成,池深2.5 m,水深2.0 m。因本试验为生产性试验,各试验分区均未设置重复。
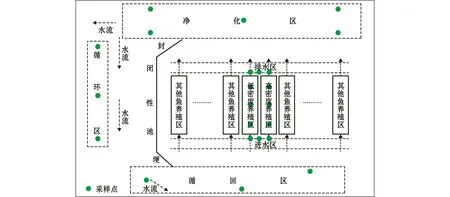
图1 池塘工业化生态养殖系统示意图Fig.1 Schematic diagram of an industrial eco-aquaculture system
1.2.2 养殖试验 养殖期间的日投喂量约为鱼体质量的3%~5%,每日分3次投喂,投喂时间分别为9:00、12:30、16:00。养殖期间保持微流水,推水前端水流速度为12 cm/s。配置微管增氧系统,以作为备用;微管增氧系统在平常不开启,只在水体溶解氧低于3 mg/L时开启。
1.2.3 浮游动物采集、鉴定和计数 试验于2016年7月开始,2017年4月结束。夏、秋季每月采样1次,冬、春季每两月采样1次,共采集8次。试验区共设置23个采样点,其中,高密度养殖区3个、低密度养殖区3个、进水区3个、排水区3个、净化区5个、循环区3个、循回区3个,各试验分区的采样点位置如图1所示。
浮游动物样品采集方法参照文献[14],用1 L有机玻璃采水器在距水面0.5 m处采集水样10 L,现场用25号浮游生物网过滤、收集到样品瓶中,加入3 mL甲醛并摇匀,带回实验室静置沉淀24 h后浓缩并定容至30 mL供镜检。计数方法参照文献[15],分类方法参照文献[16-28]。
1.3 数据处理
采用Pielou均匀度指数 (J)和Shannon-Wiener香农-威纳多样性指数 (H′)对水体浮游动物的生态学特征进行分析评价。上述各项指数的计算方法参照文献[14]。
2 结果与分析
2.1 浮游动物种类组成和丰度
试验期间,低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区共鉴定出轮虫类、枝角类、桡足类共25种,无节幼体1类。其中,轮虫类14种,占总种数的56%;枝角类8种,占总种数的32%;桡足类3种,占总种数的12%。试验期间浮游动物种类组成如表1所示。
低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区分别鉴定出浮游动物16、13、18、12、17、19、18种, 种类数变化分别为 13~17、 12~14、 15~19、 9~13、 14~18、15~20、15~19种 (图2-A),月平均种类数分别为15、12、17、11、16、17、17种。 各月各试验分区的浮游动物种类数依次为进水区、净化区、循环区、循回区>低密度养殖区>高密度养殖区>排水区。从季节变化上看,各试验分区的种类数总体依次为夏季>秋季>冬季。
低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区的浮游动物总丰度变化范围分别为 311~686、 187~753、 650~1598、411~1118、 680~1486、 599~1392、 622~1397 ind./L, 平 均 为 540、 424、 1125、 728、 1202、993、994 ind./L(图2-B)。浮游动物总丰度表现为:进水区、净化区、循环区、循回区>排水区>低密度养殖区>高密度养殖区。从季节变化上看,各试验分区的总丰度总体表现为夏季>秋季>冬季。
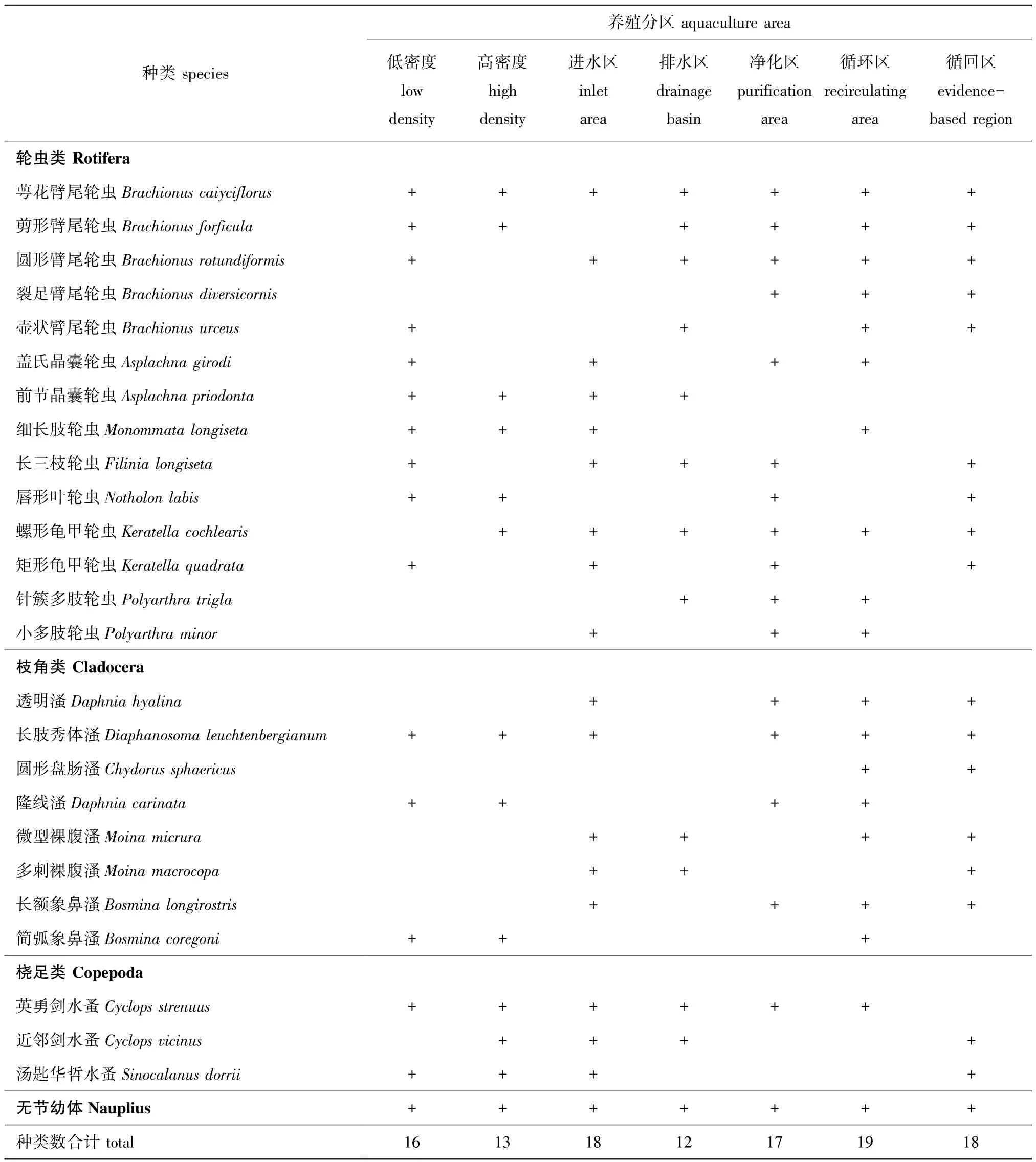
表1 各分区的浮游动物组成及种类数Tab.1 Composition and number of species of zooplankton in each partition
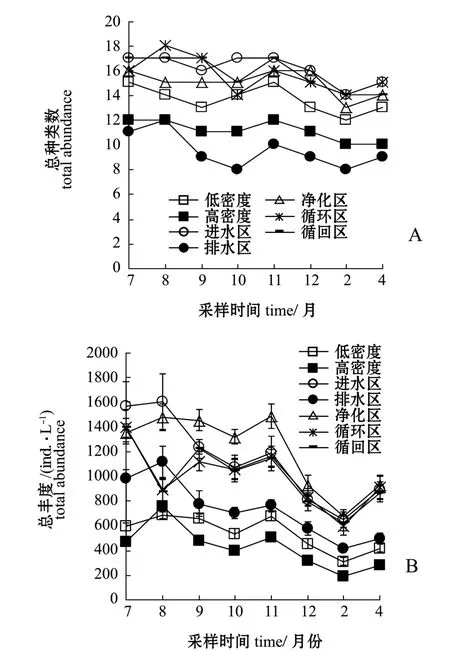
图2 浮游动物丰度和种类数变化Fig.2 Abundance and species number of zooplankton
2.2 轮虫、枝角类、桡足类丰度及其所占比例
试验期间,低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区的轮虫丰度变化范围分别为235~571、 146~475、 469~804、298~629、 487~1209、 432~762、 451~723 ind./L,月平均丰度分别为411、316、660、465、824、622、596 ind./L(图3-A);枝角类丰度变化范围分别为 23~58、 9~37、 74~284、 38~258、74~231、 80~232、 78~282 ind./L, 月平均丰度分别为 41、 20、 179、 114、 149、 154、 166 ind./L(图4-A);桡足类丰度变化范围分别为53~121、32~268、 107~653、 75~306、 96~524、 87~548、93~614 ind./L,月平均丰度分别为89、88、287、150、 229、 218、 233 ind./L(图5-A)。 各养殖分区的轮虫、枝角类、桡足类丰度均依次为进水区、净化区、循环区、循回区>排水区>低密度养殖区>高密度养殖区。从季节变化上看,各试验分区的轮虫、枝角类、桡足类丰度总体由高至低依次为夏季>秋季>冬季。
试验期间,低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区的轮虫比例变化范围分别在70.6%~83.2%、63.1%~81.3%、40.3%~72.2%、49.7%~73.3%、53.2%~81.9%、44.0%~72.1%、38.1%~72.5%之间,月平均比例分别为75.6%、76.0%、61.2%、65.8%、68.5%、64.1%、62.0%(图3-B);枝角类比例变化范围分别为4.8%~10.7%、1.3%~8.1%、11.4%~18.1%、8.5%~23.1%、5.0%~15.9%、12.8%~18.4%、9.7%~23.1%,月平均比例分别为7.7%、5.1%、15.5%、14.3%、12.8%、15.2%、16.0%(图4-B);桡足类比例变化范围分别为12.0%~18.6%、13.9%~35.6%、16.5%~34.1%、16.9%~31.1%、13.1%~38.8%、14.5%~39.4%、15.0%~44.0%,月平均比例分别为 16.7%、18.9%、23.4%、19.9%、18.7%、20.7%、22.0%(图5-B)。枝角类、桡足类比例表现为养殖区低于其他各区,而轮虫类则相反,表现为养殖区高于其他各区。
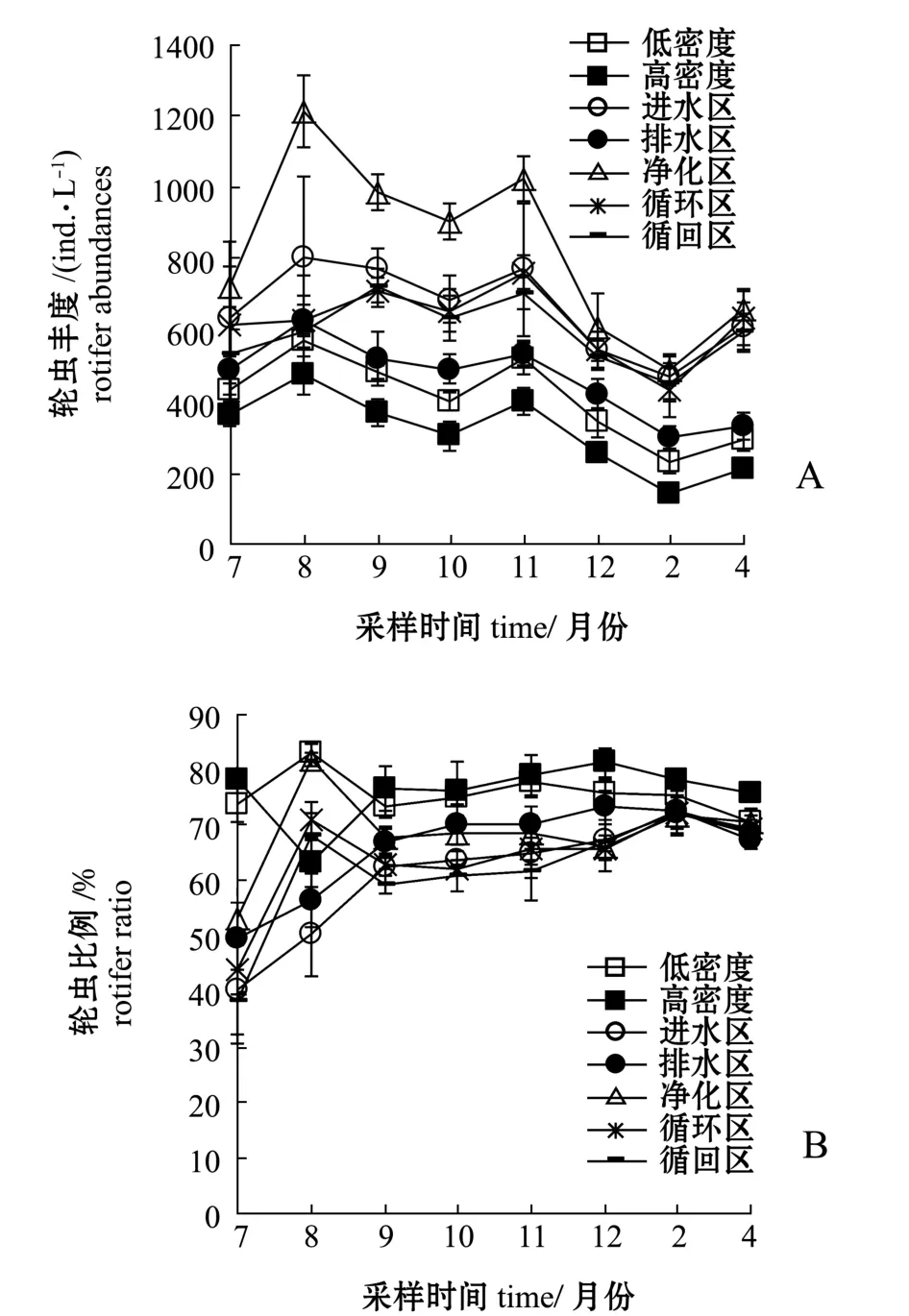
图3 轮虫丰度及其所占比例变化Fig.3 Abundance and proportion of rotifer in total zooplankton
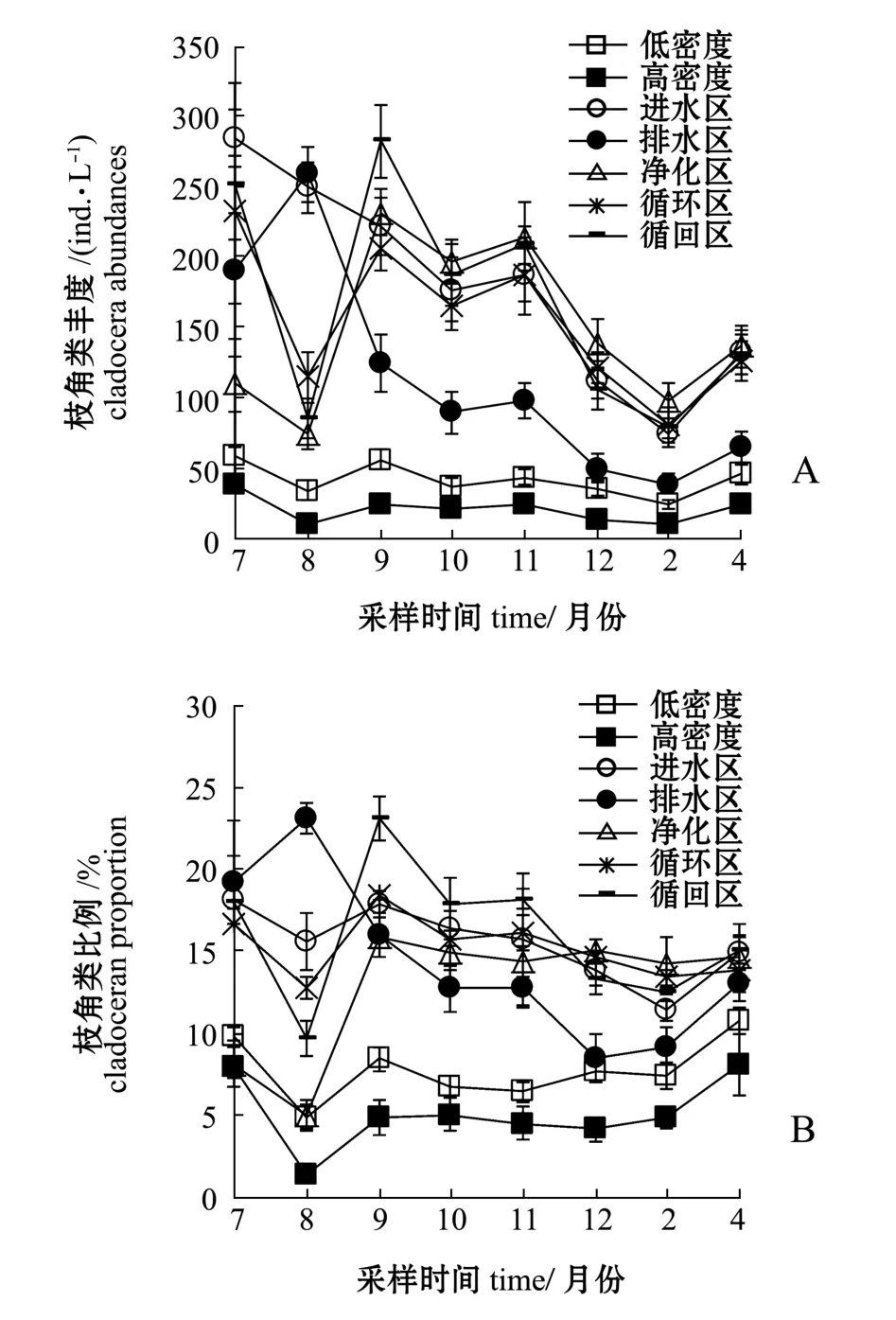
图4 枝角类丰度及其所占比例变化Fig.4 Abundance and proportion of cladocera in total zooplankton
2.3 多样性和均匀度
从图6可见:试验期间,低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区的多样性指数变化范围分别为2.43~2.86、1.68~2.45、 2.95~3.53、 1.42~2.93、 3.08~3.42、2.93~3.41、 3.02~3.41, 平均值分别为2.70、 2.13、 3.35、 1.94、 3.24、 3.24、 3.28; 均匀度指数变化范围分别为 0.66~0.80、0.49~0.74、 0.74~0.91、 0.45~0.82、 0.77~0.90、0.75~0.86、 0.77~0.88, 平均值分别为 0.72、0.62、 0.84、 0.60、 0.83、 0.82、 0.83。 多样性指数和均匀度指数均由高至低依次为进水区、净化区、循环区、循回区>低密度养殖区>高密度养殖区>排水区。

图5 桡足类丰度及其所占比例变化Fig.5 Abundance and proportion of copepod in total zooplankton
3 讨论
3.1 浮游动物种类组成和丰度
浮游动物种类组成和丰度受水温、水流、饵料生物、敌害生物等因子的影响[19-20]。在浮游动物种类组成方面,本研究中显示,养殖区的轮虫比例高于其他各区,而枝角类和桡足类则相反,表现为养殖区低于其他各区。研究表明,由于鱼类对浮游动物的摄食而使养殖区的浮游动物呈现出小型化趋势。鱼类捕食的下行效应可极大改变浮游动物的群落结构和大小组成,是影响其群落结构的重要因素之一[21]。鱼类的捕食对浮游动物个体大小有明显的选择性,在同等能耗下优先选择个体较大的浮游动物,所以这也是个体较小的轮虫占据绝对优势,而个体较大的枝角类和桡足类比例较低的原因之一[22]。此外,鱼类对浮游动物形成的捕食压力与鱼类的放养密度呈正相关性[22]。本研究中,高密度养殖区的浮游动物总丰度低于低密度养殖区,这可能与高密度养殖区的鱼类摄食压力较大有关,这也在一定程度上反映了本系统中浮游动物为鱼类的生长提供了优质饵料。同时,本研究结果显示,各试验分区的浮游动物总丰度变化为187~1598 ind./L,表明各试验分区的浮游动物丰度较高,能为鱼类提供丰富的生物饵料,从而降低配合饲料的投入量。
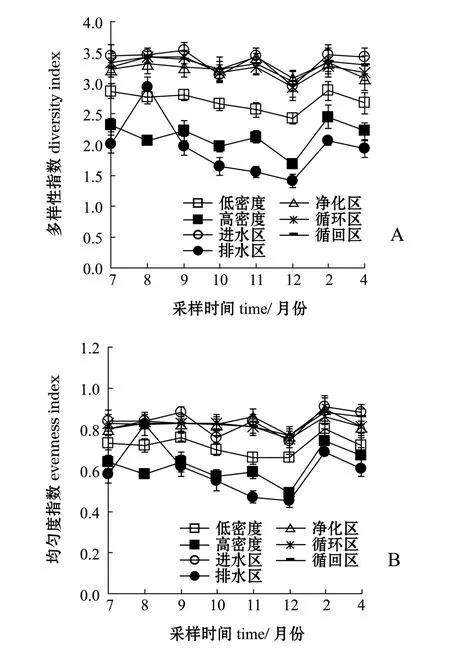
图6 浮游动物多样性指数和均匀度指数Fig.6 Biodiversity and uniformity of zooplankton
从浮游动物丰度变化上看,本研究中,从2016年7月至2017年4月,浮游动物丰度呈现出先降低后升高的变化趋势;7月至11月的浮游动物丰度较高,12月至次年4月的浮游动物丰度较低,且2月浮游动物丰度最低。这种现象的出现,可能与温度及浮游植物丰度有关[19-20]。杨宇峰等[19]研究认为,温度是影响浮游动物丰度的重要因素,一般浮游动物在高温季节具有较高的活力和繁殖力,如剑水蚤一般在春季水温近10℃时开始出现,水温20℃以上时数量较多,30℃以上出现高峰,秋季水温降至10℃左右时消失[19]。本试验中,水温呈现出先降低后升高的变化趋势,且2月份水温最低,这与浮游动物丰度的变化趋势基本一致。同时,浮游植物丰度对浮游动物丰度也有重要影响[14,19],本研究中对浮游植物的同步监测显示,从2016年7月至2017年4月,浮游植物丰度呈现出先降低后升高的变化趋势,且2月份浮游植物丰度最低,这与浮游动物的变化趋势一致。由于浮游植物是浮游动物的重要食物源,因此,浮游植物丰度变化也是导致浮游动物丰度变化的重要原因[23]。本试验结果与陈亮等[24]关于浮游植物增加导致浮游动物增加的论述一致。
3.2 浮游动物多样性和均匀度
物种多样性是用于评价群落种类组成稳定程度、数量分布均匀程度和生物资源丰富程度的客观指标[14,25]。根据多样性指数的大小可将其分为5级,<0.6为Ⅰ级,表示多样性差;0.6~1.5为Ⅱ级,表示多样性一般;1.6~2.5为Ⅲ级,表示多样性较好;2.6~3.5为Ⅳ级,表示多样性丰富;>3.5为Ⅴ级,表示多样性非常丰富[16,27]。本研究显示,低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区的多样性指数分别为 2.70、 2.13、 3.35、 1.94、 3.24、 3.24、 3.28,这表明低密度养殖区、进水区、净化区、循环区、循回区的浮游动物多样性丰富,而高密度养殖区、排水区的浮游动物多样性较好。同时,生物多样性也是判断水质优劣的重要依据之一,多样性指数>3为清洁,2~3为轻度污染,1~2为中度污染,<1为重污染,且多样性指数越大水质越好[14,26]。因此,从生物多样性指数反映的水质状况看,排水区处于中度污染状态,养殖区处于轻度污染状态,其余各区处于清洁状态。这表明除排水区外,其余各试验分区的水质均较好,系统运行良好。
均匀度是反映群落结构特征的一个重要指标,用它评价浮游动物的多样性更为直观、清晰,能够表征出物种个体数目分配的均匀程度。均匀度变化在0~l,通常以均匀度>0.3作为多样性较好的标准进行综合评价[14,27]。本研究显示,低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区的均匀度指数分别为0.72、0.62、0.84、0.60、0.83、0.82、0.83, 表明所有试验分区的均匀度指数均较好。一般而言,较为稳定的群落具有较高的多样性和均匀度[14,28],本研究中,进水区、净化区、循环区、循回区优于养殖区和排水区,且以排水区最差。曾碧健等[29]关于生态浮床原位修复对养殖池塘浮游动物群落结构影响的研究结果表明,生态浮床能够提高浮游动物的种类数和多样性;李爽[30]研究认为,水蕹菜浮床能显著提高浮游动物种类数、多样性和均匀度。这与本研究结果一致。
比较两个养殖密度区的浮游动物特征可见,低密度养殖区的浮游动物种类数、丰度、多样性指数、均匀度指数均大于高密度养殖区,表明低密度养殖区的浮游动物群落结构及其所指示的水质状况优于高密度养殖区。本试验中对团头鲂的生长试验及综合经济效益分析研究显示,高密度养殖区的总产量高于低密度养殖区,但低密度养殖区的综合经济效益高于高密度养殖区。因此,从环境效益和经济效益两个方面综合分析,低密度养殖更优。
4 结论
本试验中,各试验区共鉴定出浮游动物25种、无节幼体1类,其中,轮虫15种、枝角类8种、桡足类3种,分别占总种数的56%、32%、12%。
各试验分区的浮游动物种类数、多样性指数和均匀度指数均依次为进水区、净化区、循环区、循回区>低密度养殖区>高密度养殖区>排水区。各试验分区的浮游动物总丰度变化范围为187~1598 ind./L,浮游动物丰度较高,能为鱼类提供丰富的生物饵料。因鱼类摄食而使养殖区浮游动物呈现出小型化趋势。
从生物多样性指数反映的水质状况看,养殖区处于轻度污染状态,排水区处于中度污染状态,其余各区处于清洁状态。表明除排水区外,其余各试验分区的水质均较好,系统运行良好。
[1] 农业部渔业渔政管理局.2016中国渔业统计年鉴[M].北京:中国农业出版社,2016.
[2] 李敏,段登选,许国晶,等.大薸微生态制剂协同净化养殖池塘富营养化水体的效果[J].生态与农村环境学报,2015,31(1):94-99.
[3] 周国庆,李华,张东升,等.3株芽孢杆菌对刺参池塘有机物的降解效果及鉴定[J].大连海洋大学学报,2016,31(1):19-23.
[4] 郑志营.自动投饵机器船的轨迹优化方法研究[D].镇江:江苏大学,2015.
[5] 张茂友,诸葛燕,徐雪英,等.池塘工业化生态养殖系统鱼虾共养模式试验[J].水产养殖,2017,38(3):20-22.
[6] 许晨旭,倪建忠,杨正兵,等.池塘工业化养殖系统养殖试验[J].科学养鱼,2016(4):21-22.
[7] 顾树庭,杜兴伟,杨小猛.低碳·高效的池塘循环流水养殖系统模块建设及功能分析[J].安徽农业科学,2016,44(10):312-314.
[8] 何玉明,张天虎,陈文永,等.影响池塘工业化生态养殖系统水槽集排污效果的因素与对策[J].科学养鱼,2016(6):2-3.
[9] 何玉明,陈文永,张正弼,等.漏斗型集排污装置在池塘工业化生态养殖系统中的应用研究[J].科学养鱼,2017(1):22-23.
[10] 张林兵,徐跑,徐钢春,等.多品种主养池塘循环流水槽生态养殖试验[J].科学养鱼,2016(9):20-21.
[11] 李开枝,尹健强,黄良民.河口浮游动物生态学研究进展[J].海洋科学,2007,31(3):72-75.
[12] 高欣,景泓杰,赵文,等.凡纳滨对虾高位养殖池塘浮游生物群落结构及水质特征[J].大连海洋大学学报,2017,32(1):44-50.
[13] 蔡志龙,秦美川,赵文,等.两种混养模式海水池塘浮游生物的群落结构及其粒径特征[J].大连海洋大学学报,2016,31(6):663-672.
[14] 孟顺龙,肖代,陈小丽,等.丰、枯水期里下河腹地典型水体浮游动物群落结构与水质评价[J].水生态学杂志,2016,37(6):76-83.
[15] 国家环境保护总局,水和废水监测分析方法编委会.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[16] 韩茂森,束蕴芳.中国淡水生物图谱[M].北京:海洋出版社,1995.
[17] 蒋燮治,堵南山.中国动物志—淡水枝角类[M].北京:科学出版社,1979.
[18] 王家楫.中国淡水轮虫志[M].北京:科学出版社,1961.
[19] 杨宇峰,黄祥飞.浮游动物生态学研究进展[J].湖泊科学,2000,12(1):81-89.
[20] 王婕妤,黄备,贾海波,等.2011年春、秋季浙江舟山海域浮游动物群落结构和多样性现状[J].浙江海洋学院学报:自然科学版,2014,33(4):311-316.
[21] Gliwicz Z M.Relative significance of direct and indirect effects of predation by planktivorous fish on zooplankton[J].Hydrobiologia,1994,272(1-3):201-210.
[22] 李林春.分区池塘中浮游生物的分析研究[J].中国农学通报,2012,28(29):104-108.
[23] 代鲁平,李超伦,孙晓霞,等.2012年冬季菲律宾海浮游动物丰度和生物量的水平分布[J].海洋与湖沼,2014,45(6):1225-1233.
[24] 陈亮,刘一,禹娜,等.分水江水库浮游动物群落结构的初步研究及水质评价[J].华东师范大学学报:自然科学版,2010,(6):72-82.
[25] 陈家长,孟顺龙,尤洋,等.太湖五里湖浮游植物群落结构特征分析[J].生态环境学报,2009,18(4):1358-1367.
[26] 李学军,鲍战猛,高彩凤,等.北运河浮游动物调查及水质评价[J].生态学杂志,2014,33(6):1559-1564.
[27] 孙军,刘东艳,白洁,等.2001年冬季渤海的浮游植物群落结构特征[J].中国海洋大学学报,2004,34(3):403-422.
[28] 姜作发,唐富江,董崇智,等.黑龙江水系主要江河浮游植物种群结构特征[J].吉林农业大学学报,2007,29(1):53-57.
[29] 曾碧健,岳晓彩,黎祖福,等.生态浮床原位修复对海水养殖池塘浮游动物群落结构的影响[J].海洋与湖沼,2016,47(2):354-359.
[30] 李爽.水蕹菜浮床对精养鱼池浮游动物群落结构的影响[D].武汉:华中农业大学,2013.
