轻度氧化油脂对肉仔鸡生长性能、脏器指数和肠道形态的影响
2018-03-07孙得发边四辈
赵 剑,孙得发*,边四辈,谭 权
(诺伟司国际贸易(上海)有限公司,上海 200080)
油脂是肉鸡饲料中重要的能量饲料之一,在肉鸡饲料中添加油脂能提高肉鸡的增重、饲料利用率和饲料能量沉积[1]。而在高温高湿环境下或金属离子催化作用下,油脂中的不饱和键易被氧化生成醛、酮及羟酸等氧化产物,这些氧化产物的细胞毒作用会诱发动物肠道结构和功能的变化,如肠道中起屏障作用的潘氏细胞数量下降[2]和肠绒毛上皮细胞的周转加速[3],从而影响饲料能量的利用,降低肉鸡的生长速度和料肉比[4]。在试验条件下,氧化程度较高的油脂(过氧化值达180~210 meq/kg)对动物机体的伤害极大,而天然或人工合成的抗氧化剂可以通过提供氢原子或电子中止油脂氧化过程中的自由基链式反应。Lu等[4-5]研究表明,在使用氧化油脂的日粮中添加乙氧基喹啉能降低动物机体的氧化应激水平并保持良好的生产性能。在实际生产中,饲料厂通常只存在油脂轻度氧化的问题。因此,研究轻度氧化油脂对肉鸡肠道健康和生产性能的影响更具实用价值。
1 材料与方法
1.1 试验设计和日粮 试验采用单因素试验设计,将360只1日龄平均体重相似(约40.5 g)的罗斯肉鸡随机分成3组,每组6个重复,每个重复20只鸡。新鲜油脂组日粮中使用的油脂为新鲜鸡油,氧化油脂组使用轻度氧化鸡油,抗氧化剂组在氧化油脂组日粮基础上添加0.02%的爱克多TM(主要成分为乙氧基喹啉和没食子酸丙酯,由诺伟司国际贸易(上海)有限公司提供)。试验所用的鸡油为新鲜肉鸡腹脂通过加热熔出。新鲜鸡油除一部分冷冻储存外,其余部分则放入烘箱高温通气促进其氧化。氧化过程中每天按GB 5009.227-2016的方法测定其过氧化值,当其过氧化值超过0.20 g/100 g时即认为油脂氧化,可取出冷藏备用(本试验测定的过氧化值为0.75 g/100 g)。而新鲜鸡油的过氧化值经测定为0.15 g/100 g。
肉鸡采用单层笼养。试验期20 d。试验过程中自由采食和饮水。按饲养手册要求进行饲养管理和免疫。试验采用玉米-豆粕型粉状日粮,各处理组油脂的添加量为2.1%。基础日粮组成及营养成分见表1。
1.2 生长性能测定 以重复为单位,分别记录肉仔鸡1、10、20日龄的体重及饲料消耗量,并计算耗料增重比。1.3 脚胫色泽和脚垫评分 在试验第20 天将所有鸡的脚胫部分对比罗氏比色扇评分[6],并根据脚垫破损程度进行评分,分值范围为0~5分。
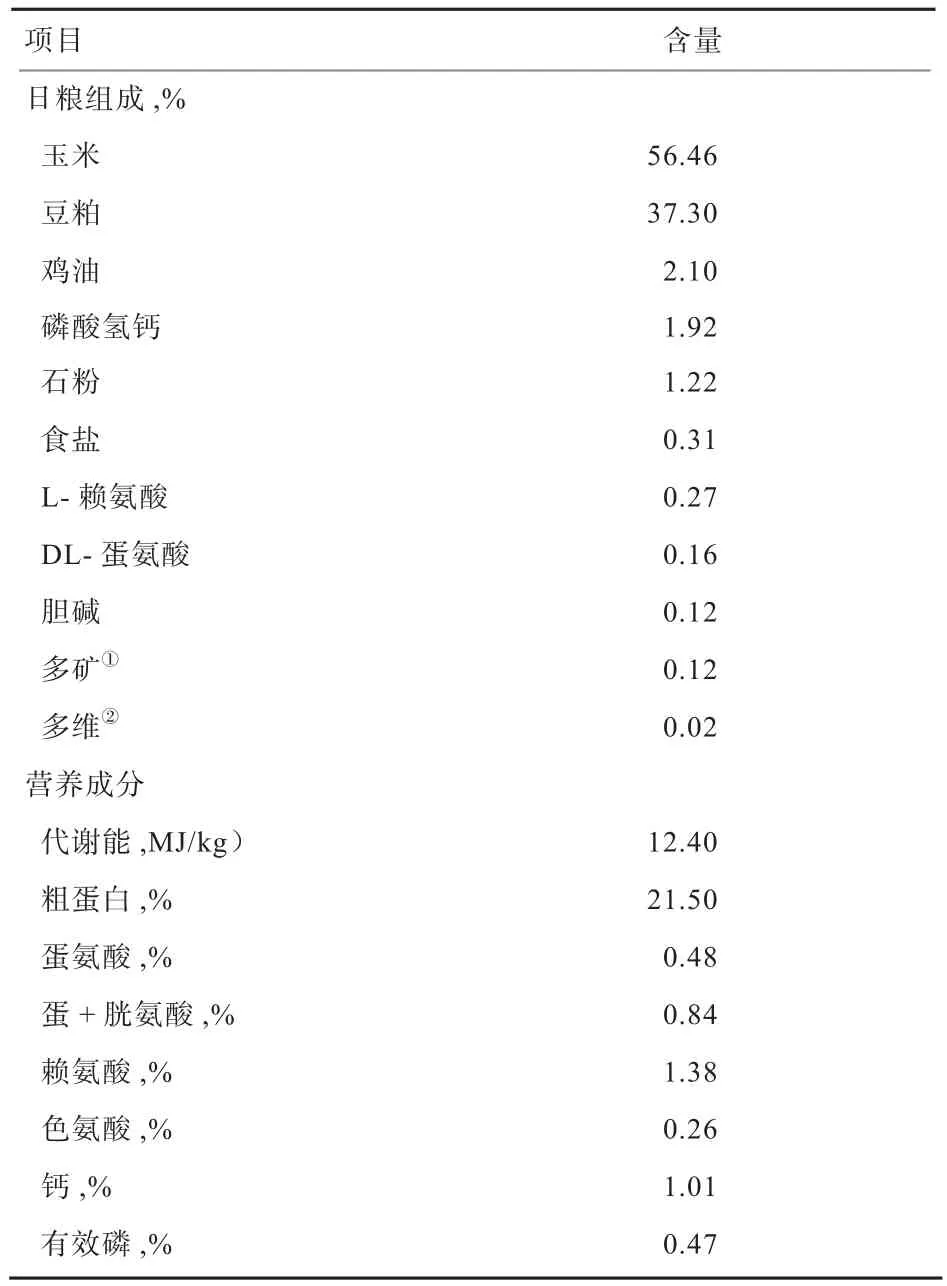
表1 基础日粮组成和营养成分
1.4 内脏指数和小肠长度 分别在试验第10天和第20天,每个重复随机抓取4只鸡,空腹称量活体重后处死。解剖取其肝脏、脾脏、心脏和去内容物的小肠,用吸水纸擦干表面后称量重量并计算其相对于活体重的脏器指数。测量小肠长度时先去除附着在肠道上的胰腺和脂肪,然后固定肠道的一端并轻拉另一端成直线,待肠道恢复形状不再回缩时,用直尺量取总长度。
1.5 小肠切片制作和形态学观察 剪取10日龄肉仔鸡的十二指肠、空肠和回肠肠段各0.5 cm,用10%的甲醛溶液固定后送样制成石蜡切片,进行HE染色。染色标本在50倍的显微镜下选取4个有完整绒毛的区域拍照并用Image-Pro Plus 5.0 图像分析软件测量绒毛高度、隐窝深度、绒毛宽度和肠壁厚度。
1.6 统计分析 使用SPSS 17.0软件进行统计分析,并采用单因素方差分析(One-Way ANOVA),结果以平均数±标准误表示,P<0.05认定为差异显著。
2 结 果
2.1 轻度氧化油脂对肉鸡生长性能、脚胫色泽和脚垫评分的影响 由表2可知,3个试验组肉仔鸡在0~10日龄和11~20日龄的平均日增重、平均日采食量和耗料增重比均无显著差异(P>0.05)。在11~20日龄,使用抗氧化剂比不使用抗氧化剂表现出改善肉鸡增重和耗料增重比的趋势(P=0.08)。3个试验组在脚胫色泽和脚垫评分上也无显著差异(P>0.05)。
2.2 轻度氧化油脂对脏器指数和小肠长度的影响 由表3可知,在0~10日龄和11~20日龄,各处理的肝脏指数、脾脏指数和小肠长度均无显著差异(P>0.05)。在0~10日龄,各处理的小肠指数和心脏指数均无显著差异(P>0.05),但在11~20日龄,氧化油脂组肉仔鸡的小肠指数显著高于其他2组(P<0.05),其心脏指数显著低于新鲜油脂组(P<0.05)。
2.3 轻度氧化油脂对小肠绒毛形态的影响 由图1可知,饲喂轻度氧化鸡油导致10日龄肉仔鸡空肠绒毛中出现不同程度的出血,且绒毛中的杯状细胞数量明显增多。其余两组肉鸡的空肠绒毛切片中未观察到此现象。由表4可知,氧化油脂组和抗氧化剂组的十二指肠绒毛高度和回肠绒毛宽度都大于新鲜油脂组,但只有抗氧化剂组肉鸡的十二指肠绒毛高度和回肠绒毛宽度与新鲜油脂组差异显著(P<0.05)。饲喂氧化油脂对小肠形态学的影响在空肠段表现得更为明显,新鲜油脂组肉鸡空肠的绒毛高度、隐窝深度和绒毛宽度均显著低于其他2组(P<0.05)。
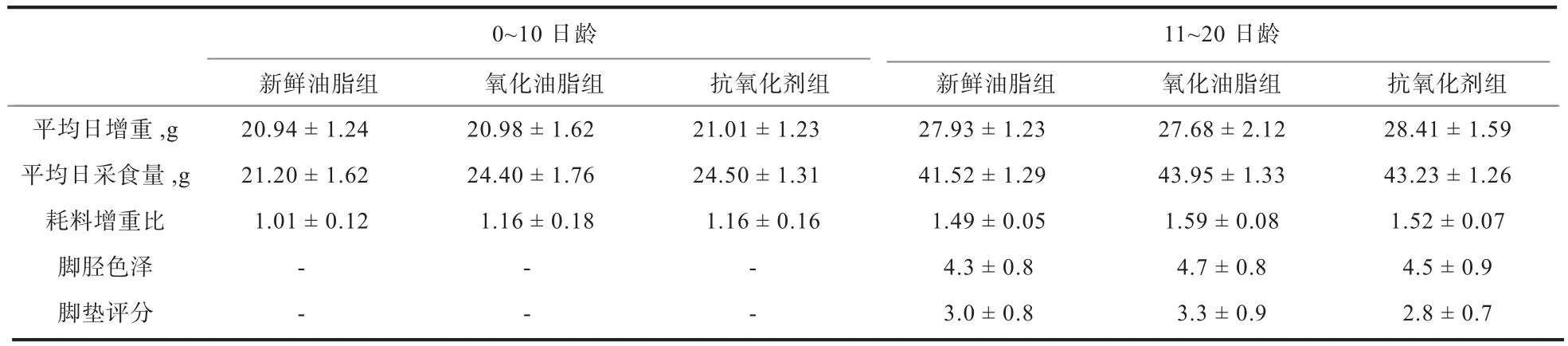
表2 轻度氧化油脂对肉仔鸡生长性能、脚胫色泽和脚垫评分的影响
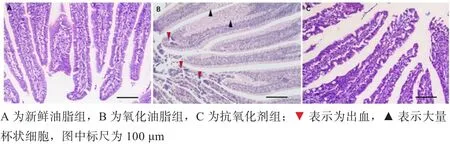
图1 各组10日龄肉鸡空肠绒毛切片
3 讨 论
3.1 轻度氧化油脂对肉仔鸡生长性能的影响 油脂氧化后不仅自身能值降低,而且生成一系列复杂的初级氧化产物和次级氧化产物,这些物质被动物摄食后会影响机体正常的生理功能。多数研究表明,使用氧化油脂会影响动物的生产性能,如大鼠摄食含氧化油脂的饲料后增重降低,严重者甚至死亡,在肉鸡、水貂和鱼类试验上都得到类似结果[7]。Dibner等[3]研究发现,给肉鸡饲喂含3%的过氧化值高达212 meq/kg油脂的日粮,严重降低了21日龄肉仔鸡的体重。本试验中,肉仔鸡饲料中添加2.1%的轻度氧化油脂并未显著影响平均日增重。另外,Lu等[4]在肉鸡日粮中添加3%的过氧化值高达180 meq/kg的氧化豆油,添加抗氧化剂较不添加显著提高了肉鸡21日龄体重。本试验中,氧化油脂组和抗氧化剂组的生长性能指标未见显著差异。田晓燕等[8]结合相关文献综述认为,肉鸡在采食低能量饲料时其采食量会增加。本试验中,含氧化油脂的饲料表现出提高采食量和降低饲料利用率的趋势,这很可能是由于氧化油脂组和抗氧化剂组饲料的实际能值因油脂氧化而降低。

表4 轻度氧化鸡油及抗氧化剂对10日龄肉仔鸡小肠形态的影响
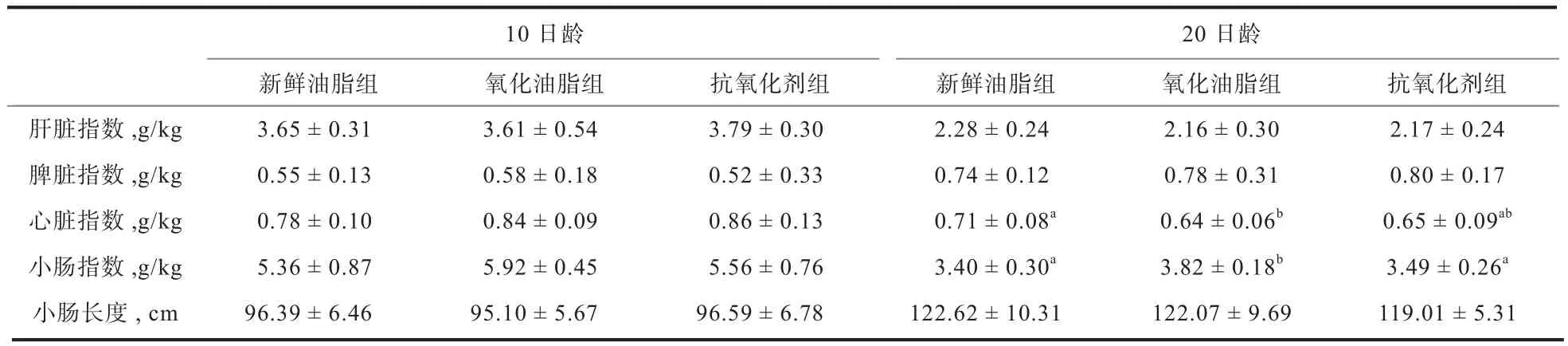
表3 轻度氧化鸡油及抗氧化剂对肉仔鸡脏器指数和小肠长度的影响
3.2 轻度氧化油脂对肉仔鸡脚胫着色和脚垫评分的影响饲料中的色素物质如类胡萝卜素等吸收进入血液并在肉鸡脚胫沉积着色。色素沉积和肠道吸收功能密切相关。Zhao等[6]研究表明,球虫严重感染的肠道会降低色素吸收入血的能力,从而在外观上表现出脚胫色泽评分下降。但本研究中未观察到各处理间脚胫色泽的显著变化,因此认为轻度氧化油脂并未大量破坏饲料中的色素物质或严重损伤肠道。
脚垫是肉鸡承重的主要部位,正常脚垫为黄色且柔软,轻度伤害则脚垫发干并略增厚,随着伤害程度的增加脚垫出现明显增厚和鳞片干燥发黑,严重时则脚垫肿胀、开裂出血。本试验中各处理肉仔鸡脚垫评分间没有显著差异但属于中度损伤,应该与使用氧化油脂无关,可能与笼养设备有关,因为相对笼养,地面平养对脚垫的损伤较小。
3.3 轻度氧化油脂对肉仔鸡内脏发育和肠道健康的影响油脂氧化的副产物会致使幼雏小肠等器官肥大[9],这可能是器官受氧化应激后的一种代偿性反应。本研究也发现氧化油脂组肉鸡在20日龄时小肠器官指数明显更大。Dibner等[3]研究发现,饲喂氧化油脂提高了小肠隐窝干细胞的周转率,其生命半衰期缩短至不足24 h。这说明食用了氧化油脂的动物其小肠组织的维持需要明显增加而饲料能量的利用效率会降低,其机理被认为与氧化油脂和细胞膜的互相作用有关。与饲喂氧化油脂的水貂出现肠绒毛萎缩不同[10],本研究结果显示轻度氧化油脂刺激肉仔鸡小肠绒毛变长变宽和隐窝变深。分析认为,少量的油脂氧化副产物可能会刺激隐窝干细胞加速分化进而促进绒毛发育,但即便是轻度氧化的油脂也仍然对小肠绒毛产生组织结构学上的损害,表现在氧化油脂组肉鸡空肠绒毛的出血和杯状细胞增多,说明氧化产物对肉雏鸡消化道的组织结构有损害作用[11]。
抗氧化剂如乙氧基喹啉可用于防止饲料和饲料原料中不饱和脂肪酸的氧化,其对熬制的动物脂肪更为有效[3]。饲料中添加乙氧基喹啉和没食子酸丙酯能提高动物的生产性能和稳定组织中的脂质成分,促氧化的金属离子会被没食子酸丙酯螯合,从而使油脂的稳定性提高,尤其在机体内部遭受氧化应激的情况下,这些成分会成为机体抗氧化系统的一部分[4]。机体抵抗氧化应激的第一步是启动抗氧化系统,抗氧化剂与自由基结合降低自由基对细胞的伤害,并在还原系统的辅助下恢复抗氧化剂的抗氧化能力[12]。本研究结果显示,在含轻度氧化油脂的日粮中添加抗氧化剂,一定程度上能在组织结构层面降低氧化油脂对小肠的损害,原因可能是抗氧化剂可以结合自由基阻止油脂被继续氧化,但并不能阻止已生成的氧化产物对组织的危害。
4 结 论
肉仔鸡饲料中使用2.1%轻度氧化鸡油不会对生长性能造成显著影响,但会造成空肠组织结构的改变,具体表现在空肠绒毛变长变宽和隐窝变深,以及小肠指数增加。
[1] Nitsan Z, Dvorin A, Zoref Z,et al. Effect of added soybean oil and dietary energy on metabolizable and net energy of broiler diets[J]. Br Poult Sci, 1997, 38(1): 101-106.
[2] Awada M, Soulage C O, Meynier A,et al. Dietary oxidized n-3 PUFA induce oxidative stress and inflammation: role of intestinal absorption of 4-HHE and reactivity in intestinal cells[J]. J Lipid Res, 2012, 53(10): 2069-2080.
[3] Dibner J J, Atwell C A, Kitchell M L,et al. Feeding of oxidized fats to broilers and swine: effects on enterocyte turnover,hepatocyte proliferation and the gut associated lymphoid tissue[J]. Anim Feed Sci Technol, 1996, 62(1): 1-13.
[4] Lu T, Harper A F, Zhao J,et al. Effects of a dietary antioxidant blend and vitamin E on growth performance, oxidative status, and meat quality in broiler chickens fed a diet high in oxidants[J]. Poult Sci, 2014, 93(7): 1649-1657.
[5] Lu T, Harper A F, Zhao J,et al. Supplementing antioxidants to pigs fed diets high in oxidants: I. Effects on growth performance, liver function, and oxidative status[J]. J Anim Sci,2014, 92(12): 5455-5463.
[6] Zhao J, Guo Y, Suo X,et al. Effect of dietary zinc level on serum carotenoid levels, body and shank pigmentation of chickens after experimental infection with coccidia[J]. Arch Anim Nutr, 2006, 60(3): 218-228.
[7] 任泽林, 霍启光, 孙艳玲. 油脂氧化对动物生产性能的影响[J]. 中国饲料, 2000(17): 19-21.
[8] 田晓燕, 姚军虎, 吴孝兵, 等. 择食饲喂对肉鸡生产性能和养分代谢的影响[J]. 中国家禽, 2004, 26(13): 17-20.
[9] 王改琴, 王恬. 油脂氧化酸败对畜禽机体功能影响及其氧化防控措施[J]. 中国油脂, 2010, 35(7): 46-50.
[10] 任泽林, 霍启光, 孙艳玲. 氧化油脂对动物机体生理生化机能及肉质的影响[J]. 中国饲料, 2000(15): 8-9.
[11] 王荣. 酸败油脂对肉雏鸡组织器官病理变化的影响[D]. 泰安: 山东农业大学, 2008.
[12] Lykkesfeldt J, Svendsen O. Oxidants and antioxidants in disease: Oxidative stress in farm animals[J]. Vet J, 2007,173(3): 502-511.
