白藜芦醇对奶牛性控冻精品质和体外受精能力的影响
2018-03-07李崇阳赵亚涵郝海生杜卫华庞云渭朱化彬赵学明
李崇阳,赵亚涵,郝海生,杜卫华,刘 岩,庞云渭,朱化彬,赵学明
(中国农业科学院北京畜牧兽医研究所,家畜胚胎工程与繁殖创新团队,北京100193)
性控冻精可用于动物群体扩繁以缩短遗传育种进程、提高畜牧生产效益[1]等。商业化的奶牛性控冻精用于人工授精,青年牛受胎率约为40%,远低于常规冻精(70%左右)[2]。另外,奶牛性控冻精体外受精能力显著低于常规精液,部分卵裂率仅为30%左右,囊胚率在10%左右[3]。
大量研究发现,性控冻精受精能力低与其制备过程产生的大量活性氧(ROS)紧密相关[4-6]。精子经历一系列分选过程,包括稀释、激光、分离加压及后续冷冻解冻,刺激精子产生大量ROS[6]。过量的ROS引起精子内抗氧化体系失衡,造成精子膜脂质过氧化、DNA片段化等结构氧化损伤,影响受精能力[7]。流式分选会除去富含抗氧化酶的精浆,导致内源性抗氧化酶不足,因此补充外源性抗氧化剂可有效去除过量的ROS[8]。研究证实,白藜芦醇是一种天然多酚抗氧化物质,可通过酚羟基给电子反应清除ROS[9],并抑制线粒体呼吸链中复合酶III活动,干扰ROS产生[10]。但白藜芦醇在性控冻精中抗氧化应用研究却非常少。本研究通过在奶牛性控冻精的洗精液和受精液中添加不同浓度的白藜芦醇,经获能孵育,分析白藜芦醇对精子ROS含量、丙二醛(MDA)含量、顶体完整性及体外受精能力的影响,从而筛选出白藜芦醇的有效浓度,为提高性控冻精质量和体外受精能力提供技术参考。
1 材料与方法
1.1 实验材料
1.1.1 试剂和仪器 除特殊说明,所有实验试剂均购于Sigma 公司(美国)。分光光度计(岛津,日本),激光共聚焦显微镜(Leika SP8,德国),荧光倒置显微镜(Nikon,日本)。
1.1.2 性控冻精的制备 委托山东奥克斯畜牧种业有限公司利用流式细胞术对荷斯坦奶牛精液进行X、Y精子分离,得到性控冻精用于本实验。
1.1.3 卵母细胞的获取 从河北屠宰场收集新鲜的牛卵巢,经过清洗放入含温生理盐水的保温杯中,2 h内运回实验室,通过真空蠕动泵抽出2~8 mm卵泡中卵母细胞,无菌环境下捡出优质卵母细胞,放入成熟液中培养。1.2 精子样品制备 将性控冻精从液氮中取出,投入温水中解冻,根据白藜芦醇浓度(0、10-3、10-4、10-5mol/L),将精子分成4个不同组别,分别转入含不同浓度白藜芦醇的洗精液的15 mL离心管中,1 500 r/min离心洗涤5 min,洗2次,弃掉上清,再分别加入含对应浓度白藜芦醇的受精液重悬,调整精子密度106个/mL,放入恒温培养箱孵育1.5 h后进行检测。
1.3 测定指标及方法
1.3.1 精子ROS水平 各组分别取100 μL重悬精液,加入1 μL DCFH-DA(工作液浓度10 μmol/L),恒温箱避光孵育20 min,1 500 r/min离心洗涤5 min,洗涤2次洗去多余的染料,加入100 μL PBS重悬沉淀,每次吸取5 μL的重悬精液滴于载玻片上,压片后置于倒置荧光显微镜下照相。ROS水平采用图像分析软件Image J进行荧光强度定量分析,并至少进行3次生物学重复。
1.3.2 精子MDA含量 各组分别取100 μL重悬精液,按照MDA检测试剂盒(南京建成)提供的试剂盒说明书,混匀加入各组反应试剂,沸水浴反应90 min,随后取出流水冷却,4 000 r/min离心洗涤10 min,取上清利用分光光度计在532 nm处,1 cm光径,双蒸水调零后,通过测定各管吸光度值计算MDA含量,并至少生物学重复3次。
1.3.3 精子顶体完整性 各组分别取100 μL重悬精液,加入2.5 μL FITC-PN(2 mg/mL),恒温箱避光孵育10 min,随后加入2.5 μL PI (1 mg/mL)恒温箱避光孵育5 min,随后1 500 r/min离心5 min,洗去多余染料,沉淀加100 μL PBS重悬,吸取5 μL重悬精液于载玻片上,压片后置于导致荧光显微镜下检测精子顶体完整性,并至少进行3次生物学重复。
1.3.4 精子体外受精能力 分别取各组重悬精液90 μL加入到含10 μL受精液的受精滴中,形成100 μL每孔的受精滴。将体外成熟培养22~24 h的卵母细胞吸出,用透明质酸酶消化吹打脱去部分卵丘细胞,终止液终止消化,挑选出剩余2~3层卵丘细胞的卵母细胞,在受精液中洗涤2遍,移入受精滴中,每个受精滴中放25枚卵母细胞,精卵共孵育16~18 h,脱去卵丘细胞,移入mCRlaa胚胎培养前期液中培养48 h,统计卵裂率,并将卵裂后的受精卵放入胚胎培养后期液中,隔天半量换液,第7天统计囊胚率,并至少进行3次生物学重复。
1.4 统计分析 所有实验组至少进行3次以上的生物学重复,结果以平均值±标准差表示,采用SAS 9.1对数据进行ANOVA显著性分析,P<0.05被认为是差异显著。
2 结 果
2.1 不同浓度白藜芦醇处理对性控冻精ROS含量的影响如表1所示,10-3、10-4、10-5mol/L白藜芦醇的处理组ROS含量显著低于对照组(P<0.05)。随着白藜芦醇浓度的降低,对ROS去除效果降低,10-3mol/L处理组与10-4mol/L处理组去除效果相近(P>0.05)。

表1 不同浓度的白藜芦醇处理对性控冻精ROS含量影响
2.2 不同浓度白藜芦醇处理对性控冻精MDA含量的影响 如表2所示, 10-3、10-4、10-5mol/L白藜芦醇处理组的MDA含量均显著低于对照组(P<0.05)。10-4mol/L白藜芦醇处理组MDA含量最低,显著低于其他3组(P<0.05)。

表2 不同浓度的白藜芦醇添加对性控冻精MDA的影响
2.3 不同浓度白藜芦醇处理对性控冻精顶体完整性的影响 如表3所示,各组间顶体完整的死精子率以及顶体损伤的死精子率差异均不显著(P>0.05)。10-3、10-4、10-5mol/L白藜芦醇处理组的顶体完整活精子比例显著高于对照组(P<0.05)。
2.4 不同浓度白藜芦醇处理对性控冻精体外受精影响由表4可以看出, 10-4mol/L 白藜芦醇处理组相较于0、10-3、10-5mol/L 白藜芦醇处理组可显著提高性控冻精的卵裂率和囊胚率(P<0.05)。
3 讨 论
在生殖生物学领域,哺乳动物受精机理研究越来越深入,精子质量往往决定着受精能力的高低,因此,准确判断和评估精子质量以及阐明精子质量的影响因素成为生殖领域的研究热点。哺乳动物的精子受精过程涉及一系列复杂的生物学过程,如精子获能、超活化、顶体反应和精卵结合等,精子功能相关蛋白在这些过程中往往发挥着重要作用,从而影响精子的受精能力[11-12]。近年来,大量研究证实,精子受精过程中生理浓度的ROS可通过对精子相关功能蛋白进行修饰[13],并通过氧化胆固醇促进精子获能,增强精子膜流动性继而提高精子受精能力[14]。然而过量的ROS会造成精子氧化损伤,性控冻精分选过程会产生大量的ROS,同时后续的冷冻解冻及离心等过程都会产生大量ROS,这些过量的ROS不仅仅损害精子膜结构、顶体膜完整性,并且还影响精子获能等过程,导致受精能力低下[6,15]。
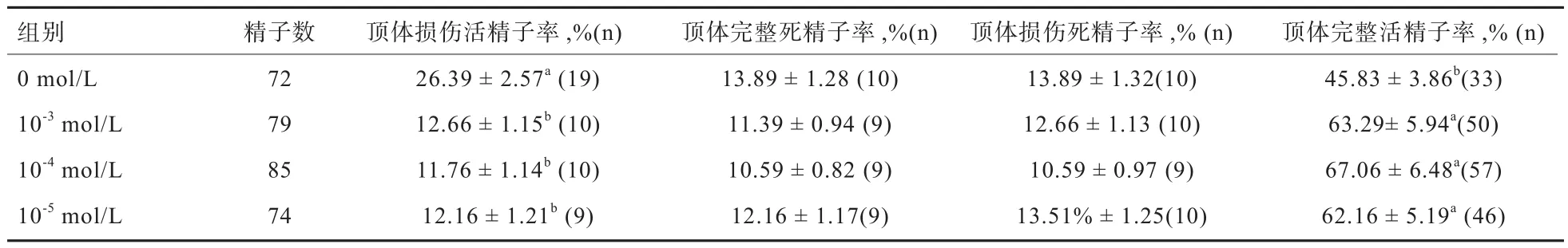
表3 不同浓度的白藜芦醇处理对性控冻精顶体完整性的影响
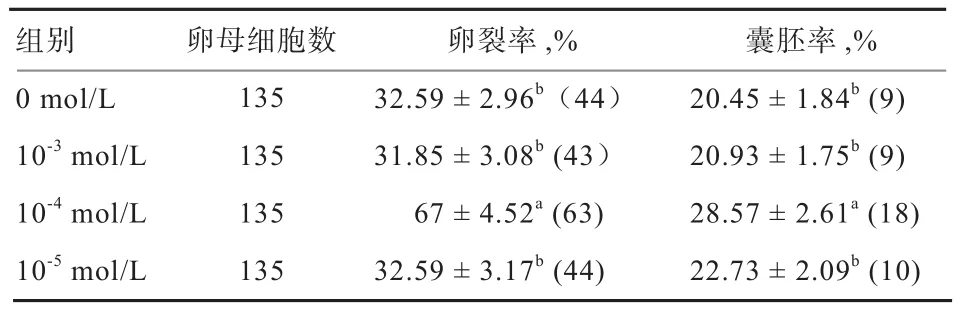
表4 不同浓度的白藜芦醇处理对性控冻精体外受精的影响
目前,许多常规精液抗氧化研究证实,通过添加外源性抗氧化剂可以有效去除多余的ROS,保护精子结构与功能,提高精子受精能力[9-10]。María等[9]和Berrougui等[10]报道,白藜芦醇具有高效的抗氧化功能,不仅可以直接清除ROS同时可抑制ROS的产生,并可通过调节精子内源性谷胱甘肽等抗氧化酶的活性发挥抗氧化作用。本研究表明,相较于对照组,10-3、10-4、10-5mol/L白藜芦醇处理均可有效降低ROS含量,并随着浓度的降低,ROS清除能力逐渐下降,其中10-3mol/L白藜芦醇处理对ROS的清除能力略高于10-4mol/L白藜芦醇组,但清除能力相近。这主要是由于白藜芦醇是一种高效抗氧化剂,在较低浓度时仍具有较高的抗氧化功能,高浓度的抗氧化剂固然可清除更多的ROS,但清除过多的ROS可能不利于受精过程。
Longobardi等[16]报道,精子质膜富含不饱和脂肪酸,极易受到氧化损伤,发生脂质过氧化反应(LPO),该反应是一个级联化反应,其终产物如MDA等会继续对细胞产生毒害作用,因此通过MDA的检测可以评估LPO反应及氧化损伤程度。本研究结果表明,添加10-4mol/L白藜芦醇可有效降低MDA含量,这主要是由于白藜芦醇处理可以有效降低ROS水平,进而抑制LPO反应,降低LPO终产物MDA的含量。
顶体是精子特有的结构之一,受精过程中顶体反应的发生是受精成功的前提条件,然而过量的ROS可造成精子胞内钙离子增加,提前诱发顶体反应,造成这些顶体损伤的精子虽然活力等参数正常,但无法完成受精,因此检测精子顶体完整性是评判精子受精能力的重要指标[17]。本研究结果表明,不同浓度白藜芦醇的处理对顶体损伤的死精子或顶体完整的死精子比例都没有显著影响,但能显著提高顶体完整的活精子比例,并降低顶体损伤活精子比例,这与Silva等[18]在羊上的结果相一致。造成这些结果的原因主要是白藜芦醇具有高效抗氧化能力,清除过量ROS,从而抑制了顶体损伤。
另外,Longobardi等[16]报道,5×10-4mol/L白藜芦醇通过提高水牛精子膜稳定性,降低获能相关变化和ROS含量从而可以提高精子受精能力。本研究发现,10-4mol/L白藜芦醇处理可显著提高性控冻精受精后的卵裂率和囊胚率,即可显著提高性控冻精受精能力,与前人的研究符合。
4 结 论
本实验结果表明,白藜芦醇是一种高效抗氧化物质,在解冻后的性控冻精中添加10-4mol/L的白藜芦醇可以有效降低ROS含量,从而有效抑制精子膜脂质过氧化反应,降低MDA等副产物对精子的毒害作用,并且有效抑制精子过早发生顶体反应,进而提高性控冻精的质量和受精能力。
[1] Li X X, Yang X G, Lu Y Q,et al. Protective effects of melatonin against oxidative stress in flow cytometry-sorted buffalo sperm[J]. Reprod Domest Anim, 2012, 47(2): 299-307.
[2] 郝海生, 赵明礼, 朱化彬, 等. 性控冷冻精液人工授精对青年奶牛繁殖性能的影响[J]. 畜牧与兽医, 2016, 48(8): 52 -54.
[3] Zhao X M, Ren J J, Zhao S J,et al. Apoptosis-like events andin vitrofertilization capacity of sex-sorted bovine sperm[J].Reprod Domest Anim, 2014, 49(4): 543-549.
[4] Chang L B, Chou C J, Shiu J H,et al. Artificial insemination of Holstein heifers with sex-sorted semen during the hot season in a subtropical region[J]. Trop Anim Health Prod, 2017, 49(6):1157-1162.
[5] Seunghyung L, Yong-Seung L, Sang-Hee L,et al. Effect of methyl-beta-cyclodextrin on the viability and acrosome damage of sex-sorted sperm in frozen-thawed bovine semen[J]. J Biol Res (Thessalon), 2016, 23 (4): 43-49.
[6] Inaba Y, Abe R, Geshi M,et al. Sex-sorting of spermatozoa affects developmental competence ofin vitrofertilized oocytes in a bull-dependent manner[J]. J Reprod, 2016, 62(5): 451-456.
[7] Morielli T, O’Flaherty C. Oxidative stress impairs function and increases redox protein modi fications in human spermatozoa[J].Reproduction, 2015, 149(1): 113-123.
[8] Zhu Z D, Fan X T, Lv Y H,et al. Vitamin E analogue improves rabbit sperm quality duringthe process of cryopreservation through its antioxidative action[J]. PLoS One, 2015, 10(12):e0145383.
[9] María A M , Jeannett A I, Germán C C,et al. Protective effect of resveratrol on biomarkers of oxidative stress induced by iron/ascorbate in mouse spermatozoa[J]. Nutrients, 2014 , 6(2): 489-503.
[10] Berrougui H, Grenier G, Loued S,et al. A new insight into resveratrol as an atheroprotective compound: inhibition of lipid peroxidation and enhancement of cholesterol efflux[J].Atherosclerosis, 2009, 207(2): 420-427.
[11] 陈志林, 冯美莹, 陈预明, 等. 精子功能相关的蛋白质调控受精过程的研究进展[J]. 遗传, 2014, 36(8): 747-755.
[12] Aitken R J, Baker M A, Nixon B. Are sperm capacitation and apoptosis the opposite ends of a continuum driven by oxidative stress?[J]. Asian J Androl, 2015, 17(4): 633-639.
[13] Du Plessis S S, Agarwal A, Halabi J,et al. Contemporary evidence on the physiological role of reactive oxygen species in human sperm function[J]. J Assist Reprod Genet, 2015, 32(4):509-520.
[14] Del Olmo E, García-Álvarez O, Maroto-Morales A,et al.Oestrous sheep serum balances ROS levels to supplyin vitrocapacitation of ram spermatozoa[J]. Reprod Domest Anim,2016, 51(5): 743-50.
[15] Tvrdá E, Kováčik A, Tušimová E,et al. Antioxidant efficiency of lycopene on oxidative stress - induced damage in bovine spermatozoa[J]. J Anim Sci Biotechnol, 2016, 7(1): 50.
[16] Longobardi V, Zullo G, Salzano A,et al. Resveratrol prevents capacitation-like changes and improvesin vitrofertilizing capability of buffalo frozen-thawed sperm[J]. Theriogenology,2017, 88: 1-8.
[17] 杜鹏, 黄志承, 史哲, 等. 精子顶体反应率与精液相关参数之间关系的研究[J]. 临床医学工程, 2013, 26(7): 34 -46.
[18] Silva E C, Cajueiro J F, Silva S V,et al. Effect of antioxidants resveratrol and quercetin onin vitroevaluation of frozen ram sperm[J]. Theriogenology, 2012, 77(8): 1722-1726 .
